
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •Определение молекулярных масс газообразных веществ
- •Основные стехиометрические законы.
- •Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •Волновые свойства электрона. Квантовые числа s-, p-, d-, f-состояния электрона. Электронные орбитали. Проскок электрона.
- •Принцип Паули. Определение электронной емкости уровней, подуровней и орбиталей. Правило Хунда.
- •Порядок заполнения подуровней электронами. Правила Клечковского, электронные и электронографические формулы.
- •Периодический закон д.И. Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер. Электронные аналоги.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Оксиды. Классификация, способы получения, химические свойства.
- •Кислоты. Классификация, способы получения, химические свойства.
- •Основания. Классификация, способы получения, химические свойства.
- •Соли. Классификация, способы получения, химические свойства.
- •Образование химической связи. Энергия связи и длина связи. Типы химической связи. Межмолекулярное взаимодействие. Водородная связь.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
- •Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Уравнять окислительно-восстановительную реакцию ионно-электронным методом.
- •Направленность ковалентной связи. Σ и π-связи. Гибридизация атомных орбиталей.
- •Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
- •Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
- •Система. Фаза. Компонент. Параметры системы. Правило фаз Гиббса.
- •Функции состояния: внутренняя энергия и стандартная энтальпия образования химических веществ
- •Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчеты.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Теплоемкость.
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии. Изменение энтропии при химических процессах и фазовых переходах.
- •Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Третий закон термодинамики. Постулат Планка.
- •Постулат Планка
- •Условия самопроизвольного протекания химических реакций.
- •Константа химического равновесия. Расчет кр и кс.
- •Скорость химической реакции. Закон действующих масс. Константы скорости гомогенной и гетерогенной химических реакций. Связь константа скорости с константой равновесия
- •Закон действующих масс (з.Д.М.)
- •Кинетическая классификация по степени сложности. Молекулярность и порядок реакции. Обратимые и необратимые реакции. Классификация реакций по степени сложности
- •Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Зависимость скорости реакции от температуры.
- •Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.
- •Катализ. Сущность гомогенного и гетерогенного катализа. Стадии гетерогенного катализа.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Способы выражения концентраций растворов.
- •Способы выражения концентрации растворов
- •Растворимость. Произведение растворимости. Изменение энтальпии и энтропии при растворении.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях. Физические и химические процессы при растворении.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Законы Рауля.
- •Э лектролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •Константа диссоциации. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Окислительно-восстановительные реакции. Ионно-электродный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •Возникновение скачка потенциала на границе раздела "металл-раствор".
- •Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нерста. Стандартный потенциал. Ряд напряжений металла.
- •Типы электродов. Стеклянный электрод.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току
- •Коррозия металлов. Химическая и электрохимическая коррозия
- •Основные методы борьбы с коррозией. Почвенная коррозия.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Сущность термографического анализа. Основные принципы построения диаграммы плавкости бинарных систем.
- •Диаграмма состояния однокомпонентной системы на примере воды.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Диаграмма плавкости непрерывных твердых растворов. Правило рычага.
- •Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •Диаграммы плавкости бинарных систем с образованием химических соединений.
- •Адсорбция и абсорбция. Хемосорбция.
- •Агрегатные состояния вещества. Стеклообразное и жидкокристаллическое состояния вещества.
Кинетическая классификация по степени сложности. Молекулярность и порядок реакции. Обратимые и необратимые реакции. Классификация реакций по степени сложности
Изолированные реакции при их протекании образуются продукты только одного типа.
Параллельные реакции в ходе них взятые вещества одновременно реагируют в двух или более направлениях.
Схематично:
![]()
Наблюдаемая
скорость реакции: ![]()
Для параллельной мономолекулярной реакции:
![]()
можно
написать ![]() ,
где х - количество молей А, израсходованных
к моменту времени, "а"
число молей А в начальный момент.
,
где х - количество молей А, израсходованных
к моменту времени, "а"
число молей А в начальный момент.
После интегрирования:
Сопряженные реакции - совместные реакции вида:
![]()
Последовательные (многоступенчатые) реакции:
![]()
Обратимые и необратимые реакции.
Наблюдаемая
скорость обратимой реакции ![]()
 Существуют
реакции, в которых доминирует процесс,
идущий в одном направлении, поскольку
продукты реакции быстро удаляются из
системы: выпадение осадка, газа и т.д.
Существуют
реакции, в которых доминирует процесс,
идущий в одном направлении, поскольку
продукты реакции быстро удаляются из
системы: выпадение осадка, газа и т.д.
В какой-то мере эти реакции все же обратимы, их можно считать лишь практически необратимыми.
Для
совершенно необратимых реакций скорости
прямого и обратного процессов несоизмеримы:
![]()
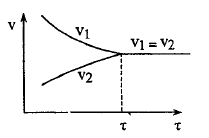
Когда скорости сравниваются, устанавливается подвижное равновесие
![]()
При неизменных условия химическое равновесие может сохраняться сколь угодно долго.
Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Зависимость скорости реакции от температуры.
Согласно эмпирическому правилу Вант-Гоффа, повышение температуры на каждые 10 увеличивает скорость реакции в 2-4 раза.
Увеличение скорости реакции нельзя объяснить увеличением скоростей движения молекул и учащением вследствие этого столкновений.
С ростом температуры происходит перераспределение энергии между молекулами таким образом, что резко возрастает число активных молекул, обладающих некоторым избытком энергии (энергией активации).
С.
Аррениус установил: ![]() , где к - константа скорости реакции, а
А и В - индивидуальные постоянные,
характерные для данной реакции.
, где к - константа скорости реакции, а
А и В - индивидуальные постоянные,
характерные для данной реакции.
![]()
![]() т.е.
представлена как разность двух
энергетических величин, относящихся к
прямой и обратной реакциям.
т.е.
представлена как разность двух
энергетических величин, относящихся к
прямой и обратной реакциям.
![]()
Допущения,
сделанные Аррениусом: ![]()
![]()
Здесь
Е1
и Е2
- энергии активации прямой и обратной
реакции. Ранее имели:
,
следовательно ![]()
Рассмотрим график изменения энергии в процессе протекания экзотермической реакции: A + B = C + D
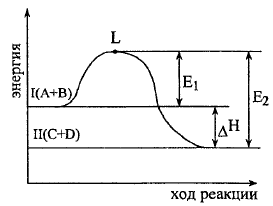 Уровень
L
отвечает тому наименьшему запасу энергии
у молекул, который необходим для их
результативного столкновения. Разность
уровней L
и I
- это энергия активации прямой реакции,
L
и II-
обратной.
Уровень
L
отвечает тому наименьшему запасу энергии
у молекул, который необходим для их
результативного столкновения. Разность
уровней L
и I
- это энергия активации прямой реакции,
L
и II-
обратной.
Для
эндотермической реакции: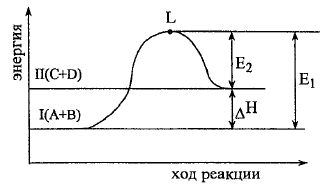
Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.
С ростом температуры происходит перераспределение энергии между молекулами так, что резко возрастает число активных молекул, обладающих некоторым избытком энергии (энергией активации). Большая часть поступающей в систему энергии тратится на ослабление внутримолекулярных связей, что и делает молекулы активными.
С. Аррениус установил опытным путем зависимость:
![]() где к – константа скорости, А и В –
индивидуальные постоянные, характерные
для данной реакции.
где к – константа скорости, А и В –
индивидуальные постоянные, характерные
для данной реакции.
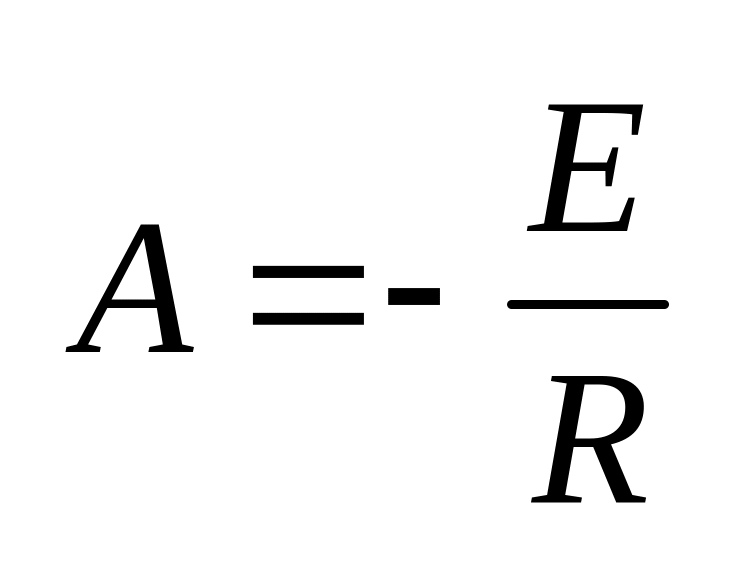 (энергия активации, постоянная – 8,31).
(энергия активации, постоянная – 8,31).
Графический расчет энергии активации.
По опытным данным строят график
зависимости
![]() от обратной температуры. Если закон
выполняется, на графике должна получиться
прямая линия. Тангенс угла, образуемого
Ох и прямой,
от обратной температуры. Если закон
выполняется, на графике должна получиться
прямая линия. Тангенс угла, образуемого
Ох и прямой,
![]()
Аналитический расчет энергии активации.
Полагая, что в небольшом интервале
![]() энергия постоянна, можно написать:
энергия постоянна, можно написать:
![]()
![]()
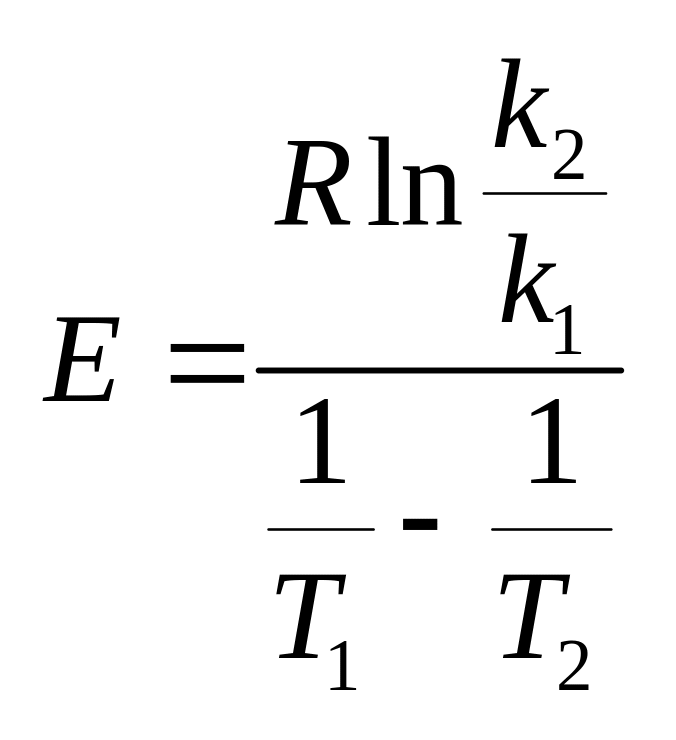
Энергия активации зависит от температуры.
Чем меньше энергия, тем легче идет реакция и тем больше скорость реакции при данной температуре.
Реакции с энергией меньше
![]() протекают практически мгновенно
протекают практически мгновенно
