
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •Определение молекулярных масс газообразных веществ
- •Основные стехиометрические законы.
- •Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •Волновые свойства электрона. Квантовые числа s-, p-, d-, f-состояния электрона. Электронные орбитали. Проскок электрона.
- •Принцип Паули. Определение электронной емкости уровней, подуровней и орбиталей. Правило Хунда.
- •Порядок заполнения подуровней электронами. Правила Клечковского, электронные и электронографические формулы.
- •Периодический закон д.И. Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер. Электронные аналоги.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Оксиды. Классификация, способы получения, химические свойства.
- •Кислоты. Классификация, способы получения, химические свойства.
- •Основания. Классификация, способы получения, химические свойства.
- •Соли. Классификация, способы получения, химические свойства.
- •Образование химической связи. Энергия связи и длина связи. Типы химической связи. Межмолекулярное взаимодействие. Водородная связь.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
- •Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Уравнять окислительно-восстановительную реакцию ионно-электронным методом.
- •Направленность ковалентной связи. Σ и π-связи. Гибридизация атомных орбиталей.
- •Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
- •Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
- •Система. Фаза. Компонент. Параметры системы. Правило фаз Гиббса.
- •Функции состояния: внутренняя энергия и стандартная энтальпия образования химических веществ
- •Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчеты.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Теплоемкость.
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии. Изменение энтропии при химических процессах и фазовых переходах.
- •Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Третий закон термодинамики. Постулат Планка.
- •Постулат Планка
- •Условия самопроизвольного протекания химических реакций.
- •Константа химического равновесия. Расчет кр и кс.
- •Скорость химической реакции. Закон действующих масс. Константы скорости гомогенной и гетерогенной химических реакций. Связь константа скорости с константой равновесия
- •Закон действующих масс (з.Д.М.)
- •Кинетическая классификация по степени сложности. Молекулярность и порядок реакции. Обратимые и необратимые реакции. Классификация реакций по степени сложности
- •Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Зависимость скорости реакции от температуры.
- •Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.
- •Катализ. Сущность гомогенного и гетерогенного катализа. Стадии гетерогенного катализа.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Способы выражения концентраций растворов.
- •Способы выражения концентрации растворов
- •Растворимость. Произведение растворимости. Изменение энтальпии и энтропии при растворении.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях. Физические и химические процессы при растворении.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Законы Рауля.
- •Э лектролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •Константа диссоциации. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Окислительно-восстановительные реакции. Ионно-электродный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •Возникновение скачка потенциала на границе раздела "металл-раствор".
- •Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нерста. Стандартный потенциал. Ряд напряжений металла.
- •Типы электродов. Стеклянный электрод.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току
- •Коррозия металлов. Химическая и электрохимическая коррозия
- •Основные методы борьбы с коррозией. Почвенная коррозия.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Сущность термографического анализа. Основные принципы построения диаграммы плавкости бинарных систем.
- •Диаграмма состояния однокомпонентной системы на примере воды.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Диаграмма плавкости непрерывных твердых растворов. Правило рычага.
- •Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •Диаграммы плавкости бинарных систем с образованием химических соединений.
- •Адсорбция и абсорбция. Хемосорбция.
- •Агрегатные состояния вещества. Стеклообразное и жидкокристаллическое состояния вещества.
Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
Донорно-акцепторная связь (ДАС) – разновидность ковалентной связи.
Выделяют соед.1-го порядка (или валентно-насыщенные соед.)
Пример: H2O,
AgCl, NH3,
HCl, KJ, CuSO4,
FeCl3
и т.д. Реагируя друг с другом дают
соединения высшего порядка (или
комплексные соединений).
![]()
![]() В
комплексных соединениях проявляются
ДАС.
В
комплексных соединениях проявляются
ДАС.
Рассмотрим пример:
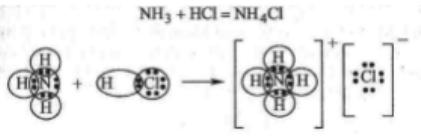
Азот в NH3 – донор, водород в HCl–акцептор.
Комплексные соединения–соединения высшего порядка, возникающие из соединений 1-го порядка без образования новых электронных пар за счет проявления хотя бы одной ДАС.
Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
Основные положения метода молекулярных орбиталей
Образование химических связей является результатом перехода электронов с атомных орбит на новые, называемые МО, и обладающие энергией, определяемой всеми атомами молекулы.
Каждой молекулярной орбитали соответствует определенная энергия, приближенно характеризуемая энергией удаления электрона с данной молекулярной орбитали, энергией ионизации молекулы.
Электроны в молекуле не локализованы в межядерных пространствах, они могут перемещаться в электрическом поле нескольких ее ядер.
Состояние каждого электрона описывается одноэлектронной молекулярной волновой функцией, характеризуемой определенным набором квантовых чисел.
Распределение электронов по новым энергетическим уровням или МО производится в соответствии с принципом наименьшей энергии, правилами Паули и Хунда.
Если переход электронов на МО энергетически выгоден, то химическая связь возникает.
Молекулярная орбита, получающаяся путем вычитания перекрывающихся частей АО, не включает пространства между ядрами. Она имеет более высокую энергию, чем первоначальные АО, и называется разрыхляющей МО.
Молекулярная орбита, которая получается от сложения двух s-орбит, занимает пространство между двумя ядрами; ее называют связывающей МО; ей соответствует энергия, более низкая, чем каждой из двух s-АО, от которых она произошла.
Э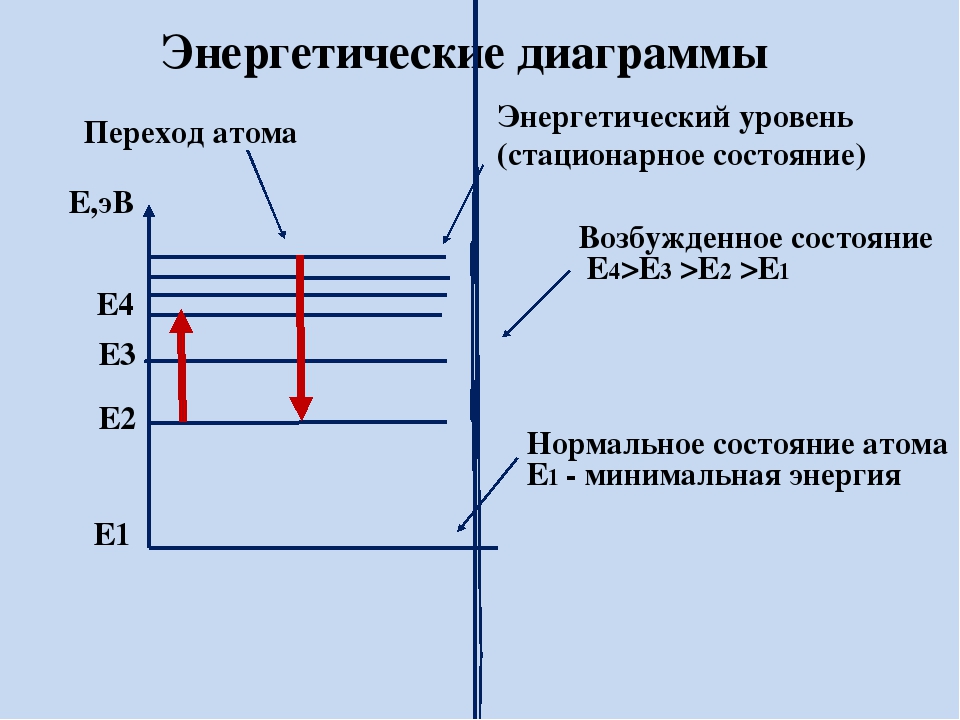 нергетическая диаграмма атома
— это схематическое изображение
орбиталей с учетом их энергии.
нергетическая диаграмма атома
— это схематическое изображение
орбиталей с учетом их энергии.
Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
Металлическая химическая связь— связь между положительными ионами в кристаллах металлов, осуществляемая за счет притяжения электронов, свободно перемещающихся по кристаллу. Добиться состояния одной молекулы металла можно только при очень высоких температурах — когда металл перейдет в газообразное состояние.
Металлическая связь обусловливает характерные свойства металлов:
теплопроводность (перенос теплоты частицами — в данном случае — электронами);
электропроводность;
все вещества — твердые (кроме некоторых щелочных металлов);
высокие температуры плавления и кипения;
характерный металлический блеск
высокая плотность вещества (кроме щелочных металлов);
пластичность — это смещение слоев кристаллической решетки.
Система. Фаза. Компонент. Параметры системы. Правило фаз Гиббса.
Система – это тело или группа тел, находящихся во взаимодействии, которые мысленно выделены из окружающей среды. Различают гомогенные и гетерогенные системы. В первых из них нет поверхностей раздела, отделяющих друг от друга части системы, различающиеся по свойствам; во-вторых – есть такие.
У изолированных систем нет обмена энергией и веществом с окружающей средой; у закрытых систем нет только массообмена; у открытых систем есть и энерго, и массообмен с окружающей средой.
Фаза – совокупность всех гомогенных частей системы, одинаковых по составу и по всем химическим и физическим свойствам, не зависящим от количества вещества, и отграниченных друг от друга поверхностями раздела, на которых все свойства фазы резко, скачком, меняются.
Гомогенные системы – однофазны, гетерогенные системы – многофазны.
Параметры – величины, определяющие состояние системы. Интенсивные параметры не зависят от массы или числа частиц в системе (давление, температура и другие), экстенсивные – зависят (объем, энергия и другие).
Компоненты — независимые составляющие вещества системы, то есть индивидуальные химические вещества, которые необходимы и достаточны для составления данной термодинамической системы, допускают выделение из системы и независимое существование вне её. Изменения масс компонентов выражают все возможные изменения в химическом составе системы, а масса (количество вещества, число частиц) каждого вещества, выбранного в качестве компонента, не зависит от масс (количеств вещества, числа частиц) других компонентов.
Правило фаз Гиббса-показывает количественную зависимость между числом степеней свободы системы (С), числом независимых компонентов (К) и числом фаз (Ф).
Если на равновесие в системе влияет n внешних факторов, то правило фаз Гиббса запишется следующим образом:
С К Ф n (1)
При С = 0 в равновесии находится наибольшее число фаз. В общем случае, число фаз не может быть больше К + n (при этом С = 0):
Ф К n (2)
Правило фаз Гиббса для однокомпонентной системы:
в равновесной термодинамической системе, на которую из внешних факторов оказывают влияние только температура и давление, число термодинамических степеней свободы равно числу компонентов минус число фаз плюс два.
С К Ф 2 (3)
Для двухкомпонентной системы (К = 2) диаграммы рассматривают без учета газовой фазы, то есть считают, что р = const, а изменяющимся внешним фактором считают только температуру (n=1). Тогда правило фаз Гиббса запишется следующим образом: С 2Ф 1 3Ф (4)
Правилу фаз Гиббса не подчиняются коллоидные системы, в которых дисперсная фаза микроскопических размеров. Правило фаз не применимо к неравновесным метастабильным состояниям (переохлажденная вода, перегретый пар и т.д.).
