
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •Определение молекулярных масс газообразных веществ
- •Основные стехиометрические законы.
- •Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •Волновые свойства электрона. Квантовые числа s-, p-, d-, f-состояния электрона. Электронные орбитали. Проскок электрона.
- •Принцип Паули. Определение электронной емкости уровней, подуровней и орбиталей. Правило Хунда.
- •Порядок заполнения подуровней электронами. Правила Клечковского, электронные и электронографические формулы.
- •Периодический закон д.И. Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер. Электронные аналоги.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Оксиды. Классификация, способы получения, химические свойства.
- •Кислоты. Классификация, способы получения, химические свойства.
- •Основания. Классификация, способы получения, химические свойства.
- •Соли. Классификация, способы получения, химические свойства.
- •Образование химической связи. Энергия связи и длина связи. Типы химической связи. Межмолекулярное взаимодействие. Водородная связь.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
- •Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Уравнять окислительно-восстановительную реакцию ионно-электронным методом.
- •Направленность ковалентной связи. Σ и π-связи. Гибридизация атомных орбиталей.
- •Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
- •Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
- •Система. Фаза. Компонент. Параметры системы. Правило фаз Гиббса.
- •Функции состояния: внутренняя энергия и стандартная энтальпия образования химических веществ
- •Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчеты.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Теплоемкость.
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии. Изменение энтропии при химических процессах и фазовых переходах.
- •Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Третий закон термодинамики. Постулат Планка.
- •Постулат Планка
- •Условия самопроизвольного протекания химических реакций.
- •Константа химического равновесия. Расчет кр и кс.
- •Скорость химической реакции. Закон действующих масс. Константы скорости гомогенной и гетерогенной химических реакций. Связь константа скорости с константой равновесия
- •Закон действующих масс (з.Д.М.)
- •Кинетическая классификация по степени сложности. Молекулярность и порядок реакции. Обратимые и необратимые реакции. Классификация реакций по степени сложности
- •Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Зависимость скорости реакции от температуры.
- •Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.
- •Катализ. Сущность гомогенного и гетерогенного катализа. Стадии гетерогенного катализа.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Способы выражения концентраций растворов.
- •Способы выражения концентрации растворов
- •Растворимость. Произведение растворимости. Изменение энтальпии и энтропии при растворении.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях. Физические и химические процессы при растворении.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Законы Рауля.
- •Э лектролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •Константа диссоциации. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Окислительно-восстановительные реакции. Ионно-электродный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •Возникновение скачка потенциала на границе раздела "металл-раствор".
- •Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нерста. Стандартный потенциал. Ряд напряжений металла.
- •Типы электродов. Стеклянный электрод.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току
- •Коррозия металлов. Химическая и электрохимическая коррозия
- •Основные методы борьбы с коррозией. Почвенная коррозия.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Сущность термографического анализа. Основные принципы построения диаграммы плавкости бинарных систем.
- •Диаграмма состояния однокомпонентной системы на примере воды.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Диаграмма плавкости непрерывных твердых растворов. Правило рычага.
- •Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •Диаграммы плавкости бинарных систем с образованием химических соединений.
- •Адсорбция и абсорбция. Хемосорбция.
- •Агрегатные состояния вещества. Стеклообразное и жидкокристаллическое состояния вещества.
Возникновение скачка потенциала на границе раздела "металл-раствор".
Если пластину любого металла погрузить в воду или раствор электролита, содержащий ионы этого металла, то небольшая часть металла перейдет в раствор, в форме положительно заряженных ионов, а сама пластина, концентрируя на себе избыток свободных электронов, приобретает отрицательный заряд. Такому переходу содействует связывание ионов металла с молекулами воды (растворителя).В итоге устанавливается равновесие
Me ↔ Me2+ + 2e
Me2+ + m H2O ↔ Me2+ · m H2O
Me + m H2O ↔ Me2+ · m H2O +2e
Положительно заряженные ионы Me+2, перешедшие в раствор, концентрируются у поверхности пластины, приобретающей отрицательный заряд, в результате возникает двойной электрический слой (ДЭС), обусловливающий резкий скачок электрического потенциала на границе металл - раствор электролита.
Эту разность электрических потенциалов или скачок потенциала на границе металл-раствор электролита называют электродным потенциалом.
Величина электродного потенциала зависит от природы металла, концентрации, точнее активности ионов металла в растворе и температуры.
Математически эта зависимость выражается уравнением В.Г.Нернста (1888).
EMe = E0Me + (R ∙T/n · F) / ln аMen+,
а в случае разбавленных растворов полностью диссоциирующих солей данного металла
ЕMe = E0Me + (R∙T/n · F) / ln [Men+ ],
где E0Me- стандартный электродный потенциал, R- универсальная газовая постоянная, F- постоянная Фарадея, n - заряд иона металла, аMe,n+ , [ Men+] – активность или концентрация ионов металла (моль\л)
После перехода от натурального логарифма к десятичному и подстановки значений
R=8,314Дж\моль· К
T=298,15 К
F=96500 Кл, точнее 96487 Кл уравнение примет вид EMe = E0Me + 0,0592/n ·lg [Men+]
Равновесный электродный потенциал.
Потенциал, отвечающий состоянию равновесия, когда скорость перехода ионов в раствор равна скорости их осаждения – равновесный потенциал. Для всех металлов, погружаемых в чистую воду, качественно наблюдается одинаковая картина: металл заряжается отрицательно, прилегающий слой жидкости – положительно. Данный скачок можно
охарактеризовать реакцией:
![]() Рассмотрим
погружение в раствор активного и
неактивного металла.
Рассмотрим
погружение в раствор активного и
неактивного металла.
Активный металл посылает большое число ионов в раствор, равновесная концентрация его ионов трудно достижима => металл будет заряжаться отрицательно.
Равновесная концентрация очень мала => электроду сообщается положительный заряд, а оставшиеся анионы создают отрицательный заряд у прилегающего слоя.
Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
Гальванической элемент илюбое устройство, дающее возможность получать электрический ток за счёт проведения той или иной химической реакции.
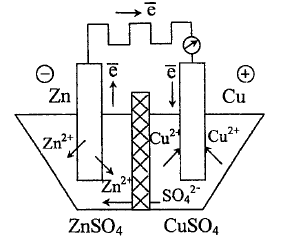 Рассмотрим
систему, в которой медь и цинк в воде
пластинок помещены в растворы своих
солей, разделённых пористой керамической
перегородкой
диафрагмой.
При разомкнутой внешней цепи на обоих
электродах устанавливаются равновесные
потенциалы, различающиеся по величине
и по знаку. При замыкании внешней цепи
на некоторое сопротивление электроны
от цинкового электрода получают
возможность перемещаться по внешнему
проводнику к медному электроду.
Рассмотрим
систему, в которой медь и цинк в воде
пластинок помещены в растворы своих
солей, разделённых пористой керамической
перегородкой
диафрагмой.
При разомкнутой внешней цепи на обоих
электродах устанавливаются равновесные
потенциалы, различающиеся по величине
и по знаку. При замыкании внешней цепи
на некоторое сопротивление электроны
от цинкового электрода получают
возможность перемещаться по внешнему
проводнику к медному электроду.
Равновесие
![]() на цинковом электроде нарушается, и для
пополнения убыли электронов получает
развитие процесс:
на цинковом электроде нарушается, и для
пополнения убыли электронов получает
развитие процесс: ![]() ,
при этом в раствор переходит ионы
,
при этом в раствор переходит ионы ![]() .
.
Электроны,
проходящие к медному электроду,
восстанавливают ионы ![]() по
реакции:
по
реакции: ![]() Равновесие нарушается и на медном
электроде, поэтому из раствора к медному
электроду поступают все новые порции
.
Равновесие нарушается и на медном
электроде, поэтому из раствора к медному
электроду поступают все новые порции
.
Таким образом, в системе получают развитие два территориально разобщённых процесса:
на
отрицательном электроде - ![]() (окисление);
(окисление);
на
положительном электроде - ![]() (восстановление).
(восстановление).
Суммарная
реакция ![]() ,
а в молекулярной форме:
,
а в молекулярной форме: ![]()
Гальванический элемент, основанный на такой реакции, был предложен русским учёным Б.С.Якоби. Создателем этого элемента является также и английский учёный Даниэль.
Причина возникновения электрического тока - разность потенциалов, возникающих на пластинках.
Гальваническая цепь последовательная совокупность всех скачков потенциала на различных поверхностях раздела, отвечающих данному гальваническому элементу.
Гальваническая цепь медно-цинкового элемента записывается следующим образом:
![]()
Граница "электрод-электролит" обозначается одной вертикальной чертой, двумя обозначается граница двух электролитов, на которой устранён диффузионный потенциал. Электроны перемещаются по внешнему проводнику слева направо, и в том же направлении переносится ионами положительное электричество внутри элемента. При такой записи гальванической цепи ЭДС элемента всегда считается положительной, поскольку эта запись отвечает направлению самопроизвольного протекания реакции, сопровождающегося уменьшением изобарно-изотермического потенциала.
![]()
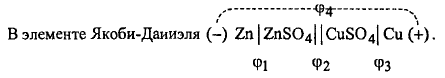
![]() - скачки потенциалов на границах
"электрод-электролит",
- скачки потенциалов на границах
"электрод-электролит", ![]() - на границе двух электролитов,
- на границе двух электролитов, ![]() - на границе двух металлов. Величиной
можно пренебречь.
- на границе двух металлов. Величиной
можно пренебречь.
