
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •Определение молекулярных масс газообразных веществ
- •Основные стехиометрические законы.
- •Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •Волновые свойства электрона. Квантовые числа s-, p-, d-, f-состояния электрона. Электронные орбитали. Проскок электрона.
- •Принцип Паули. Определение электронной емкости уровней, подуровней и орбиталей. Правило Хунда.
- •Порядок заполнения подуровней электронами. Правила Клечковского, электронные и электронографические формулы.
- •Периодический закон д.И. Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер. Электронные аналоги.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Оксиды. Классификация, способы получения, химические свойства.
- •Кислоты. Классификация, способы получения, химические свойства.
- •Основания. Классификация, способы получения, химические свойства.
- •Соли. Классификация, способы получения, химические свойства.
- •Образование химической связи. Энергия связи и длина связи. Типы химической связи. Межмолекулярное взаимодействие. Водородная связь.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
- •Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Уравнять окислительно-восстановительную реакцию ионно-электронным методом.
- •Направленность ковалентной связи. Σ и π-связи. Гибридизация атомных орбиталей.
- •Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
- •Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
- •Система. Фаза. Компонент. Параметры системы. Правило фаз Гиббса.
- •Функции состояния: внутренняя энергия и стандартная энтальпия образования химических веществ
- •Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчеты.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Теплоемкость.
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии. Изменение энтропии при химических процессах и фазовых переходах.
- •Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Третий закон термодинамики. Постулат Планка.
- •Постулат Планка
- •Условия самопроизвольного протекания химических реакций.
- •Константа химического равновесия. Расчет кр и кс.
- •Скорость химической реакции. Закон действующих масс. Константы скорости гомогенной и гетерогенной химических реакций. Связь константа скорости с константой равновесия
- •Закон действующих масс (з.Д.М.)
- •Кинетическая классификация по степени сложности. Молекулярность и порядок реакции. Обратимые и необратимые реакции. Классификация реакций по степени сложности
- •Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Зависимость скорости реакции от температуры.
- •Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.
- •Катализ. Сущность гомогенного и гетерогенного катализа. Стадии гетерогенного катализа.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Способы выражения концентраций растворов.
- •Способы выражения концентрации растворов
- •Растворимость. Произведение растворимости. Изменение энтальпии и энтропии при растворении.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях. Физические и химические процессы при растворении.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Законы Рауля.
- •Э лектролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •Константа диссоциации. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Окислительно-восстановительные реакции. Ионно-электродный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •Возникновение скачка потенциала на границе раздела "металл-раствор".
- •Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нерста. Стандартный потенциал. Ряд напряжений металла.
- •Типы электродов. Стеклянный электрод.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току
- •Коррозия металлов. Химическая и электрохимическая коррозия
- •Основные методы борьбы с коррозией. Почвенная коррозия.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Сущность термографического анализа. Основные принципы построения диаграммы плавкости бинарных систем.
- •Диаграмма состояния однокомпонентной системы на примере воды.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Диаграмма плавкости непрерывных твердых растворов. Правило рычага.
- •Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •Диаграммы плавкости бинарных систем с образованием химических соединений.
- •Адсорбция и абсорбция. Хемосорбция.
- •Агрегатные состояния вещества. Стеклообразное и жидкокристаллическое состояния вещества.
Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
ЭДС гальванического элемента зависит от природы реагирующих веществ, их концентрации и температуры.
Влияние природы реагирующих веществ
Пусть в гальваническом элемента протекает реакция 1:
![]() .
.
![]() .
.
Здесь
![]() - максимальная
полезная работа реакции.
- максимальная
полезная работа реакции.
При протекании реакции 2 имеем:
![]() .
.
Влияние температуры на ЭДС элемента
Уравнение
Гиббса-Гельмгольца: ![]() .
сделаем подстановки в это уравнение:
.
сделаем подстановки в это уравнение:
![]() ,
,
![]()
![]() .
Обозначим второе слагаемое через
.
Обозначим второе слагаемое через ![]() , получаем
, получаем ![]() ,
поскольку
,
поскольку ![]() .
.
![]() - теплота реакции, которая выделяется
или поглощается при её необратимом
проведении.
- теплота реакции, которая выделяется
или поглощается при её необратимом
проведении.
q характеризует связанную энергию, определяет количество теплоты, неизбежно выделяющейся или поглощающейся при обратимой работе элемента.
Поскольку
![]() Таким образом, определив температурный
градиент ЭДС, можно вычислить изменение
энтропии для реакции, протекающей в
элементе.
Таким образом, определив температурный
градиент ЭДС, можно вычислить изменение
энтропии для реакции, протекающей в
элементе.
Зависимость ЭДС от концентрации реагирующих веществ
Пусть в гальваническом элементе протекает реакция A + B = 2D.
![]() - уравнение
Нернста.
- уравнение
Нернста.
Стандартный водородный электрод. Формула Нерста. Стандартный потенциал. Ряд напряжений металла.
 Стандартный
водородный электрод
— электрод, использующийся в качестве
электрода сравнения при различных
электрохимических измерениях и в
гальванических элементах.
Стандартный
водородный электрод
— электрод, использующийся в качестве
электрода сравнения при различных
электрохимических измерениях и в
гальванических элементах.
Стандартный потенциал (нормальный потенциал), значение электродного потенциала, измеренное в стандартных условиях относительно выбранного электрода сравнения (стандартного электрода). Обычно стандартные потенциалы находят в условиях, когда термодинамич. активности а всех компонентов потенциалопределяющей р-ции, протекающей на исследуемом электроде, равны 1, а давление газа (для газовых электродов) равно 1,01 · 105 Па (1 атм).
Электрохимический ряд активности металлов — последовательность, в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов φ⁰, отвечающих полуреакции восстановления катиона металла Meⁿ⁺: Meⁿ⁺ + nē → Me
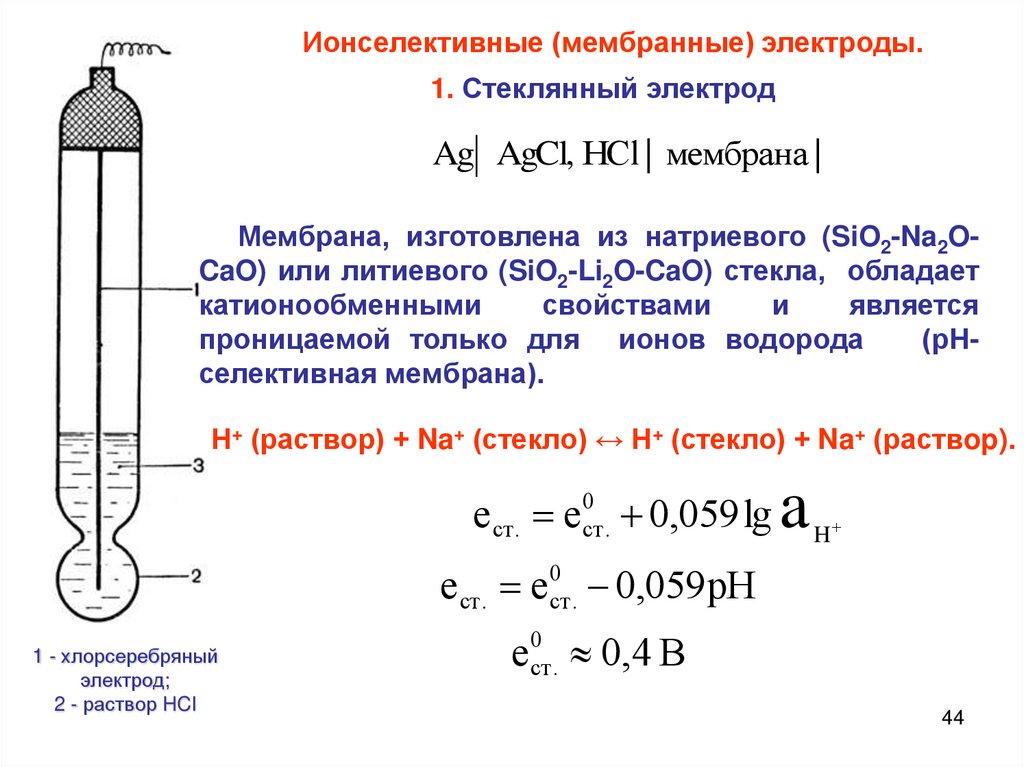
Типы электродов. Стеклянный электрод.
Различают три разновидности так называемых химических электродов. Это электроды первого, второго и третьего рода.
Электроды
первого рода
металлы, погруженные в растворы своих
солей: ![]()
![]() ,
т.е. потенциалопределяющими ионами
являются катионы металлов.
,
т.е. потенциалопределяющими ионами
являются катионы металлов.
Электроды
второго рода
металл погружен в насыщенный раствор
своей малорастворимой соли, к которой
добавлена другая соль с тем же анионом,
но хорошо растворимая, например, ![]() .
.
Процессы на электроде:
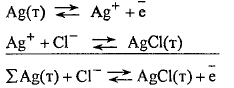
![]() ,
т.е. потенциалопределяющими ионами
являются анионы
,
т.е. потенциалопределяющими ионами
являются анионы ![]() .
Знак "минус" в формуле для
.
Знак "минус" в формуле для ![]() использован потому, что получение аниона
есть результат протекания процесса
восстановления.
использован потому, что получение аниона
есть результат протекания процесса
восстановления.
Электроды третьего рода (газовые электроды).
Известные водородный, кислородный и хлорный электроды.
Для
водородного электрода ![]() ,
,
![]() , т.е. потенциал газового электрода
зависит как от активности ионов в
растворе, так и от парциального давления
газа.
, т.е. потенциал газового электрода
зависит как от активности ионов в
растворе, так и от парциального давления
газа.
Электролиз. Последовательность разряда ионов на катоде и аноде.
Электролиз – ОВ процесс, протекающий в растворе или расплаве при прохождении постоянного электрического тока.
Электролиз HCl:
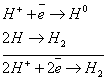
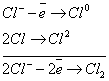
Последовательность катодных процессов. Процесс идет в направлении уменьшения потенциала.
![]()
Металлы можно разбить на 3 группы:
ВСЕГДА восстанавливается на катоде.
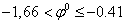 восстанавливаются вместе
с водородом
восстанавливаются вместе
с водородом
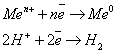
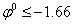 НИКОГДА невосстанавливаются.
НИКОГДА невосстанавливаются.
![]()
![]() в нейтральной или кислой
средах
в нейтральной или кислой
средах
Последовательность анодных процессов.
А) с растворимым анодом, окисляется сам анод
![]()
Б) угольные инертные электроды, процесс идет в порядке увеличение потенциала.
идет окисление бескислородных анионов кислот, за исключением Cl
кислородсодержащие ионы в водных растворах не окисляются (сильная ковалентная связь)
в случае отсутствия бескислородных ионов:
В щелочномрастворе
![]()
В кислой, нейтральнойсреде
![]()
