
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •Определение молекулярных масс газообразных веществ
- •Основные стехиометрические законы.
- •Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •Волновые свойства электрона. Квантовые числа s-, p-, d-, f-состояния электрона. Электронные орбитали. Проскок электрона.
- •Принцип Паули. Определение электронной емкости уровней, подуровней и орбиталей. Правило Хунда.
- •Порядок заполнения подуровней электронами. Правила Клечковского, электронные и электронографические формулы.
- •Периодический закон д.И. Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер. Электронные аналоги.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Оксиды. Классификация, способы получения, химические свойства.
- •Кислоты. Классификация, способы получения, химические свойства.
- •Основания. Классификация, способы получения, химические свойства.
- •Соли. Классификация, способы получения, химические свойства.
- •Образование химической связи. Энергия связи и длина связи. Типы химической связи. Межмолекулярное взаимодействие. Водородная связь.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
- •Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Уравнять окислительно-восстановительную реакцию ионно-электронным методом.
- •Направленность ковалентной связи. Σ и π-связи. Гибридизация атомных орбиталей.
- •Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
- •Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
- •Система. Фаза. Компонент. Параметры системы. Правило фаз Гиббса.
- •Функции состояния: внутренняя энергия и стандартная энтальпия образования химических веществ
- •Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчеты.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Теплоемкость.
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии. Изменение энтропии при химических процессах и фазовых переходах.
- •Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Третий закон термодинамики. Постулат Планка.
- •Постулат Планка
- •Условия самопроизвольного протекания химических реакций.
- •Константа химического равновесия. Расчет кр и кс.
- •Скорость химической реакции. Закон действующих масс. Константы скорости гомогенной и гетерогенной химических реакций. Связь константа скорости с константой равновесия
- •Закон действующих масс (з.Д.М.)
- •Кинетическая классификация по степени сложности. Молекулярность и порядок реакции. Обратимые и необратимые реакции. Классификация реакций по степени сложности
- •Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Зависимость скорости реакции от температуры.
- •Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.
- •Катализ. Сущность гомогенного и гетерогенного катализа. Стадии гетерогенного катализа.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Способы выражения концентраций растворов.
- •Способы выражения концентрации растворов
- •Растворимость. Произведение растворимости. Изменение энтальпии и энтропии при растворении.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях. Физические и химические процессы при растворении.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Законы Рауля.
- •Э лектролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •Константа диссоциации. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Окислительно-восстановительные реакции. Ионно-электродный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •Возникновение скачка потенциала на границе раздела "металл-раствор".
- •Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нерста. Стандартный потенциал. Ряд напряжений металла.
- •Типы электродов. Стеклянный электрод.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току
- •Коррозия металлов. Химическая и электрохимическая коррозия
- •Основные методы борьбы с коррозией. Почвенная коррозия.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Сущность термографического анализа. Основные принципы построения диаграммы плавкости бинарных систем.
- •Диаграмма состояния однокомпонентной системы на примере воды.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Диаграмма плавкости непрерывных твердых растворов. Правило рычага.
- •Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •Диаграммы плавкости бинарных систем с образованием химических соединений.
- •Адсорбция и абсорбция. Хемосорбция.
- •Агрегатные состояния вещества. Стеклообразное и жидкокристаллическое состояния вещества.
Законы Фарадея. Выход по току
При электролизе данного электролита количество вещества, выделяющегося на электродах пропорционально количеству электричества.
При электролизе разных электролитов одинаковое количество электричества выделяет на электродах количество вещества, пропорциональное их эквиваленту.
При пропускании через электролит электричества в 1Ф=96493Кл на электродах выделяется 1 эквивалентная масса (1 моль-эквивалент)
![]() где
к – электрохимический эквивалент.
где
к – электрохимический эквивалент.
Выход по току:
![]()
Удельный расход энергии:
![]()
Коррозия металлов. Химическая и электрохимическая коррозия
Коррозия – это разрушение металла в результате его физико-химического взаимодействия с окружающей средой. При этом металлы окисляются и образуются продукты, состав которых зависит от условий коррозии.
Химическая коррозия характерна для сред, не проводящих электрический ток. При химической коррозии происходит прямое гетерогенное взаимодействие металла с окислителем окружающей среды.
По условиям протекания:
А) газовая коррозия – в газах и парах без конденсации влаги на поверхности металла, обычно при высоких температурах.
Б) коррозия в неэлектролитах – агрессивных органических жидкостях, таких как сернистая нефть и т.д.
Электрохимическая коррозия – характерна для сред, имеющих ионную проводимость. Процесс электрохимической коррозии включает анодное растворение металла и катодное восстановление окислителя. Может протекать в электролитах (водных растворах солей, кислот, щелочей, в морской воде), в атмосфере любого влажного газа, в почве.
Также существует коррозия за счет внешнего электрического тока, это особый вид электрохимической коррозии.
Основные методы борьбы с коррозией. Почвенная коррозия.
Коррозия – самопроизвольно протекающий процесс поверхностного окисления металла в результате его химического или электрохимического взаимодействия с окружающей средой.
В результате коррозии металл из свободного состояния переходит в связанное.
Методы борьбы различны:
Антикоррозийное легирование металла – введение в металл добавок, чтобы повысить стойкость основного металла.
Защитные покрытия (металлические и неметаллические).
Металлические наносятся под давлением сжатого воздуха. характерно покрытие листового материала тонким слоем другого материала.
Неметаллические – лаки ,краски, битум, солидол.
Ингибиторы коррозии- вещества, замедляющие процесс разрушения металла.
Пример:
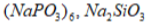
электрозащита- защищаемый металл приводят в контакт с менее благородным металлом (цинк или магний).
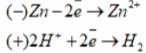
Поток электронов направляется к защищаемому металлу- этот вид защиты используется для магистральных труб, корпусов кораблей и т.д.
Почвенная коррозия — разрушение металла под воздействием агрессивной почвенной среды. Этому виду коррозионного разрушения подвергаются металлы и конструкции, находящиеся в почве, то есть различные подземные резервуары, трубопроводы, сваи, кабели и пр.
Кристаллическое состояние вещества. Химическая связь в кристаллах.
Твердые вещества могут находиться в аморфном или кристаллическом состояниях. Кристаллические структуры. Наименьшая структурная единица – элементарная ячейка. В зависимости от решеток и углов между характеристическими осями различают 7 основных видов (кубическая, ромбоэдрическая и пр.). Тип кристаллической системы определяется природой и размерами частиц, видом химических связей между ними, температурой и другими факторами. Многие соединения могут существовать в двух и более кристаллических структурах. Это явление – полиморфизм. Все кристаллы можно разделить по видам химической связи. Стоит отметить, что существуют кристаллы со смешанными связями.
Молекулярная связь. В узлах кристаллических решеток находятся молекулы, между которыми дейтсвуютвандерваальсовы силы, имеющие невысокую энергию.Для кристаллов с молекулярными связями характерны низкие температуры плавления и высокая сжимаемость.
Ковалентная связь. В узлах кристаллов располагаются атомы, образующие прочные ковалентные связи. Это обуславливает высокую энергию решетки. Кристаллы с ковалентной связью - диэлектрики или полупроводники. Типичными примеры: алмаз и кремний.
Ионная связь. Структурные единицы – положительно и отрицательно заряженные ионы, между которыми происходит электростатическое взаимодействие, характеризуемое высокой энергией. Кристаллы с ионной связью при низких температурах являются диэлектриками. При температурах близких к температуре плавления они становятся проводниками электричества.
Металлическая связь. Специфические свойства металлов (высокая проводимость, теплопроводность, ковкость, пластичность, металлический блеск) можно объяснить особым типом связи – металлическая.Во всех узлах кристаллической решётки расположены положительные ионы металла. Между ними беспорядочно движутся валентные электроны, отщепившиеся от атомов при образовании ионов. Эти электроны удерживают вместе положительные ионы, в противном случае решётка распалась бы под действием сил отталкивания между ионами.
Смешанная связь. Тот или иной вид связи встречается редко, обычно – наложение двух или более связей.
