
- •Основные газовые законы. Определение молекулярных масс газообразных веществ.
- •Определение молекулярных масс газообразных веществ
- •Основные стехиометрические законы.
- •Понятие о химическом эквиваленте и эквивалентной массе простых и сложных веществ. Закон химических эквивалентов.
- •Волновые свойства электрона. Квантовые числа s-, p-, d-, f-состояния электрона. Электронные орбитали. Проскок электрона.
- •Принцип Паули. Определение электронной емкости уровней, подуровней и орбиталей. Правило Хунда.
- •Порядок заполнения подуровней электронами. Правила Клечковского, электронные и электронографические формулы.
- •Периодический закон д.И. Менделеева и периодическая система элементов: ряды, периоды, подгруппы, порядковый номер. Электронные аналоги.
- •Периодическое изменение свойств химических элементов. Радиус атомов, сродство к электрону, энергия ионизации, электроотрицательность.
- •Оксиды. Классификация, способы получения, химические свойства.
- •Кислоты. Классификация, способы получения, химические свойства.
- •Основания. Классификация, способы получения, химические свойства.
- •Соли. Классификация, способы получения, химические свойства.
- •Образование химической связи. Энергия связи и длина связи. Типы химической связи. Межмолекулярное взаимодействие. Водородная связь.
- •Ковалентная (атомная) связь. Метод валентных связей. Возбужденные состояния атомов.
- •Валентность и степень окисления. Способы определения степени окисления. Основные окислители и восстановители. Уравнять окислительно-восстановительную реакцию ионно-электронным методом.
- •Направленность ковалентной связи. Σ и π-связи. Гибридизация атомных орбиталей.
- •Полярность связи. Ионная (электронная) связь. Полярность молекул и их дипольный момент.
- •Донорно-акцепторный механизм ковалентной связи. Комплексные соединения.
- •Основные положения метода молекулярных орбиталей. Связывающие и разрыхляющие орбитали. Энергетические диаграммы.
- •Металлическая связь. Роль металлической связи в формировании физических и химических свойств металлов.
- •Система. Фаза. Компонент. Параметры системы. Правило фаз Гиббса.
- •Функции состояния: внутренняя энергия и стандартная энтальпия образования химических веществ
- •Первое начало термодинамики. Теплота, работа. Закон Гесса. Следствия из закона Гесса. Термохимические расчеты.
- •Зависимость теплового эффекта химической реакции от температуры (закон Кирхгоффа). Теплоемкость.
- •Второе начало термодинамики. Понятие об энтропии. Расчет энтропии. Изменение энтропии при химических процессах и фазовых переходах.
- •Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
- •Третий закон термодинамики. Постулат Планка.
- •Постулат Планка
- •Условия самопроизвольного протекания химических реакций.
- •Константа химического равновесия. Расчет кр и кс.
- •Скорость химической реакции. Закон действующих масс. Константы скорости гомогенной и гетерогенной химических реакций. Связь константа скорости с константой равновесия
- •Закон действующих масс (з.Д.М.)
- •Кинетическая классификация по степени сложности. Молекулярность и порядок реакции. Обратимые и необратимые реакции. Классификация реакций по степени сложности
- •Зависимость скорости реакции от температуры. Правило Вант-Гоффа. Уравнение Аррениуса. Зависимость скорости реакции от температуры.
- •Энергия активации химической реакции. Аналитический и графический метод расчета энергии активации.
- •Катализ. Сущность гомогенного и гетерогенного катализа. Стадии гетерогенного катализа.
- •Растворы (разбавленные, концентрированные, насыщенные, пересыщенные). Способы выражения концентраций растворов.
- •Способы выражения концентрации растворов
- •Растворимость. Произведение растворимости. Изменение энтальпии и энтропии при растворении.
- •Физические и химические процессы при растворении. Растворимость твердых тел и жидкостей в жидкостях. Физические и химические процессы при растворении.
- •Растворимость газов в жидкостях. Закон Генри-Дальтона. Закон распределения.
- •Законы Рауля.
- •Э лектролитическая диссоциация. Степень диссоциации. Слабые электролиты.
- •Константа диссоциации. Закон разведения Оствальда.
- •Сильные электролиты. Понятие активности и коэффициента активности. Ионная сила раствора.
- •Электролитическая диссоциация воды. Ионное произведение воды. Водородный показатель. Понятие об индикаторах.
- •Гидролиз солей. Константа и степень гидролиза.
- •Окислительно-восстановительные реакции. Ионно-электродный метод подбора коэффициентов в окислительно-восстановительных реакциях.
- •Возникновение скачка потенциала на границе раздела "металл-раствор".
- •Равновесный электродный потенциал.
- •Медно-цинковый гальванический элемент Якоби-Даниеля. Процессы на электродах. Понятие об эдс.
- •Зависимость эдс гальванического элемента от природы реагирующих веществ, температуры и концентрации. Стандартная эдс.
- •Стандартный водородный электрод. Формула Нерста. Стандартный потенциал. Ряд напряжений металла.
- •Типы электродов. Стеклянный электрод.
- •Электролиз. Последовательность разряда ионов на катоде и аноде.
- •Законы Фарадея. Выход по току
- •Коррозия металлов. Химическая и электрохимическая коррозия
- •Основные методы борьбы с коррозией. Почвенная коррозия.
- •Кристаллическое состояние вещества. Химическая связь в кристаллах.
- •Сущность термографического анализа. Основные принципы построения диаграммы плавкости бинарных систем.
- •Диаграмма состояния однокомпонентной системы на примере воды.
- •Эвтектическая диаграмма плавкости (без образования твердых растворов).
- •Диаграмма плавкости непрерывных твердых растворов. Правило рычага.
- •Диаграмма плавкости бинарной системы с ограниченными твердыми растворами.
- •Диаграммы плавкости бинарных систем с образованием химических соединений.
- •Адсорбция и абсорбция. Хемосорбция.
- •Агрегатные состояния вещества. Стеклообразное и жидкокристаллическое состояния вещества.
Второе начало термодинамики. Понятие об энтропии. Расчет энтропии. Изменение энтропии при химических процессах и фазовых переходах.
Невозможен самопроизвольный переход тепла от менее нагретого тела более нагретому.
Невозможно создание вечного двигателя 2-го рода (машины, которая периодически превращает тепло среды при постоянной температуре в работу.)
Термодинамический КПД:
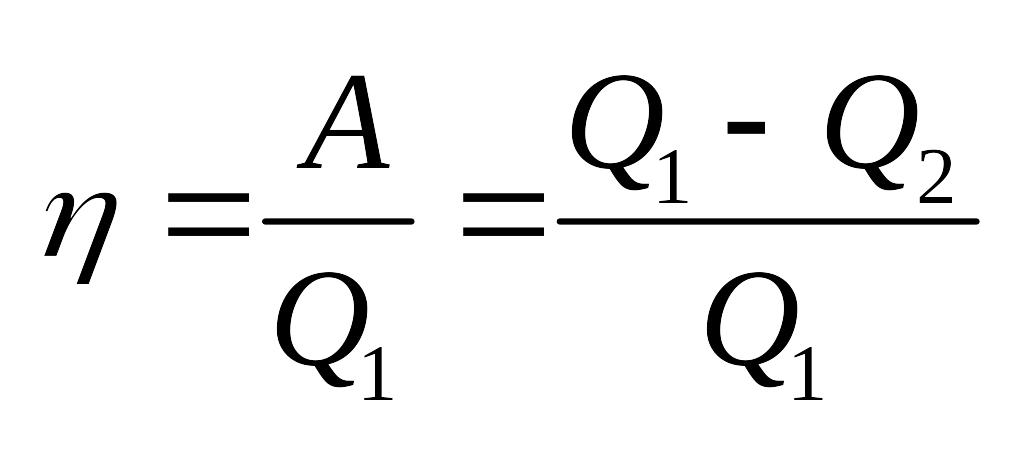 Для
изолированных систем критерием,
позволяющим судить о направлении
процессов и об условиях равновесия,
является функция-S-энтропия.
Для
изолированных систем критерием,
позволяющим судить о направлении
процессов и об условиях равновесия,
является функция-S-энтропия.
Процессы протекают в сторону увеличения энтропии. При равновесии энтропия достигает максимума. Обратное протекание процессов не может быть самопроизвольным – требуется затрата работы извне. Физический смысл функции состояния энтропии легче всего проиллюстрировать на примере кипения жидкости.
При нагреве: Т и U увеличиваются до тех пор, пока жидкость не закипит. При этом поглощается теплота испарения, затрачиваемая на увеличение беспорядка в системе. Таким образом, энтропия – мера упорядоченности состояния системы.
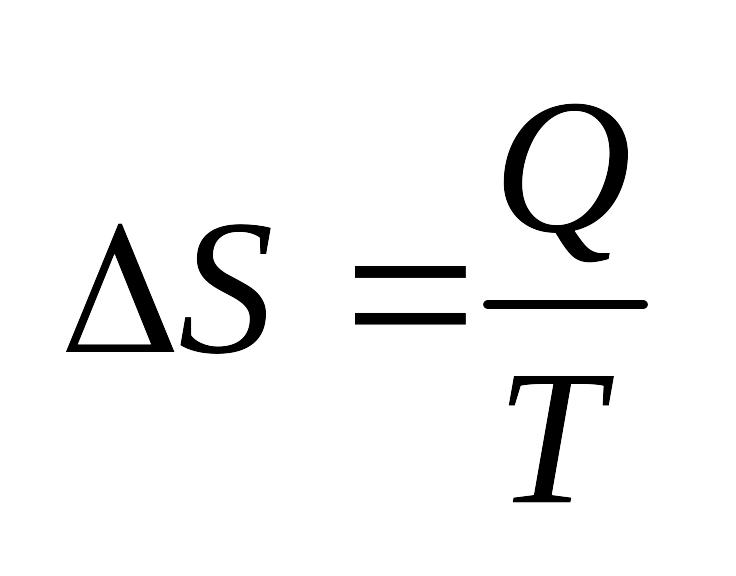 - 2е начало термодинамики
для обратимых процессов.
- 2е начало термодинамики
для обратимых процессов.
В изолированной системе
процессы самопроизвольные, протекают
в сторону увеличения энтропии![]()
В неизолированных–возможно
![]()
Примеры:![]()
![]()
![]()
![]()
Следует отметить, что фазовые переходы (испарение, сублимация и плавление) — это не только физические процессы изменения состояния, но и в значительной степени химические процессы разрыва и образования связей, сопровождающиеся изменением энтальпии и энтропии в системе.
Изменение энтропии в результате протекания химических реакций так же, как и в фазовых переходах, вычисляют как разность между энтропией конечного и начального состояний системы.
Объединенная формула первого и второго начала термодинамики. Свободная энергия Гиббса и Гельмгольца.
Теплота, подведенная к системе, расходуется на приращение внутренней энергии системы и на работу системы над окружающей средой.
![]()
Второй закон. Несколько формулировок, выберем эту:
в изолированных системах самопроизвольно
идут процессы, которые сопровождаются
возрастанием энтропии:![]()
Энтропия – термодинамическая функция, характеризующая меру неупорядоченности состояния системы. Она используется для суждения о направлении самопроизвольно протекающих процессах.
Обобщенный закон. Для каждой изолированной термодинамической системы существует состояние термодинамического равновесия, которого она при фиксированных внешних условиях с течением времени самопроизвольно достигает.
Энергия Гельмгольца. Максимальная
работа, которую может совершить система
при равновесном проведении процесса,
равна изменению энергии Гельмгольца
реакции
![]()
![]() Энергия
Гельмгольца равна
Энергия
Гельмгольца равна
![]() называют связанной энергией.
Она характеризует предел самопроизвольного
течения реакции, которое возможно при
называют связанной энергией.
Она характеризует предел самопроизвольного
течения реакции, которое возможно при
![]()
Энергия Гиббса. Энтальпийный
и энтропийный факторы, характеризующие
процессы, объединены функцией - энергия
Гиббса.![]()
Поскольку энергию Гиббса можно превратить
в работу, то ее называют свободной
энергией.
![]() Химическая
реакция возможна, если энергия Гиббса
уменьшается (<0).
Химическая
реакция возможна, если энергия Гиббса
уменьшается (<0).
Третий закон термодинамики. Постулат Планка.
Третий закон термодинамики:
При нулевой абсолютной температуре энтропия любых веществ, находящихся в равновесном состоянии, имеет одинаковое значение, не зависящее от фазы вещества.
В изотермических
процессах, происходящих при ![]() ,
энтропия не зависит ни от обобщенных
сил, ни от обобщенных координат.
,
энтропия не зависит ни от обобщенных
сил, ни от обобщенных координат.
Поскольку на основе второго начала термодинамики можно определить только изменение энтропии:
![]()
М. Планк показал, что третий закон термодинамики равносилен следующему условию
