
- •Введение
- •Вещества, нарушающие течение биоэнергетических и метаболических процессов
- •Сернистый иприт
- •Азотистые иприты
- •Блокаторы пируватдегидрогеназы
- •Блокаторы цикла Кребса
- •Антивитамины
- •Брометалин
- •Тиомочевины
- •Яды крови
- •Токсиканты периферической нервной системы Нервномышечная передача
- •Вещества раздражающего действия, ирританты
Антивитамины
Каталитическая активность многих ферментов обусловлена участием в их работе коферментов, образующихся из витаминов. Блокировка превращения витаминов в коферменты или их необратимое превращение в производные, которые не могут участвовать в биосинтезе коферментов, создаёт аналогичный авитаминозу эффект, т.е., несмотря на присутствие витаминов в пище, поступление в организм антивитаминов приводит к соответствующим авитаминозу болезненным состояниям, следствием которых может быть гибель животных. В частности, высокой токсичностью (ЛД50 около 5 мг/кг) обладает легко преодолевающий гематоэнцефалический барьер дигидразид тиоугольной кислоты, который реагирует с альдегидной группой пиридоксаля с образованием тиогидразона.
Авитаминоз по витамину В6 возникает также при лечении туберкулёза гидразидом изоникотиновой кислоты:
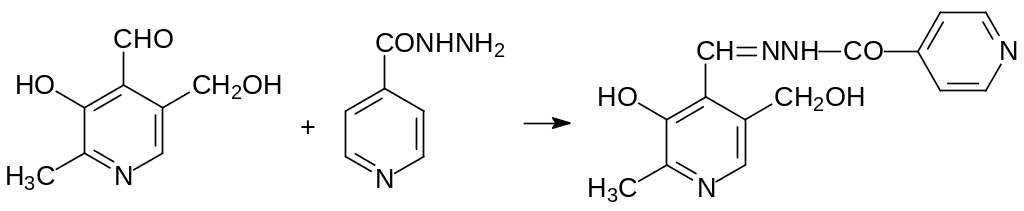
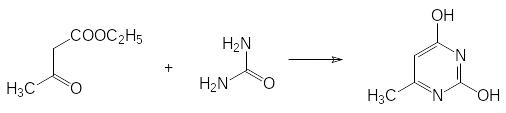
Аналогичный авитаминозу по витамину В6 токсический эффект демонстрируют некоторые замещённые пиримидины, механизм действия которых основан, очевидно, на вытеснении пиридоксальфосфата или его предшественников из каталитических комплексов с соответствующими апоферментами. Одно из таких соединений – 4-диметиламино-6-метил-2-хлорпиримидин (кримидин, кастрикс) получают в три стадии. Сначала проводят реакцию ацетоуксусного эфира с мочевиной:
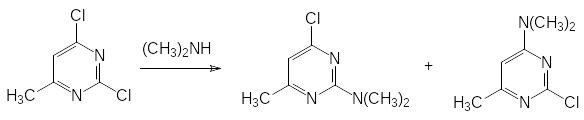
Образовавшийся 2,4-дигидрокси-6-метилпиримидин кипятят с фосфорилхлоридом, замещая гидроксильные группы на атомы хлора, и после этого действием диметиламина на образовавшийся 2,4-дихлор-6-метилпиримидин получают смесь малотоксичного 2‑диметиламино-6-метил-2-хлорпиримидина (в продуктах реакции его около 20 %) и высокотоксичного 4-диметиламино-6-метил-2-хлорпиримидина (выход около 80 %, ЛД50 1,25 мг/кг):
Токсическое действие кримидина проявляется уже через 15-45 минут и сопровождается судорогами. Более мягким действием отличается 4‑амино-5-гидрокси-2-метилпиримидин (токсопиримидин, ЛД50 около 250 мг/кг). В сублетальных дозах кримидин и токсопиримидин вызывают у животных повышенную возбудимость, что позволяет использовать их для снижения численности птиц около аэродромов. Съевшие корм с добавками этих антивитаминов птицы испытывают сильный испуг от шума самолетов и разлетаются, избегая после этого таких беспокойных мест.
Пиридоксальфосфат в составе декарбоксилаз аминокислот принимает участие в образовании нейромедиаторов возбуждения и нейромедиатора торможения ГАМК, а в составе трансаминаз этот кофермент инактивирует как катехоламины, так и ГАМК, превращая её в полуальдегид янтарной кислоты. Однако обусловленный дефицитом по пиридоксальфосфату токсический эффект соответствует только недостаточной активности ГАМК-эргических нейронов, контролирующих прохождение сигналов возбуждения. Из этого можно сделать вывод от том, что главную роль в поддержании требуемой для нормальной работы нейронов концентрации ГАМК играет её образование из глютаминовой кислоты, катализируемое придоксальфосфатом в составе глютаминдекарбоксилазы.
Одним из соединений с антивитаминной активностью является N‑3‑пиридилметил-N´-4-нитрофенилмочевина (пиринурон, Вакор). Это соединение останавливает включение амида никотиновой кислоты в структуру никотинамидадениндинуклеотида (NAD+) и никотинамидадениндинуклеотидфосфата (NADP+) – коферментов реакций гидрирования и дегидрирования (приведена формула NAD+):
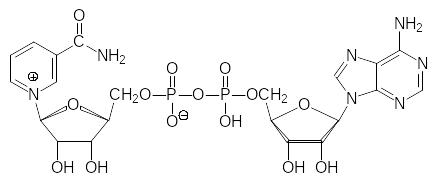
Нарушение биосинтеза этих коферментов или отсутствие исходных продуктов для их образования, одним из которых является триптофан, приводит к серьёзным нарушениям обменных процессов в организме животных и человека с возможным летальным исходом. Самыми яркими проявлениями авитаминоза по предшественникам NAD+ являются дерматиты, диарея и деменция (болезнь трёх Д, пеллагра).
Токсичность пиринурона для крыс составляет 12,3 мг/кг, а для собак, свиней и цыплят от 500 до 1000 мг/кг. Его получение основано на реакции 3-аминометилпиридина с 4-нитрофенилизоцианатом:
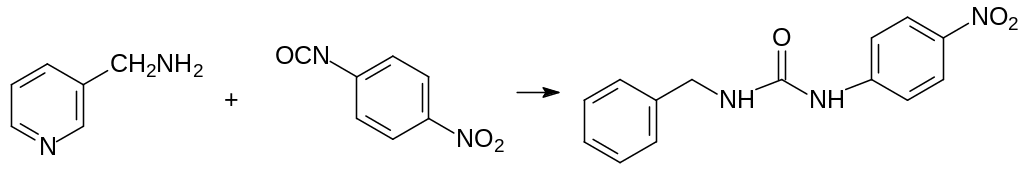
Несмотря на хорошую избирательность и доступность исходных продуктов, практическое использование этого вещества в качестве ратицида было прекращено ещё в 1979 г. Причиной тому послужила высокая токсичность пиринурона по отношению к вырабатывающим инсулин β-клеткам поджелудочной железы. Поступление в организм человека даже небольших количеств пиринурона вызывает тяжелый инсулинзависимый сахарный диабет с крайне нестабильным течением.
Более интересными оказались антивитамины, представляющие собой структурные аналоги участвующего в работе нескольких факторов свёртывания крови витамина К. Эта группа биологически активных веществ, среди которых есть как сильнейшие яды, так и лекарства, выявилась в результате исследования причин геморрагических состояний у скота, в корм которому добавляли подгнивший клевер. Вызывающее кровоточивость и хрупкость кровеносных сосудов действующее начало в этом корме оказалось бис-(4-гидроксикумарин-3-ил)метаном, получившим название дикумарол:
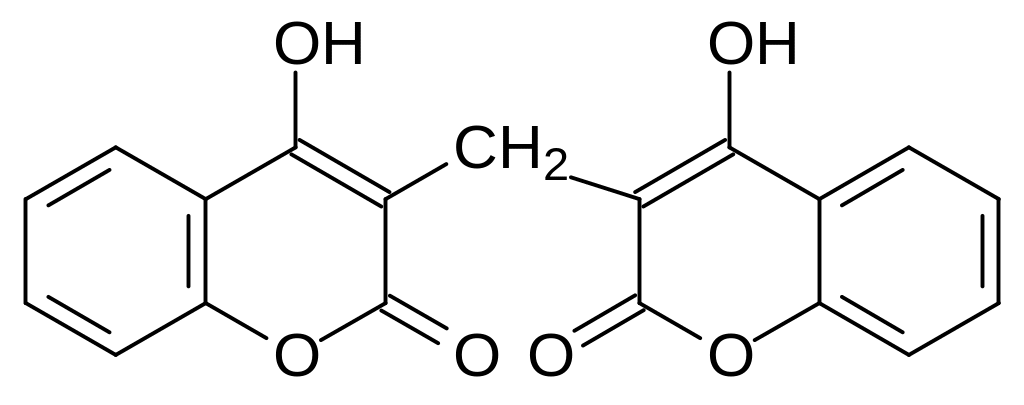
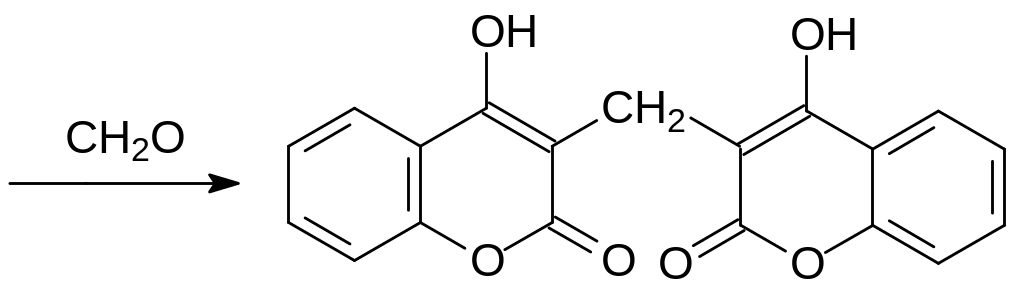
При высушивании травянистых растений обычный для растений продукт метаболизма фенилаланина – гликозилированная транс-о-гидроксикоричная кислота, участвующая в образовании многих необходимых растению веществ, превращается в лактон цис-2-гидроксикоричной кислоты. Лактон гидроксикоричной кислоты или бензопиран-2-он, это кумарин, вещество с запахом сена. В гнилостных бактериях кумарин окисляется и превращается в 4-гидроксикумарин, который далее конденсируется в дикумарол в реакции с формальдегидом или с фолатным переносчиком одноуглеродных структурных элементов:

Изучение механизма антикоагулянтной активности производных 4‑гидроксикумарина показало, что они являются антагонистами витамина К, представляющего собой 3-пренилзамещенный 2‑метилнафтохинон с числом атомов углерода в пренильном остатке c одной этиленовой связью R не менее двадцати:
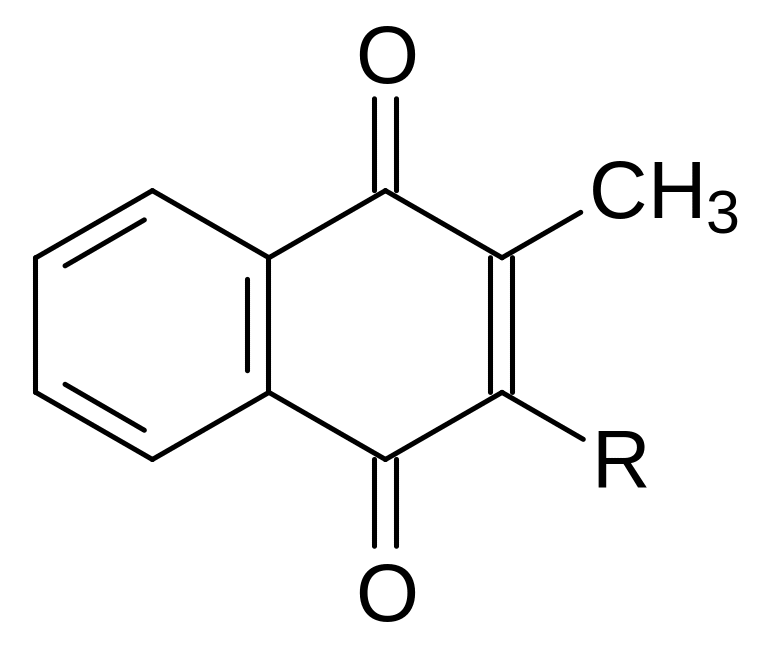
Предшественниками витамина К могут быть также метилнафтохинон, 2-метилнафтогидрохинон и метилзамещенные 1-амино-4-гидроксинафталины, а также викасол – растворимый в воде продукт присоединения бисульфита натрия к метилнафтохинону:
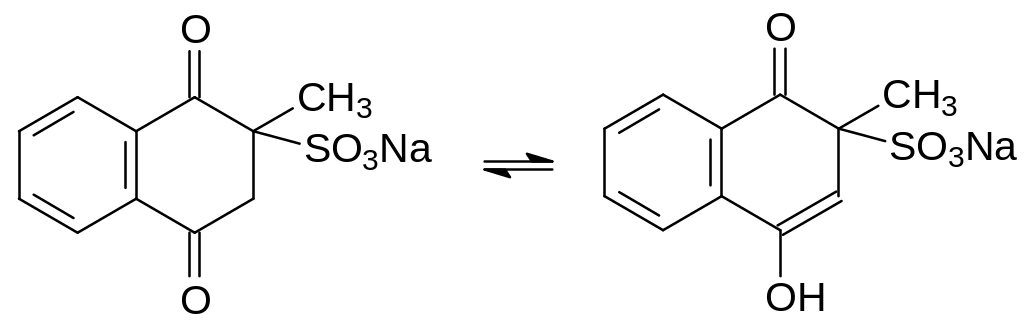
В образовании тромба, останавливающего утечку крови из поврежденных кровеносных сосудов, участвуют факторы свёртывания крови (коагуляции), содержащиеся в поврежденных тканях, в плазме крови и в её клеточных компонентах. Кровь не должна свёртываться в неповреждённых кровеносных сосудах, поэтому запуск образования тромба регулируется в сложном каскаде превращений с участием всех предназначенных для этого факторов. В частности, в плазме крови их 13 и ещё 22 фактора свёртывания крови содержатся в тромбоцитах. На последнем этапе коагуляции образование сгустка крови происходит в результате превращения белка фибриногена (фактор I) в фибрин (фактор II) в результате отщепления от фибириногена нескольких пептидных фрагментов под действием специфического фермента тромбина. Молекулы фибрина полимеризуются в структурирующие образующийся тромб фибриновые нити, захватывая в него и клеточные компоненты крови. Катализирующий образование фибрина из фибриногена фермент тромбин также образуется из предшественника протромбина гидролитическим путём, который запускают несколько факторов из плазмы крови, а также тканевых и тромбоцитарных факторов. Решающую роль в проявлении ферментативной активности тромбина играют ионы кальция (фактор IV) для связывания которого ещё на уровне протромбина его белковая молекула подвергается посттрансляционной модификации с введением ещё одной карбоксильной группы в γ‑положение структурного элемента входящей в его состав глютаминовой кислоты. В отличие от обычных реакций карбоксилирования, протекающих при катализе биотинзависимыми ферментами с участием АТФ, посттрансляцинное карбоксилирование молекулы протромбина катализируется соответствующей γ‑карбоксилазой с участием молекулы кислорода и гидрохинона, образующегося при восстановлении витамина К:

В этом превращении восстановленная форма витамина К выступает скорее всего как косубстрат. В процессе посттрансляционного карбоксилирования протромбина гидрохинон витамина К подвергается двойному окислению: сначала он превращается в хинон, а после этого идёт эпоксидирование по двойной связи с образованием эпоксида витамина К. Редуктаза витамина К восстанавливает это производное с образованием соответствующего хинона:
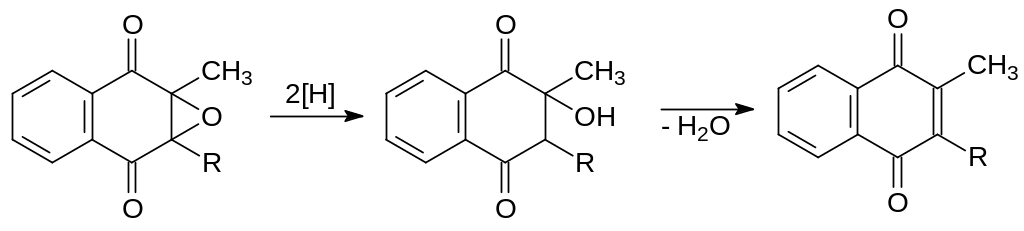
Образовавшийся хиноновый витамин К восстанавливается далее в гидрохинон:
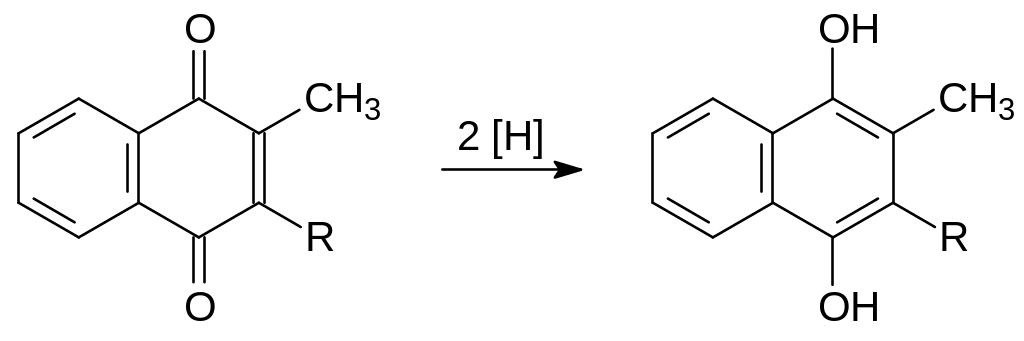
Блокировка редуктазы эпоксида витамина К его антиметаболитами приводит к накоплению эпоксидированного нафтохинонового витамина К и к прекращению образования карбоксилированного протромбина, а образующийся из него тромбин не активируется ионами кальция. Вследствие блокировки этих ферментативных превращений фибриноген не может превращаться в фибрин и образование тромбов становится невозможным.
Представленный механизм действия антагонистов витамина К объясняет специфику их антикоагулянтной активности. Добавленные к донорской крови они не лишают её способности к свёртыванию, поскольку в ней содержатся все факторы, вызывающие превращение фибриногена в фибрин. Для проявления антикоагулянтной активности антагонисты витамина К должны блокировать образование карбоксилированного протромбина в течение достаточно продолжительного времени, когда в процессе обновления белковых компонент крови неспособный к активации ионами кальция протромбин заменит образовавшийся до начала действия блокаторов γ-карбоксилазы активный протромбин. Такие средства для снижения свёртываемости крови называют антикоагулянтами непрямого действия.
При поступлении в организм теплокровных дикумарола и многих других производных 4-гидроксикумарина антикоагулянтный эффект сопровождается геморрагией из-за снижения прочности кровеносных сосудов. Это может быть связано с тем, что строение производных 4‑гидроксикумарина имеет определённое сходство с природными соединениями из группы биофлавоноидов – эффективных антиоксидантов, повышающих тонус стенок кровеносных сосудов. В качестве примера можно привести формулы кверцетина, цианидина и гесперидина, которые в растениях содержатся в виде гликозидов:
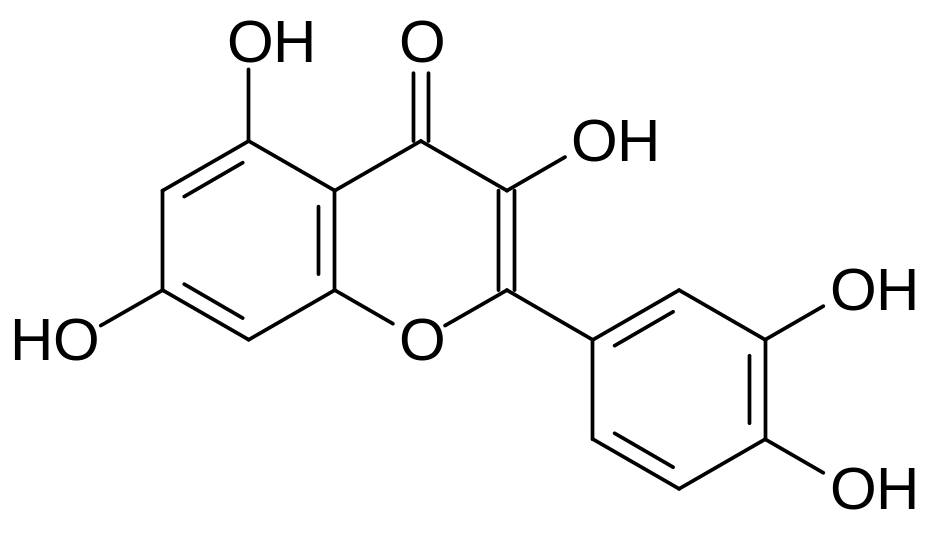
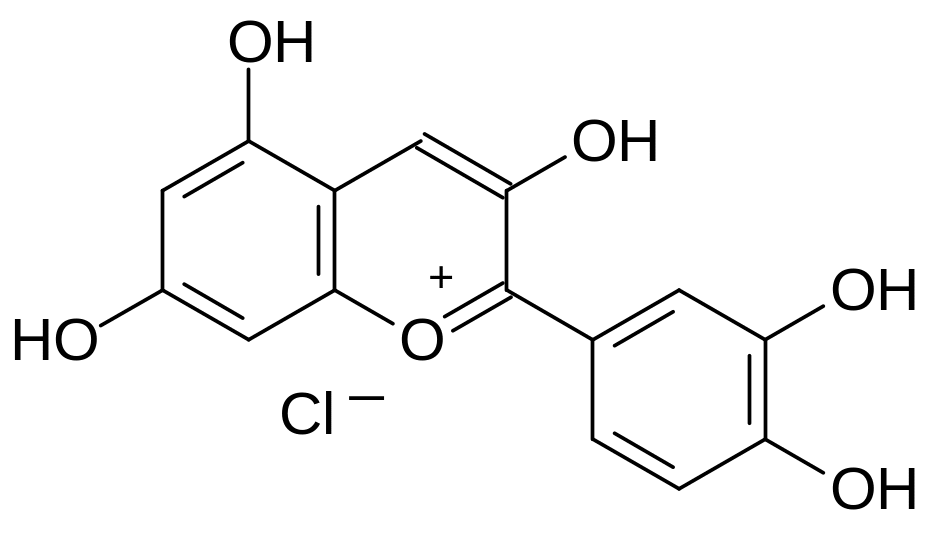
Кверцетин Цианидин
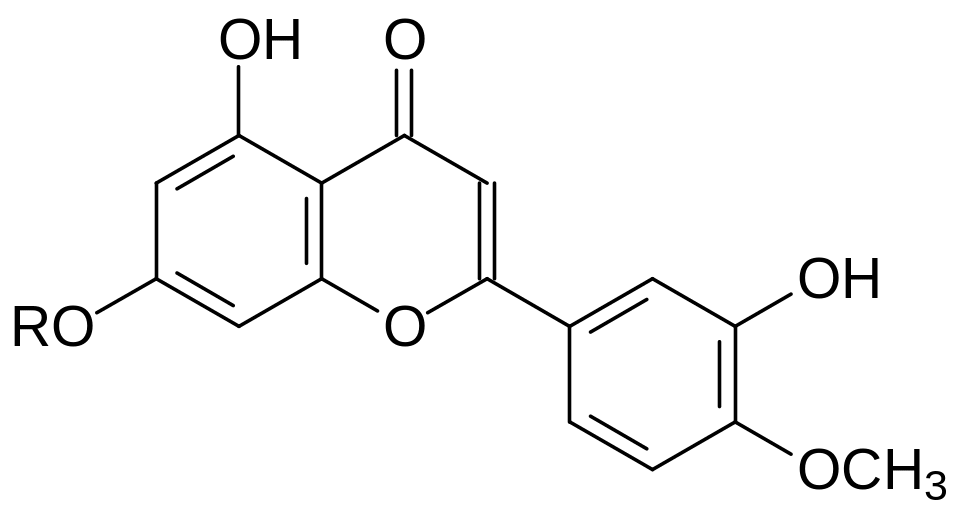
Гесперидин
Биофлавоноид гесперидин – это агликон содержащегося в белом слое кожуры плодов цитрусовых рамноглюкозида гесперитина. В растениях биофлавоноиды выполняют роль антиоксидантов и ингибитинов, защищающих растения от патогенных микроорганизмов. Лекарственная форма Детралекс (Ангиорус и др.) включает смесь гесперидина и его производного диосмина. Детралекс проявляет венотонизирующие свойства, особенно в присутствии аскорбиновой кислоты, защищающей биофлаваноиды от окисления. Предполагается также, что диосмин может быть полезным в лечении таких нейродегенеративных заболеваний, как болезнь Альцгеймера.
В соответствии с этим можно предположить, что биофлавоноиды активируют работу клеточных систем, поддерживающих эластичность и прочность кровеносных сосудов, а производные 4‑гидроксикумарина оказывают противоположное действие.
4-Гидроксикумарин можно рассматривать как енольную форму β‑дикарбонильного соединения – лактона 2-гидроксибензоилуксусной кислоты:

В соответствии с этим способы получения 4-гидроксикумарина основаны на реакциях сложноэфирной конденсации и на ацилировании β‑дикарбонильных соединений хлорангидридом салициловой кислоты. По схеме сложноэфирной конденсации протекает циклизация метилового эфира ацетилсалициловой кислоты:
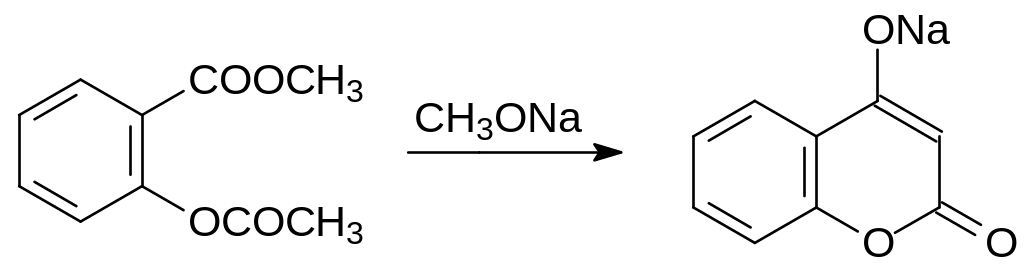
Выход целевого продукта в этом случае не превышает 30 %, так как метилат натрия реагирует с исходным соединением не только с образованием соли 4-гидроксикумарина, но и с отщеплением ацетильной группы с образованием метилацетата и 2-метоксикарбонилфенолята натрия.
С невысоким выходом идёт и взаимодействие метилового эфира салициловой кислоты с ацетонитрилом в присутствии опасного в обращении амида натрия в соответствии со схемой:


Для получения 4-гидроксикумарина в промышленном масштабе использовалась реакция ацилирования натриевого или магниевого производного малонового эфира хлорангидридом ацетилсалициловой кислоты. Образующийся на первой стадии эфир 4-гидроксикумарин-3-карбоновой кислоты при нагревании в водном растворе минеральной кислоты гидролизуется и декарбоксилируется, поскольку образующаяся при гидролизе кислота представляет собой β‑дикарбонильное соединение:

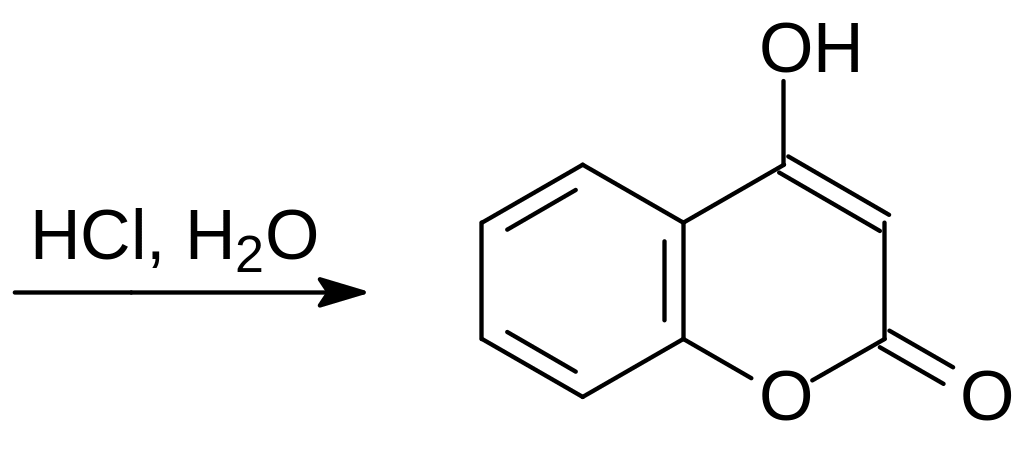
Исходным продуктом в реакции с хлорангидридом ацетилсалициловой кислоты может быть и соль ацетоуксусного эфира. Реакция в этом случае идёт с промежуточным образованием 3-ацетил-4-гидроксикумарина, который отщепляет ацетильную группу в присутствии сильных оснований:


Антикоагулянтную активность дикумарола пытались использовать для лечения таких тромбоэмболических заболеваний, как тромбозы, тромбофлебит, тромбоэмболий и др. лечение проводилось при постоянном врачебном контроле, так как у дикумарола много противопоказаний и побочных эффектов. У него ярко выражена гепатотоксичность, кроме того он является разобщителем в окислительном фосфорилировании. Менее токсичным и более мягким лекарственным средсьтвом оказался пеллентан или дикумарол, образующийся при конденсации 4-гидроксикумарина с этиловым эфиром глиоксиловой кислоты:
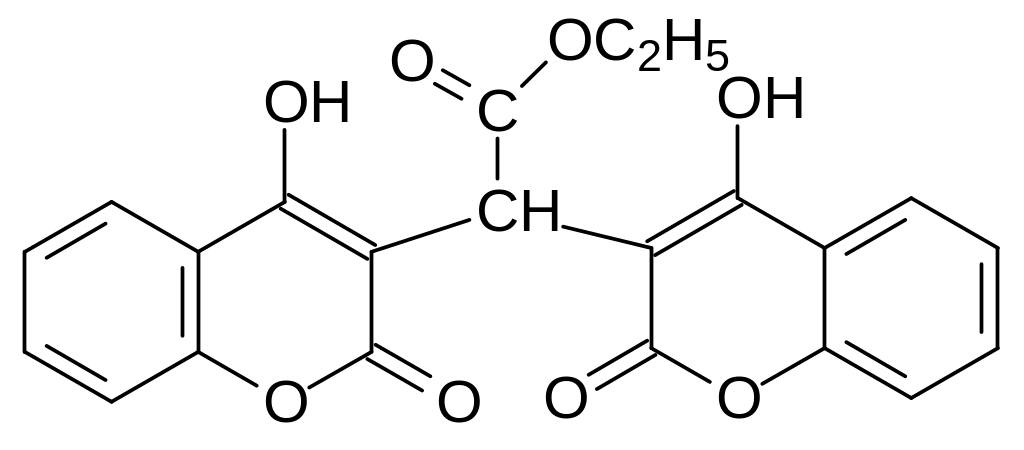
Интенсивно исследовались антикоагулянтные свойства соединений с одним кумариновым структурным элементом. При этом оказалось, что введение заместителей в бензольное кольцо 4-гидроксикумарина приводит только к снижению антикоагулянтной активности, тогда как модификации заместителей в 3-положении позволяют получить как более безопасные лекарственные препараты, так и более эффективные антикоагулянты с геморрагическим эффектом, которые можно было использовать в качестве ратицидов.
Первым вошедшим в практику ратицидом стал 3-(2-ацетил-1-фенилэтил)-4-гидроксикумарин – Варфарин (зоокумарин). Его получают по реакции 4-гидроксикумарина с бензилиденацетоном по катализируемой основаниями реакции Михаэля. При этом оказалось, что взаимодействие 4‑гидроксикумарина с бензилиденацетоном катализируется также кислыми фосфатами с аммонийными катионами:

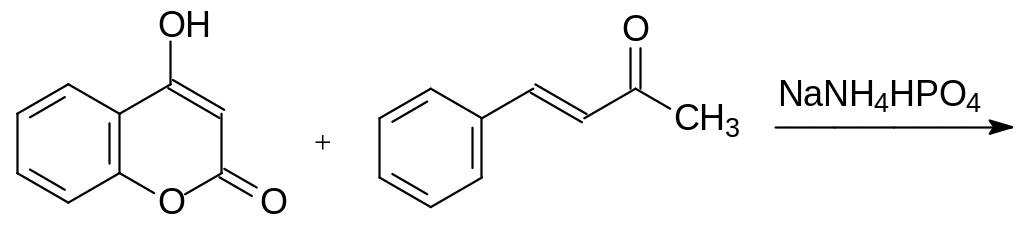
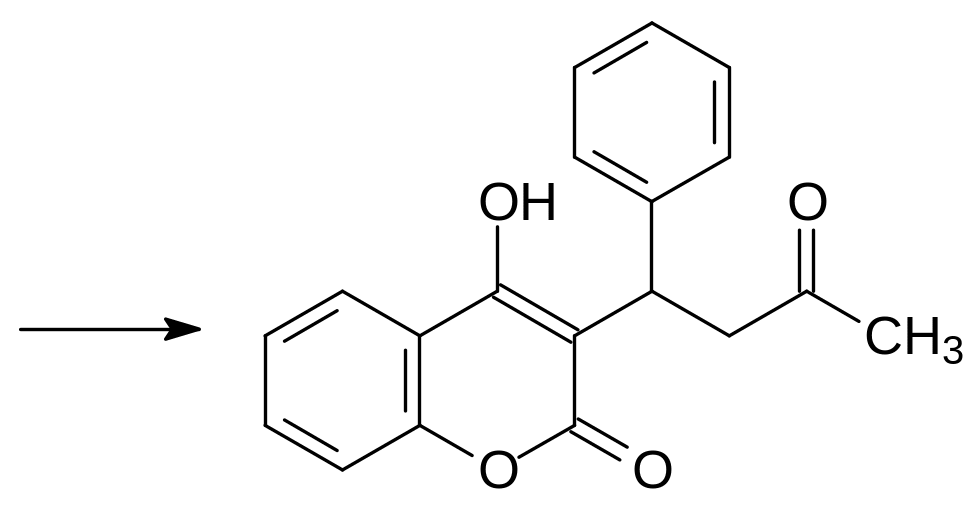
Варфарин и его аналоги оказались очень эффективными средствами для борьбы с грызунами в жилых помещениях, в бытовых и складских постройках. В 1971 году в США было произведено около 6000 т варфарина и более токсичного кумахлора:

У кумахлора острая токсичность для крыс составляет около 1000 мг/кг, тогда как многократное поедание приманок, содержащих от 0,5 до 1,0 % кумахлора, обеспечивающее поступления яда в суммарном количестве около 1-2 мг/кг в течение 10 дней вызывает гибель крыс в течение 2-3 недель после отравления. Причиной летального исхода отравления является пониженная свёртываемость и хрупкость кровеносных сосудов, вызывающие внутренние кровотечения и отёки. При этом кровотечения возникают не только от травм, но и от пульсации крови в потерявших эластичность артериях. Отсроченный токсический эффект антикоагулянтов непрямого действия делает их идеальными ратицидами, поскольку быстрая и тем более мучительная гибель первых съевших отравленную приманку животных настораживает других, и они метят приманки с такими ядами мочой.
Высокая хроническая токсичность и невысокая острая токсичность делают эти препараты более безопасными, чем препараты с высокой острой токсичностью, тем более, что для лечения случайных отравлений антикоагулянтами можно использовать витамин К и викасол.
В течение уже многих лет варфарин и кумахлор не используются в качестве ратицидов. Оказалось, что активное использование этих средств для борьбы с грызунами привело к появлению резистентных рас крыс и мышей. Биохимический механизм резистентности может быть основан на том, что в результате искусственного отбора на фоне применения варфарина и кумахлора выживали особи с эффективными механизмами второй фазы биотрансформации ксенобиотиков, превращающими, например, продукт таутомерии варфарина в неактивный и растворимый в воде глюкуронид по катализируемой глюкуронилтрансферазой реакции с уридиндифосфатглюкуроновой кислотой:
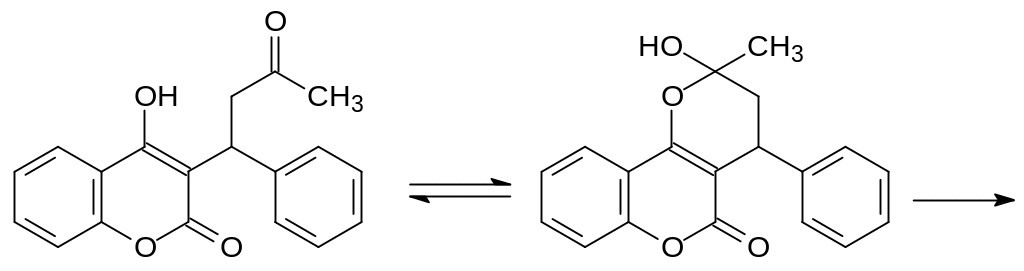

Косвенным подтверждением такой схемы метаболической детоксикации варфарина является наличие антикоагулянтной активности у 3-замещённых 4-гидроксикумаринов, в молекуле которых нет карбонильной группы в этом заместителе, например, у лекарственного средства маркумар:
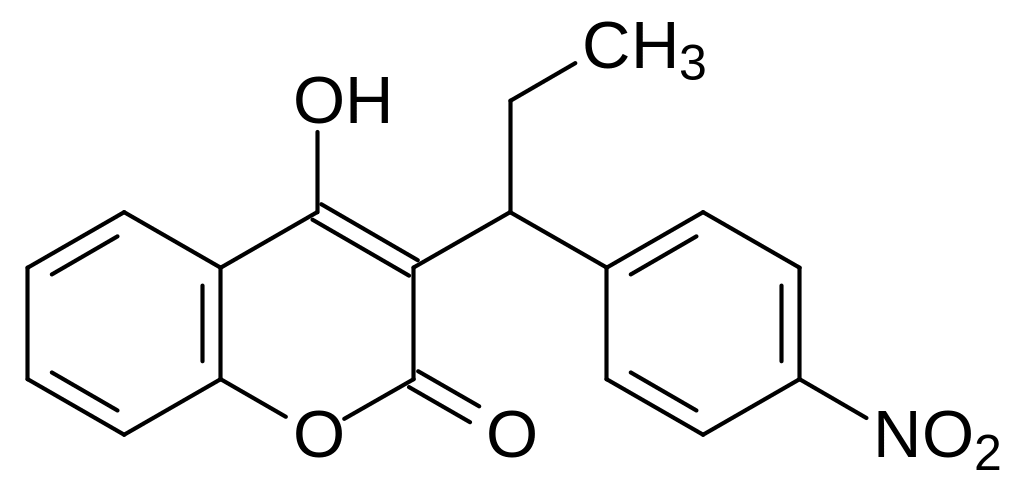
Преодолевает приобретённую к структурным аналогам варфарина резистентность и куматетралил, образующийся при термическом алкилировании 4-гидроксикумарина тетралолом (тетрагидронафтолом) ратицид куматетралин:
В опытах по определению токсичности пятикратное в течение одной недели скармливание крысам доз куматетралина, соответствующих 0,3 мг/кг, приводит к гибели животных в течение 2-3 недель.
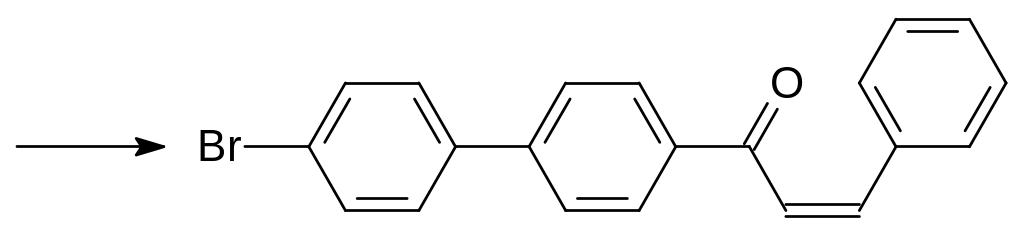
Возможность лечения витамином К случайных отравлений антикоагулянтами непрямого действия сделала перспективным получение ядов, вызывающих гибель животных после однократного поедания приманки с токсикантом. Основываясь на структуре витамина К, в составе которого есть липофильный заместитель с числом атомов углерода более 20, получали соединения с повышенной гидрофобностью и без карбонильной группы в 3‑положении замещённого 4-гидроксикумарина. Одним из таких используемых до настоящего времени в качестве ратицида соединений стал бромдиалон, образующийся в многостадийном синтезе из бифенила. Бромированием и ацетилированием бифенила получают 4‑ацетил-4´-бромбифенил, который конденсируют в присутствии щёлочи с бензальдегидом:

Полученным соединением алкилируют 4-гидроксикумарин и восстанавливают кетогруппу в образующемся аналоге варфарина боргидридом натрия:
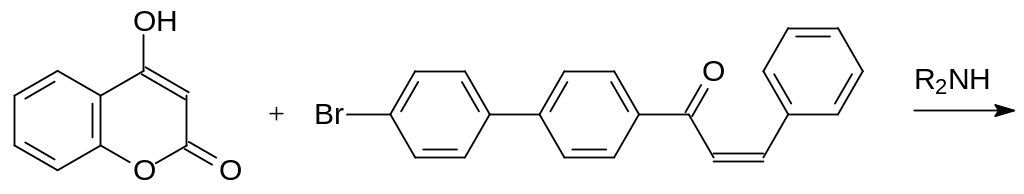
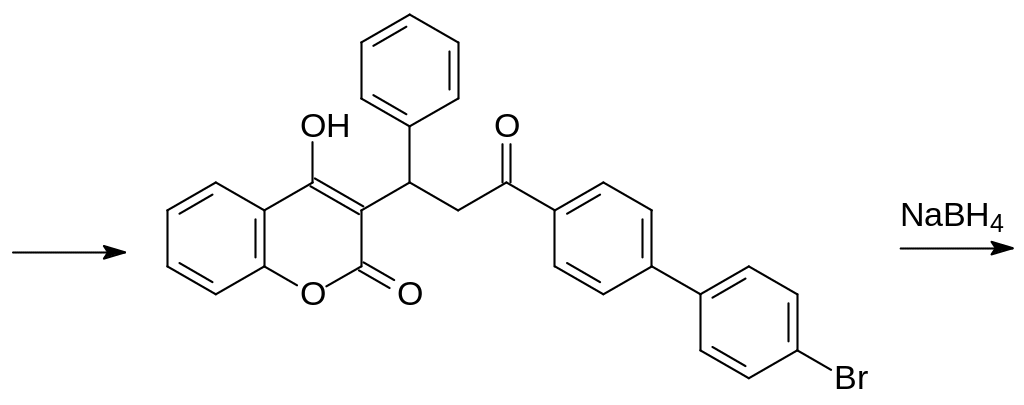
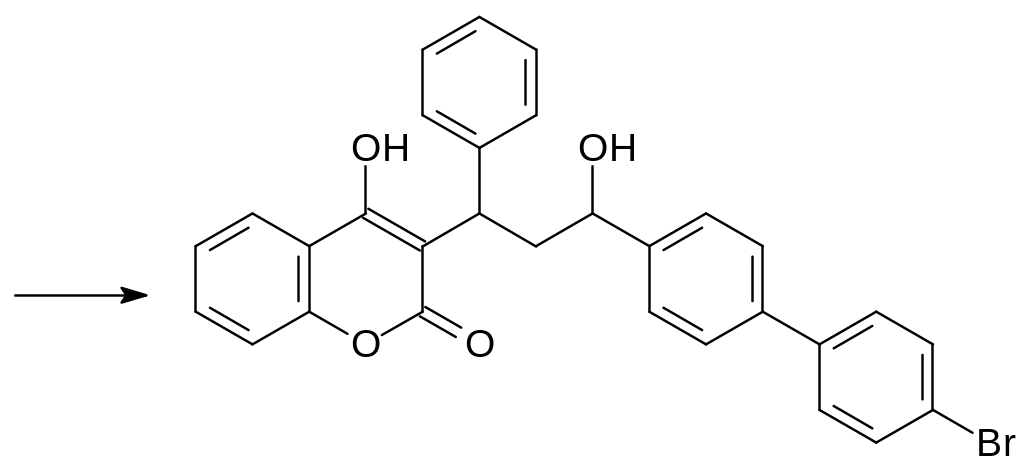
Одна из препаративных форм бромдиалона «Маки» используется для приготовления пищевых приманок с содержанием 0,005-0,015 % бромдиалона.
Ещё более эффективные токсиканты с антикоагулянтной активностью получены путём введения бифенильной или бромбифенильной группы в состав куматетралила. Очевидно, что именно бифенильная структурная единица более всего соответствует пространственному расположению олигоизопреноидного радикала в витамине К, интегрированном в гидрофобный «карман» апофермента редуктазы эпоксида витамина К:

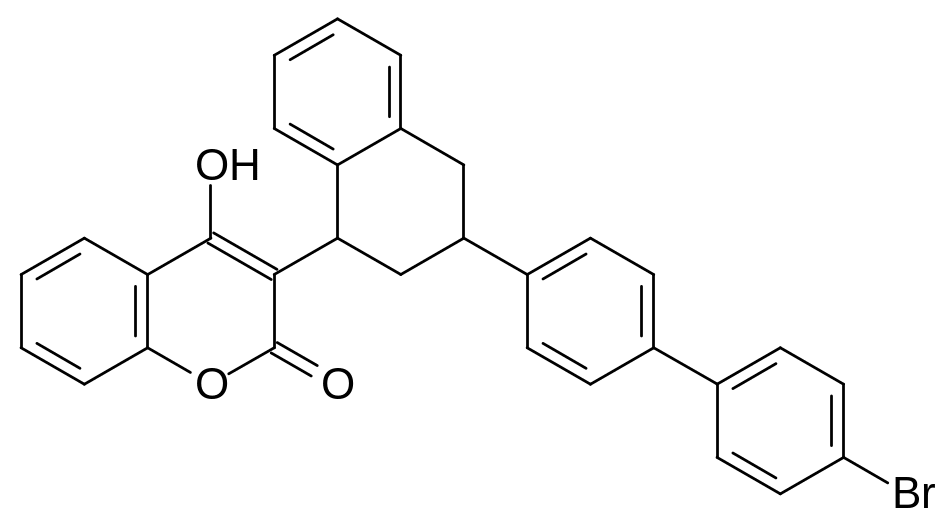
Одновременно с поиском эффективных ратицидов проводились исследования более безопасных антикоагулянтов для использования их в качестве лекарственных средств. Уже на ранних этапах исследования в этом направлении были получены структурные аналоги варфарина с нитрогруппой в фенильном остатке заместителя в 3-положении 4‑гидроксикумарина, у которых практически отсутствовал геморрагический эффект. В РХТУ им. Д.И.Менделеева была разработана технология получения простейшего гомолога варфарина с пониженной в сравнении с варфарином геморрагической активностью:

Под названием Фепромарон он прошёл все испытания и был включён реестр средств для лечения предынфарктных состояний и для растворения образовавшихся тромбов.
И всё же в настоящее время продолжают использовать в лекарственных целях варфарин. В молекуле варфарина есть асимметрический атом углерода. При этом, как и следовало ожидать, один из пространственных изомеров более активен как антикоагулянт. В соответствии с этим для исключения из состава лекарственного средства малоактивного изомера были разработаны стереоселективные методики синтеза варфарина, основанные на катализе реакции 4-гидроксикумарина с бензилиденацетоном хиральными аминами. В качестве примера можно привести катализаторы, полученные в ИОХ РАН. Так, например, оптически активные дихинолилэтилендиамины формулы:
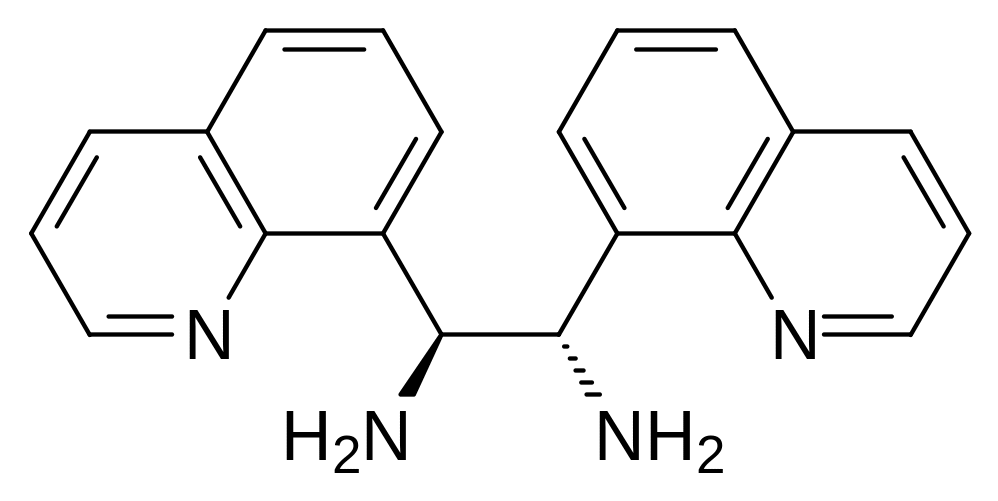
в количестве 10 мольн. % с добавлением 20 мольн. % R- или S-изомеров миндальной кислоты позволяют получать энантиомеры варфарина в водной среде с выходом до 86 % и с энантиомерным избытком ее 91 %. После выделения продукта реакции с одной перекристаллизацией получается оптически чистый варфарин (ее 99 %).
Снижение риска тромбоэмболических заболеваний после проведения операций по стентированию сосудов и в других патологических случаях сейчас чаще всего достигается использованием ингибиторов агрегации тромбоцитов. Одним из таких препаратов является Клопидогрел:
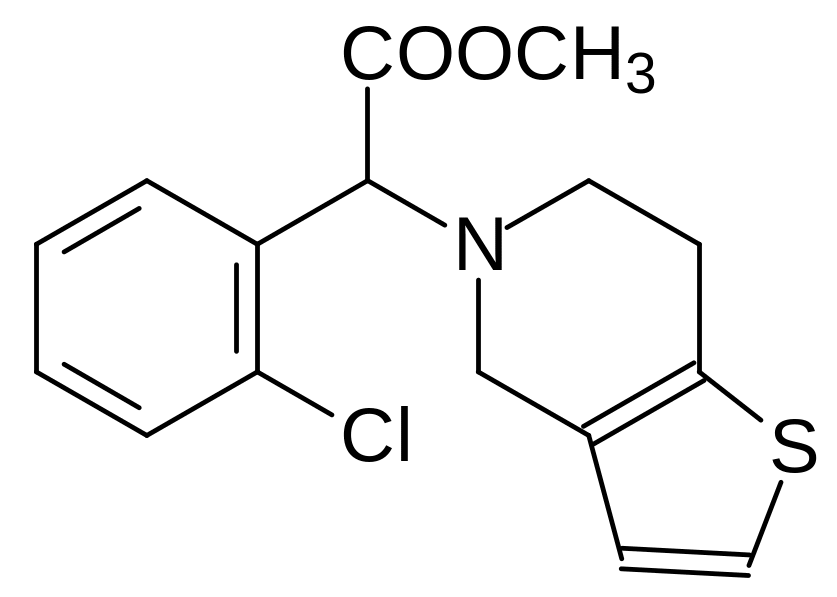
Значительное снижение медикаментозной нагрузки происходит при комбинированном лечении больных с повышенным риском тромбозов сочетанием антикоагулянтов с разными механизмами действия. В качестве примера можно назвать разработанные протоколы лечения, включающие введение Варфарина, Клопидогрела и Аспирина. Варфарин, как отмечалось выше, снижает уровень активного протромбина, Клопидогрел ингибирует агрегацию тромбоцитов, а Аспирин блокирует биосинтез активирующих тромбоциты тромбоксанов, которые образуются из пероксидных продуктов окисления арахидоновой кислоты циклооксигеназами. Такое разнонаправленное действие лекарственных средств сопровождается синергизмом, когда наблюдаемый эффект оказывается больше ожидаемого от простого суммирования эффектов этих действующих веществ.
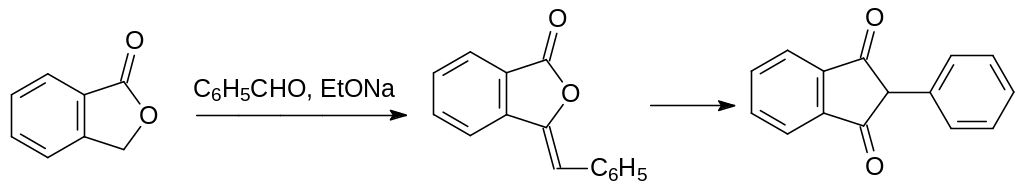
Структурными аналогами нафтохинонового витамина К являются также производные 2-замещенного индан-1,3-диона. Первым соединением этого ряда, у которого была обнаружена антикоагулянтная активность, стал 2-фенилиндан-1,3-дион (фениндион, Фенилин). Несмотря на большое количество побочных эффектов и противопоказаний, этот антикоагулянт непрямого действия и сейчас используется в терапии болезненных состояний, связанных с повышенной свёртываемостью крови.
Фениндион получают по реакции конденсации фталида с бензальдегидом в присутствии сильных оснований. Первичный продукт этой реакции – бензилиденфталид – перегруппировывается в 2‑фенилиндан-1,3-дион сразу после образования:
Более эффективные индандионовые антикоагулянты были получены в результате циклизации диметилового эфира фталевой кислоты с кетонами, в молекуле которых один из связанных с карбонильной группой радикалов представлен метильной группой. В качестве примера можно назвать использовавшийся в качестве ратицида пивал – 2-пивалоилиндан-1,3-дион. По токсичности он мало отличается от варфарина. Для крыс ЛД50 составляет 230-330 мг/кг, а многократное поступление пивала позволяет снизить токсическую дозу почти на два порядка (пять раз по 2,0 мг/кг). Пивал образуется в реакции диметилфталата с пинаколином в присутствии сильных оснований:

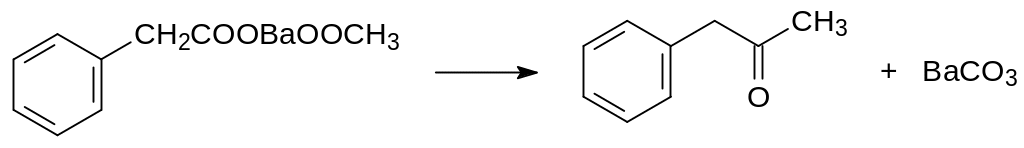
Более высокой токсичностью отличаются индандионовые соединения с повышенной липофильностью заместителя в 2-положении. В частности, циклизация диметилфталата с 1,1-дифенилацетоном приводит к образованию 2-дифенилацетилиндан-1,3-диона (дифенацин, дифасинон). Один из способов его получения включает синтез фенилацетона пиролизом смеси уксусной и фенилуксусной кислоты на катализаторе из оксида бария. Понятно, что речь в этом случае идёт о разложении при высокой температуре образующейся из этих кислот и оксида бария бариевой соли уксусной и фенилуксусной кислот по аналогии с известной реакцией разложения диацетата кальция:
Полученный фенилацетон избирательно хлорируют сульфурилхлоридом и алкилируют бензол образующимся при этом 1‑фенил-1-хлорацетоном по реакции Фриделя-Крафтса:
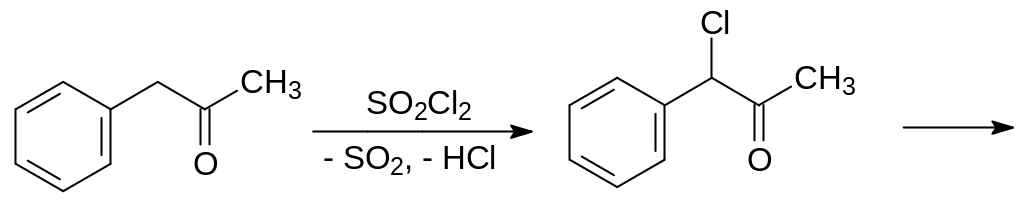
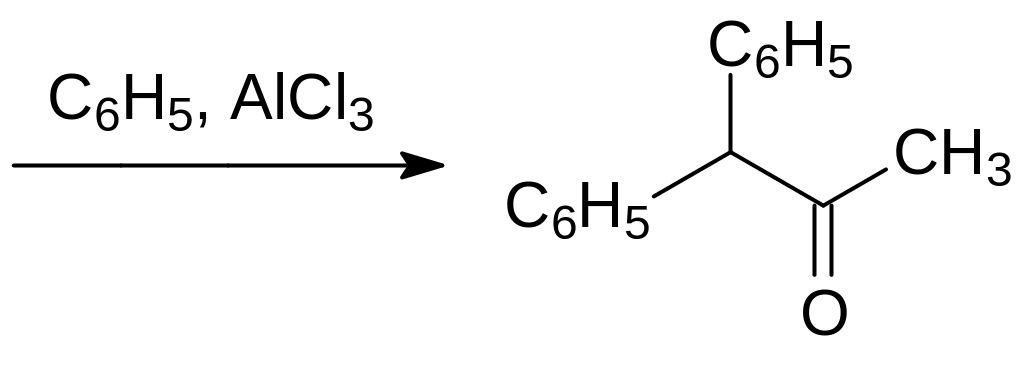
Далее полученный дифенилацетон конденсируют с диметилфаталатом по аналогии с представленной выше реакцией диметилфталата с пинаколином. Дифенацин преодолевает резистентность, приобретённую грызунами по отношению к варфарину, кроме того он примерно в 25 раз более токсичен, чем варфарин. Для приготовления отравленных приманок применяется Ратиндан – смесь дифенацина с нейтральным наполнителем с содержанием дифенацина 0,5 %. Дальнейшее повышение токсичности 2‑диарилацетилиндан-1,3-дионов достигается введением в молекулу дифенацина дополнительных гидрофобизирующих молекулу заместителей, в роли которых могут выступать атомы галогенов, метильная группа (фентолацин), этильная группа (этилфенацин) или изпропильная группа (изоиндан).
Важную роль в свёртывании крови играют ионы кальция, поэтому эффективным синергистом антикоагулянтов является витамин D, регулирующий в организмах теплокровных обмен фосфатов и кальция. Так, например, одна из препаративных форм варфарина включала 0,025 % варфарина и 0,1 % витамина D.
