
- •Введение
- •Вещества, нарушающие течение биоэнергетических и метаболических процессов
- •Сернистый иприт
- •Азотистые иприты
- •Блокаторы пируватдегидрогеназы
- •Блокаторы цикла Кребса
- •Антивитамины
- •Брометалин
- •Тиомочевины
- •Яды крови
- •Токсиканты периферической нервной системы Нервномышечная передача
- •Вещества раздражающего действия, ирританты
Токсиканты периферической нервной системы Нервномышечная передача
Сложная система управления взаимодействием между клетками, составляющими организм животных, называется нейрогуморальной регуляцией. Команды отдельным клеткам и группам клеток поступают в виде нервных импульсов или гормонов, выделяемых специальными клетками нервной системы и железами внутренней секреции в жидкие среды организма (греч. humor - жидкость). Главная роль в поддержании баланса регуляторных веществ принадлежит центральной нервной системе (ЦНС), нейроны которой непосредственно или с участием нейронов периферической нервной системы и жидких сред организма получают информацию о состоянии внутренней среды организма и внешней среды. После обработки полученной информации нейроны ЦНС с помощью специальных химических соединений (нейромедиаторов, гормонов и др.) управляют всеми функциями организма, обеспечивая этим его существование в постоянно меняющихся условиях.
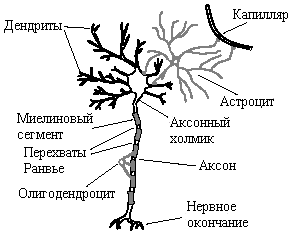
Кроме произвольных действий, управляемых соматической нервной системой, есть еще и функции, которые ЦНС выполняет так, что они не контролируются сознанием (сокращения гладких мышц, миокарда, работа секреторных желез и др.). Такие непроизвольные функции находятся под контролем вегетативной нервной системы, подразделяющейся в свою очередь на симпатическую и парасимпатическую нервную систему. Есть много типов нейронов, но принцип их работы един. При изучении механизма передачи нервного импульса чаще всего рассматривают нейроны соматической нервной системы. Тело нейрона – сома – имеет несколько отростков, которые часто не совсем правильно называют волокнами. Все отростки, кроме одного, похожи на микроскопические деревья, поэтому их называют дендритами. Они предназначены для получения нейроном необходимых для его существования веществ от вспомогательных клеток нервной системы, которые называют нейроглией, и информации от других нейронов.
Полученная и переработанная нейроном информация может быть реализована в виде нервного импульса, для передачи которого у нейрона есть только один отросток – аксон, заканчивающийся в синапсе (по греч. соединение), т.е. там, где передается сигнал от нервного окончания на иннервируемую клетку. Как и все живые клетки, нейроны имеют систему поддержания водно-солевого баланса с высоким содержанием ионов калия и низким содержанием ионов натрия в цитозоле. В норме концентрация ионов натрия в цитозоле нейрона примерно в 10 раз ниже, чем в интерстициальной жидкости, а концентрация ионов калия в нейроне примерно в 40 раз выше, чем вне его. Кроме того, существует единое для всех живых клеток различие в составе и в содержании анионов внутри клетки и вне клетки. Это связано в первую очередь с присутствием в цитозоле и в различных клеточных образованиях высокомолекулярных кислот, для анионов которых клеточная мембрана является непреодолимым барьером. Поскольку образующиеся при диссоциации солей этих кислот катионы чаще всего представлены небольшими ионами натрия и калия, которые всё же проходят через дефектные участки мембраны и через интегрированные в мембрану белки, возникает электрохимический мембранный потенциал с отрицательным зарядом с внутренней стороны мембраны и с положительным зарядом с её наружной стороны. Значение этого потенциала для нейронов равно примерно -70 мВ. На рисунке представлен нейрон соматической нервной системы с обеспечивающими его работу кровеносным сосудом, глиальной клеткой астроцитом, поставляющим нейрону требуемые для идущих в нем метаболических процессов вещества (нейроны не контактируют с капиллярами), и олигодендроцит – тоже глиальная клетка, образующая диэлектрическую миелиновую изоляцию на аксоне.
Как отмечалось выше, ионы натрия и калия проходят через клеточные мембраны, и для поддержания повышенной концентрации ионов калия и пониженной концентрации ионов натрия в цитозоле в клеточную мембрану нейрона встроена транспортная система, называемая Na+,К+-насосом или Na+,К+-АТФазой. За счёт свободной химической энергии аденозинтрифосфата (АТФ), разлагающегося на аденозиндифосфат (АДФ) и фосфат, эта транспортная система выводит против градиента концентраций ионы натрия из клетки и закачивает в неё ионы калия.
Обычные для всех клеток транспортные системы, обеспечивающие им обмен участвующими в метаболизме веществами и поддержание водно-солевого баланса, у нейронов дополнены натриевыми и калиевыми каналами. Эти встроенные в мембрану нейронов белки могут открывать путь для диффузии ионов натрия и калия по градиенту концентрации в ответ на изменение мембранного потенциала (потенциал-зависимые каналы) или на связывание с каким-либо химическим веществом (лиганд-зависимые каналы) с рецепторными сайтами на составляющих канал белках.
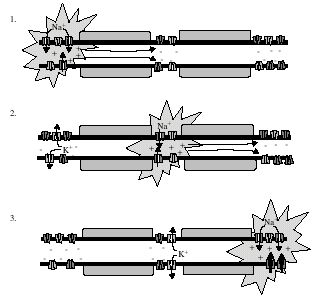
Отходящий от сомы нейрона аксон начинается в так называемом аксонном (триггерном) холмике, в мембрану которого вероятнее всего встроены лиганд-зависимые натриевые каналы. Передача нервного импульса от нейрона через аксон к иннервируемой клетке осуществляется в виде волны изменения полярности (физиологи говорят о деполяризации), начинающейся на аксонном холмике и проходящей по аксону за счёт согласованного во времени прохода катионов через встроенные в мембрану аксона потенциал-зависимые натриевые и калиевые каналы. При изменении электрохимического потенциала мембраны от состояния покоя –70 мВ до порогового значения, составляющего около –40 мВ (в основе этого изменения лежит электромагнитный эффект на соседнем участке мембраны аксонного холмика или аксона), происходит структурная перестройка составляющих натриевые каналы белков, в результате которой открывается путь для ионов натрия внутрь аксона. Положительно заряженные ионы натрия устремляются через открытые каналы по градиенту концентрации в гораздо большем количестве, чем то, которое нужно для нейтрализации отрицательного заряда с внутренней стороны мембраны (главной движущей силой является разность концентраций). Это приводит к тому, что возникает эффект изменения полярности (деполяризации) мембраны: с её внутренней стороны заряд меняется от ‑70 мВ до значения от +30 мВ до +40 мВ. Это новое состояние электрохимического потенциала называется потенциалом действия.
Вызванное поступлением ионов натрия внутрь клетки изменение электрохимического потенциала открывает калиевый (потенциал-зависимый) канал и теперь уже ионы калия устремляются из внутренней сферы аксона в интерстициальную жидкость, унося с собой положительный заряд. На короткое время создается равновесие ионов натрия и калия вблизи каналов, когда мембранный потенциал снова определяется только высокомолекулярными анионами цитозоля (они через натриевые и калиевые каналы, конечно, не проходят). В соответствии с этим межмембранный потенциал возвращается к значению, которое устанавливается в аксоне в состоянии покоя, т.е. –70 мВ. При этом значении мембранного потенциала натриевые и калиевые каналы закрываются. При установившихся при этом равновесных концентрациях ионов натрия и калия передача нервного импульса в результате изменения поляризации мембраны аксона невозможна. Для передачи нового импульса должна опять восстановиться разность концентраций ионов натрия и калия. Связанный с деполяризацией вход ионов натрия и выход ионов калия затрагивает лишь небольшой объем цитозоля и интерстициальной жидкости около участков мембраны с ионными каналами. В соответствии с этим вошедшие через канал ионы натрия диффундируют в цитозоль, а ионы калия в интерстициальную жидкость. Этим обеспечивается возможность быстрого восстановления способности аксона передавать новый импульс, хотя, конечно, разность концентраций ионов калия и ионов натрия теперь немного меньше, чем была в состоянии покоя. Роль постоянно работающей Na+,К+‑АТФазы состоит в том, чтобы вывести из цитозоля вошедшие в аксон ионы натрия и закачать в него вышедшие ионы калия. Na+,К+‑АТФаза работает с невысокой скоростью, поддерживая водно-солевой баланс нейрона, поэтому благодаря диффузии прохождение одного нервного импульса занимает время около 0,002 с. В соответствии с этим по аксонам нейронов соматической нервной системы может проходить до 500 импульсов в секунду.
Электромагнитный эффект потенциала действия изменяет значение электрохимического потенциала на соседнем участке мембраны аксона до порогового значения (от –70 до –40 мВ), открывающего новые натриевые каналы на этом участке аксона, и так описанная выше последовательность движения ионов натрия и калия повторяется на новом участке аксона, распространяясь в одном направлении от аксонного холмика нейрона до связывающего нейрон с иннервируемой клеткой синапса.
Итак, основной механизм, обеспечивающий прохождение волн деполяризации, основан на диффузионных процессах, поскольку скорость работы Na+,К+-насоса недостаточна для обеспечения эффективной работы нейрона при быстром чередовании следующих один за другим импульсов, Для увеличения ёмкости системы по катионам натрия и калия головоногие моллюски выработали приспособительный механизм, основанный на увеличении объема аксонов. Практически все начальные представления по механизму передачи нервного импульса были получены на так называемых гигантских аксонах кальмаров, которые позволяли вводить в них измерительные и управляющие электроды. Современная техника эксперимента позволяет проводить такие эксперименты и на обычных нейронах.
Млекопитающие выработали более совершенную систему передачи нервных импульсов, минимизировав участки с ионными каналами. У них аксоны соматической нервной системы покрыты вспомогательными шванновскими клетками (олигодендроцитами), которые в процессе их роста обволакивают аксоны несколькими слоями своей неполярной диэлектрической мембраны с высоким содержанием липидов и гидрофобных белков. Такая изоляция, называемая миелиновой (от греч. миелос – мозг), позволяет исключать электромагнитное воздействие проводящего импульс аксона на близко расположенные аксоны других нейронов. Кроме того, покрывающая аксон миелиновая оболочка значительно увеличивает скорость прохождения импульсов по аксону и обеспечивает прохождение сигнала в результате движения через ионные каналы значительно меньшего количества ионов натрия и калия. Дело в том, что миелинизированные участки не образуют сплошного изолирующего слоя; между ним есть не покрытые миелиновой оболочкой промежутки, называемые перехватами Ранвье. Именно в этих зонах мембран и находятся ионные каналы: в миелинизированных аксонах они не распределены равномерно по всему аксону, а сконцентрированы в перехватах Ранвье. Вследствие этого обеспечивающее возникновение потенциала действия движение ионов идёт на узкой кольцевой зоне в промежутке между миелинизированными участками, а открывание натриевых каналов в следующем далее перехвате Ранвье происходит из-за того, что требуемое для этого пороговое значение мембранного потенциала (–40 мВ) обеспечивается электромагнитным эффектом. В условиях миелиновой изоляции наведённый потенциал передаётся со скоростью света с очень незначительными потерями. Вследствие этого миелинизированные аксоны могут проводить нервные импульсы со скоростью до ста метров в секунду, тогда как скорость передачи импульсов по аксонам без миелиновой оболочки составляет всего лишь несколько метров в секунду. На рисунке представлена схема скачкообразного распространения сигнала по миелинизированному аксону:
Причиной одного из тяжелейших заболеваний нервной системы – рассеянного склероза – является уничтожение миелиновой оболочки аксонов соматической нервной системы собственными защитными механизмами организма в результате сбоев в иммунной системе (аутоиммунная реакция).
Подходящий к синапсу аксон расширяется, образуя нервное окончание. Его мембрана, обращенная к иннервируемой клетке, называется пресинаптической мембраной, а включенная в синапс мембрана иннервируемой клетки называется постсинаптической. Кроме того, аксоны моторных нейронов, управляющих поперечнополосатыми мышцами, могут расходиться на несколько отростков, синапсы которых образуют так называемую двигательную концевую пластину. Дошедшая до синапса волна деполяризации должна вызвать соответствующий отклик на постсинаптической мембране. Понятно, что это может быть просто электромагнитное воздействие по аналогии с тем, которое открывает натриевые каналы при движении волны деполяризации по аксону. Такие синапсы, их называют электрическими, существуют, но гораздо более распространены химические синапсы, у которых деполяризация пресинаптической мембраны приводит к выходу в разделяющее нервное окончание и иннервируемую клетку пространство (синаптическую щель) специального вещества, называемого нейромедиатором.
Чем совершеннее нервная система, тем меньше в ней электрических синапсов. Обычно они предназначены, например, для синхронизации активности групп моторных нейронов (прыжок лягушки). Их основная особенность состоит в том, что электромагнитный эффект исключает синаптическую задержку (выход нейромедиатора из пресинаптической мембраны, его диффузию к постсинаптической мембране, связывание с расположенным на ней рецептором и соответствующий отклик в клетке на структурную перестройку белков рецептора). Для эффективного межмембранного взаимодействия в электрическом синапсе нервное окончание и иннервируемую клетку разделяет расстояние не более 2 нм, кроме того, эта синаптическая щель включает специальные структуры, снижающие электрическое сопротивление. Электрический синапс может передавать сигнал в обоих направлениях, но обычно его прохождение в одном из направлений сильно ослаблено. Электрический синапс мало зависит от концентрации ионов кальция и магния, от температуры, он мало чувствителен к фармакологическим воздействиям. Однако главная его особенность состоит в том, что он предназначен только для связи между нейронами через включение потенциалзависимых ионных каналов. Электрическое включение, вызывающее структурную перестройку соответствующих белков в ответ на ослабленное синаптической щелью изменение мембранного потенциала на пресинапической мембране, слишком уязвимо из-за возможности влияния внешних электрических полей.
В химическом синапсе волна деполяризации, достигшая нервного окончания, приводит к выделению через пресинаптическую мембрану нейромедиатора, который диффундирует через синаптическую щель шириной от 10 до 50 нм, и связывается с рецепторными участками на лигандзависимых ионных каналах постсинаптической мембраны или с соответствующим метаботропным рецептором. В нервном окончании аксона нейромедиатор включен в окруженные мембраной пузырьки, называемые везикулами. Они находятся в цитозоле аксона преимущественно вблизи пресинаптической мембраны. При её деполяризации открываются уже не натриевые, а кальциевые каналы и в нервное окончание входят ионы кальция, которые и обеспечивают связывание мембран везикул с пресинаптической мембраной. Слияние пресинаптической мембраны и мембран везикул завершается образованием поры, через которую в синаптическую щель выходит нейромедиатор. После этого целостность мембран везикул и пресинаптической мембраны восстанавливается и «пустая» везикула отделяется от мембраны. Встроенная в мембрану везикулы белковая транспортная система (транслоказа везикулин), снова «закачивает» в нее нейромедиатор, а заполненная нейромедиатором везикула снова приближается к пресинаптической мембране для передачи нового импульса. Понятно, что в передаче одного нервного импульса участвует лишь малая часть заполненных нейромедиатором везикул.
В отличие от электрического синапса химический синапс обеспечивает усиление сигнала, пришедшего в виде изменённого мембранного потенциала. Вышедшие в синаптическую щель молекулы нейромедиатора диффундируют к постсинаптической мембране и связываются с расположенными на её поверхности рецепторами, вызывая соответствующий отклик в иннервируемой клетке. Связь нейромедиатора с реагирующим на него белком на постсинаптической мембране обратима, и в зависимости от природы нейромедиатора он после выполнения им функции по передаче сигнала разлагается на неактивные соединения или ресорбируется пресинаптической мембраной (обратный захват).
В работе периферической нервной системы принимают участие два основных нейромедиатора, передающих сигнал возбуждения (в переводах с английского иногда их называют нейротрансмиттерами): ацетилхолин и норадреналин (норэпинефрин):
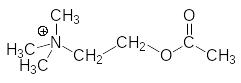

Ацетилхолин участвует в работе центральной, соматической и вегетативной нервной системы, а норадреналин – это нейромедиатор центральной и одного из двух отделов вегетативной нервной системы; он передаёт сигнал от промежуточного нейрона симпатических нервов на иннервируемые клетки с метаботропными рецепторами.
На основании представленной общей картины, показывающей механизм передачи нервного импульса в химическом синапсе, можно определить пути медикаментозного или токсического воздействия на прохождение сигналов возбуждения. Их рассмотрение можно начать с ионных каналов. Калиевый канал должен иметь достаточно сложный механизм распознавания иона, для которого он предназначен, поскольку меньшие по размерам ионы натрия и лития через него практически не проходят. В токсикологическом или в медикаментозном плане воздействие на калиевый канал используется редко. Это связано с тем, что его «ворота» расположены с внутренней стороны мембраны аксона, куда доступ активным веществам затруднен. Известно, например, что блокаторами калиевых каналов являются катионы алкилтриэтиламмония формулы RN+(С2Н5)3. Они препятствуют выходу ионов калия из аксона. Блокаторами калиевых каналов являются также алкалоид хинин и его оптический изомер хинидин.
В отличие от этого натриевый канал более уязвим. Он «смотрит» на внешнюю сторону мембраны аксона и работает по принципу сита. Если принять скорость прохождения ионов натрия за 1, то для меньших по размеру ионов лития скорость будет равна 1,1, а для более объёмных ионов калия и рубидия соответственно 0,083 и 0,025. Гидратированный катион, образованный сильным органическим основанием гуанидином, соответствует по размеру гидратированному иону натрия Na+6Н2О. Это свойство производных гуанидина используется живой природой для создания высокотоксичных блокаторов натриевых каналов.
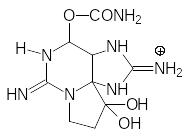
Сильным природным ядом с ЛД50 0,008 мг/кг (мыши, п.к.) и 0,004 (человек, п.о.) является сакситоксин, продуцируемый некоторыми видами красных жгутиковых и синезеленых водорослей:
Токсические свойства этих микроорганизмов известны с давних времён. В «Ветхом завете» одна из казней египетских описывалась так: «И вся вода в реке превратилась в кровь, и рыба в реке вымерла, и река воссмердела, и египтяне не могли пить из реки, и была кровь на всей земле египетской». Это достаточно точное описание явления, которое сейчас называют «красным приливом» и которое представляет собой один из сценариев цветения воды с бурным размножением в ней одноклеточных водорослей. Многочисленные микроорганизмы, развивающиеся в теплой воде с высоким содержанием азотных и фосфорных соединений (из сточных вод и удобрений), выделяют в воду несколько действующих на нервную систему высокотоксичных соединений, одним из них является сакситоксин. Питающиеся фито- и зоопланктоном моллюски могут накапливать в своих тканях сакситоксин. Поэтому употребление в пищу устриц или мидий во время цветения воды может иметь трагические последствия.
Механизм действия сакситоксина основан на блокировке натриевых каналов. Протонированный атом азота гуанидинового структурного элемента в его молекуле входит в натриевый канал, а остальная объёмная часть молекулы сакситоксина фиксирует молекулу у входа в канал за счёт образования водородных, ионных связей и полярных взаимодействий с белками натриевых каналов. Образуется «пробка», которая не пропускает ионы натрия, и передача нервного импульса становится невозможной.
Аналогичный механизм действия лежит в основе токсичности тетродотоксина с ЛД50 0,02 мг/кг (человек, п.о.) или 0,002 мг/кг (человек, в.в.):
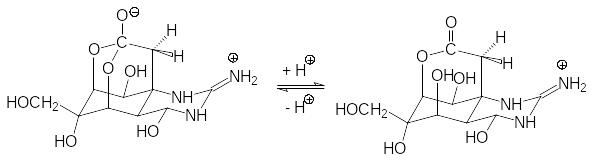
Тетродотоксин содержится в икре, печени и в выстилающих брюшину черных пленках рыбы тетродона (у японцев рыба фугу). Он выделен также из калифорнийского тритона (отсюда его другое название – тарихотоксин), некоторых лягушек и синекольчатого осьминога. Судя по всему, этот токсин также имеет микробиологическое происхождение. Рыба тетродон питается моллюсками и коралловыми полипами, которые поглощают содержащие тетродотоксин микроорганизмы и планктон. Идёт его накопление в пищевой цепи, поскольку он представляет собой достаточно стабильное соединение. Отравление сакситоксином и тетродотоксином начинается с онемения губ и языка, теряет чувствительность тело, по нему распространяется ощущение тепла и покоя. Именно эти первичные симптомы сублетальных доз тетродотоксина и объясняют пристрастие к блюдам из рыбы фугу у японцев. При летальных дозах смерть наступает от остановки дыхания.
В отличие от сакситоксина и тетродотоксина, блокирующих натриевые каналы, содержащийся в кожных выделениях южноамериканской древесной лягушки кокои батрахотоксин (ВТХ) фиксирует натриевый канал в открытом состоянии:
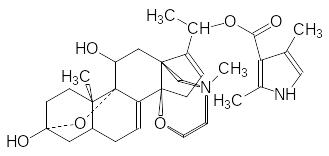
Токсичность этого соединения, в основе которого лежит стероидный углеродный скелет, так же очень высока (ЛД50 0,002 мг/кг, п.к.). При попадании батрахотоксина в кровь токсический парализующий эффект, начинающийся с резкого падения давления крови, достигается в течение 0,5-2 минут. Индейцы Южной Америки используют этот яд в отравленных стрелках, выстреливаемых из духовых трубок. Поэтому батрахотоксин называют также трубочным кураре. В соответствии с механизмом действия батрахотоксин и блокаторы натриевых каналов являются антагонистами.
Батрахотоксин также, как и тетродотоксин, накапливается в пищевой цепи, заканчивающейся лягушкой древолазом. Если ядовитую лягушку поместить в террариум и кормить обычными насекомыми, используемыми при выращивании земноводных в искусственных условиях, то содержание батрахотоксина в её кожных выделениях будет снижаться, а новое поколение лягушек будет полностью лишено этого яда.
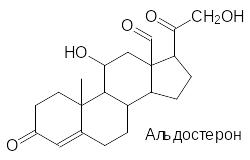
В качестве следующего объекта токсического и лекарственного воздействия на работу нервной системы можно рассмотреть вещества, действие которых направлено на Na+,K+-АТФ-азу. Водносолевой баланс клеток млекопитающих регулируется гормонами надпочечников минералокортикоидами, главным из которых является альдостерон. Стероидную природу имеют и выделяемые из растений вещества, называемые сердечными гликозидами. В виде настоек и в чистом виде они с давних пор используются в лекарственных средствах для лечения сердечной недостаточности и в составе ядов для стрел (тыквенный кураре). Эти вещества взаимодействуют с рецепторными участками, регулирующими работу Na+,K+-АТФ-азы и других ионных насосов.
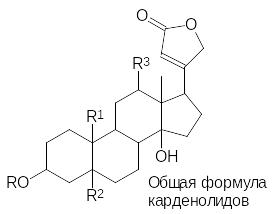
Сердечные гликозиды содержатся во многих растениях. В зависимости от строения их агликоны с пятичленным лактонным кольцом называют карденолидами (приведена их общая формула, где R означает сахаридный остаток, R1 = Н, СН3, СНО и др., R2 и R3 = Н или ОН), тогда как агликоны с шестичленным дважды ненасыщенным лактонным фрагментом называют буфадиенолидами, например:
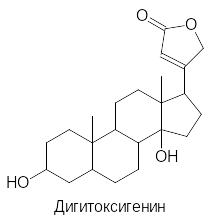

Сахаридная компонента сердечных гликозидов может содержать от одного до трёх и более сахаридных остатков, что определяет их растворимость в воде и биологическую активность (агликоны обычно более токсичны). Активность сердечных гликозидов определяют в так называемых кошачьих единицах действия (КЕД), лягушачьих (ЛЕД) и голубиных единицах действия (ГЕД). Кошачья единица действия равна результату деления одного грамма активного вещества на дозу, вызывающую падение давления крови у кошки на 50 %. Так, например, известный кардиотонический препарат дигоксин, представляющий собой гликозид дигитоксигенина и трисахарида на основе метоксисахара дигитоксозы, характеризуется КЕД около 4000.
Из луковиц белого морского лука выделяют несколько активных гликозидов, одним из которых является сцилларен А (формула его агликона представлена выше), а из красной разновидности этого растения получают гликозид сциллирозид:
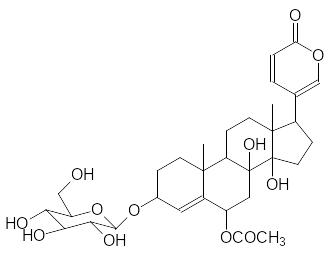
Из сока луковиц белого морского лука получали лекарства, которые с давних пор использовались в народной медицине для лечения желтухи, астмы, судорог, водянки. В отличие от этого активные вещества красного морского лука нашли применение преимущественно в качестве средств для борьбы с крысами. Токсичность сциллирозина (агликон сциллирозида) для крыс рана 0,43 мг/кг, для мышей, соответственно, 0,35 мг/кг.
Буфодиенолиды лежат также в основе ядов, выделяемых кожными железами жаб. В отличие от растительных сердечных гликозидов транспортные (растворимые в воде) формы этих ядов содержат аминокислоты. Так, например, в состав буфотоксина входят пробковая кислота и аргинин:
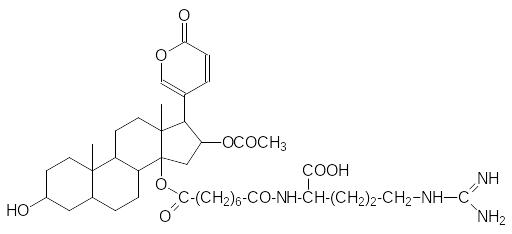
При внутривенном введении токсичность буфотоксина равна 0,3 мг/кг, в сублетальных дозах этот яд вызывает резкое снижение давления крови.
В нервных окончаниях соматической нервной системы находятся везикулы с ацетилхолином, который образуется из ацетилкофермента А и холина при катализе ацетилхолинтрансферазой:
![]()
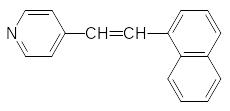
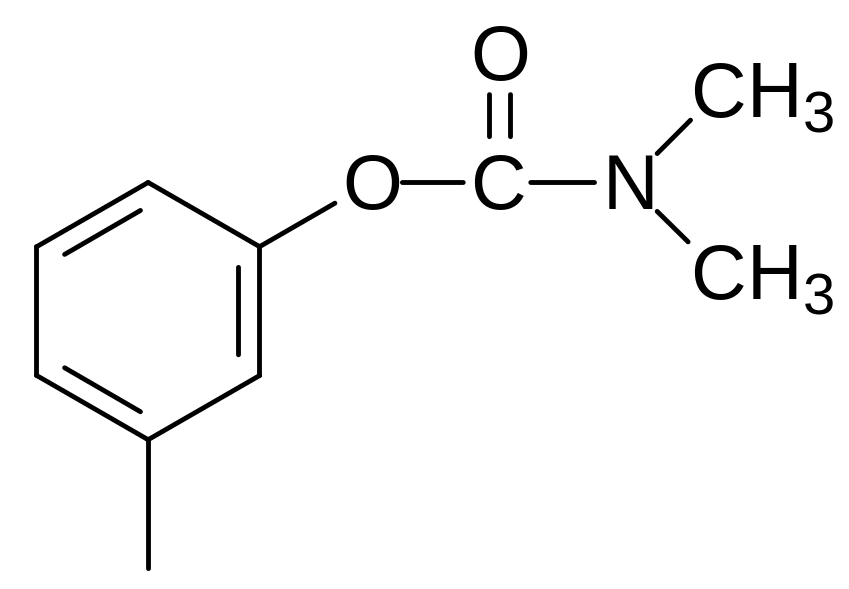
Эта реакция может идти и без ферментативного катализа, поэтому блокаторы ацетилхолинтрансферазы малоэффективны. Одним из них является, например, ‑нафтилпирид-4-илэтилен:
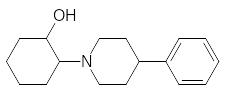
Образование ацетилхолина идет в цитозоле, и для его депонирования в везикулы в их мембрану встроена соответствующая транспортная система (везикулин), работа которой может блокироваться некоторыми веществами, например, производным пиперидина:
Белковые составляющие мембран нейронов разрушаются многими токсинами с гидролазной активностью, содержащимися в ядах змей.
Выход ацетилхолина из везикул, соединившихся с пресинаптической мембраной холинэргического синапса с участием ионов кальция, останавливает токсин, вырабатываемый анаэробной бактерией Clostridium botulinum (от лат. botulus – колбаса). Ботулотоксин представляет собой белковую молекулу, состоящую из двух соединенных дисульфидной связью белковых доменов с общей молекулярной массой около 150000 Дальтон. Восстановительное расщепление этой связи с образованием двух белковых молекул приводит к полной потере токсином его активности. Известно семь антигенных типов ботулотоксинов, которые лишь незначительно различаются по токсичности. Самым сильным ядом является ботулотоксин D (ЛД50 0,0004 мкг/кг). Токсин ботулизма связан с несколькими белками, которые, очевидно, защищают его от действия протеаз в желудочно-кишечном тракте. Ещё один бактериальный токсин Тетаноспазмин, вызывающий столбняк, имеет аналогичное строение, но он находится в комплексе с белком, который не защищает его от протеаз, поэтому токсичность тетаноспазмина проявляется только при попадании в кровь.
Бактерия Clostridium botulinum относится к спорообразующим бактериям. При попадании в неблагоприятные условия она образует спору, которая выдерживает кипячение в течение десятков минут, поэтому консервируемые продукты должны проходить термообработку в автоклавах при температуре около 110С. При попадании в пищевые продукты, которые находятся в бескислородной атмосфере (консервы, колбасы), споры дают начало бактериальным клеткам, которые продуцируют ботулин, вызывающий смертельное заболевание ботулизм. Его симптомы: мышечная слабость, понос, рвота, смерть от остановки дыхания или паралича сердца. Скрытый период действия ботулинического экзотоксина составляет от нескольких часов до двух суток в зависимости от дозы. Одного грамма очищенного токсина D-типа достаточно для смертельного поражения ингаляционным путем одного миллиона человек, правда, для этого один грамм надо разделить на миллион доз. Проводились опыты по использованию ботулинического токсина в качестве боевого отравляющего вещества, но сложности, связанные с созданием стойкого аэрозоля с требуемой концентрацией токсина в приземном слое воздуха, сделала это направление в арсенале болевых отравляющих веществ совершенно бесперспективным. Следствием неудачных экспериментов с токсинным оружием явилось Международное соглашение о полном его запрещении, ставшее одной из вех политики разрядки международной напряженности в 70-е годы ХХ века.
Токсин бактерии Clostridium botulinum представляет собой цинковую протеазу, т.е. фермент, который катализирует гидролиз белков и в активном центре которого находится ион цинка (кофактор). Наиболее чувствительными к действию этой протеазы оказались белки, участвующие в образовании поры для выхода нейромедиатора из связавшейся с пресинаптической мембраной везикулы. Оказалось, что эту особенность ботулинического токсина можно использовать в лекарственных и в косметических целях. Микроинъекции лекарственного препарата на основе этого токсина, продуцируемого штаммом Clostridium botulinum А, под названием Ботокс (компания Аллерган) или Диспорт (компания Ипсен) используются для лечения косоглазия, излишней потливости, подергивания глазных и мимических мышц, напряженного состояния шейных мышц и в других аналогичных случаях. В косметике Ботокс используют для разглаживания морщин. Вызванный Ботоксом эффект достаточно продолжителен, он составляет от двух месяцев до полугода, что объясняется медленным восстановлением белковых составляющих нервных окончаний. Объем продаж Ботокса для медицинских целей одной только компанией Аллерган составляет около 2,5 млрд. долларов США.
Если ни один из перечисленных выше факторов, влияющих на прохождение импульса возбуждения, не вмешался в работу периферической нервной системы, то вышедший из пресинаптической мембраны ацетилхолин диффундирует через синаптическую щель и связывается с соответствующими рецепторами (ионотропными или метаботропными) на постсинаптической мембране, вызывая их структурную перестройку и связанные с этим реакции в иннервируемой клетке. Взаимодействие ацетилхолина с рецепторами на постсинаптической мембране обратимо. Находящийся в разделяющей пресинатическую и постсинаптическую мембрану среде ацетилхолин гидролизуется высокоизбирательным ферментом холинэстеразой. Так прекращается вызванная им активация иннервируемых клеток. С блокировкой холинэстеразы связана биологическая активность многих веществ, среди которых фосфорорганические токсканты нервно-паралитического действия, фосфорорганические и карбаматные инсектициды и многие другие вещества синтетического или природного происхождения. Обширный материал по химии и биологической активности веществ с антихолинэстеразной активностью рассматривается в учебных пособиях по химии и токсикологии агрохимических препаратов и по химии и биологической активности органических производных кислот фосфора.
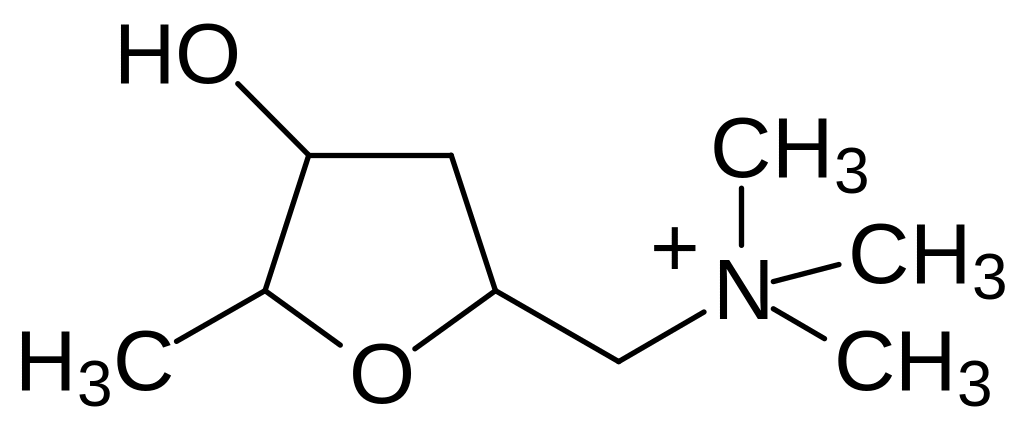
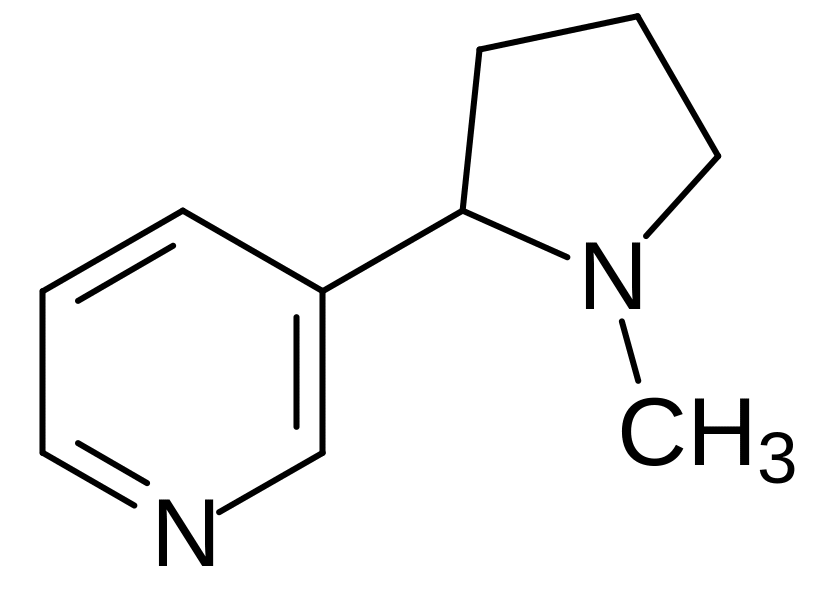
В периферической нервной системе действие ацетилхолина передается через семейство М- и N‑холинорецепторов; их агонистами являются соответственно микотоксин мухомора мускарин и алкалоид никотин:
В периферической нервной системе М-холинорецепторы участвуют в передаче сигналов возбуждения в вегетативных ганглиях и в миокарде. Структура М- и N‑холинорецепторов окончательно не установлена. По имеющимся данным ионотропный N‑холинорецептор представляет собой центр связывания ацетилхолина на образующих натриевый канал пяти белковых субъединицах (α, α, β, γ, δ). Различные варианты сочетаний этих субъединиц обеспечивают многообразие подтипов рецепторов, которые самым разным образом распределены в мускулатуре, в нервной системе и в других органах.
Рецепторы на ацетилхолин в центральной и вегетативной нервной системе отличаются от рецепторов в соматической нервной системе. Их отличие выявлено при изучении веществ, которые действуют также как ацетилхолин – это его агонисты, и которые блокируют действие ацетилхолина – это его антагонисты. В качестве эталонных агонистов холинорецепторов, как отмечалось выше, были выбраны азотсодержащие природные соединения: микотоксин мускарин и алкалоид никотин.
Мускарин имитирует действие ацетилхолина в синапсах нейронов центральной и вегетативной нервной системы и поэтому активируемый им рецепторы получили обозначение М-холинорецепторы. В соответствии с этим активирующие эти рецепторы другие вещества называют М‑холиномиметиками. Холинорецепторы соматической нервной системы достаточно избирательно активируются никотином – это N‑холинорецепторы, ну а другие активирующие N‑холинорецепторы вещества называют N‑холиномиметиками.
Эталонным антагонистом М-холинорецепторов был выбран алкалоид из растений семейства паслёновых, например, из красавки (Atropa belladonna):

Есть, конечно, и другие блокирующие М-холинорецепторы вещества, их общее название М-холинолитики.
Эталонным блокатором ацетилхолина в N‑холинорецепторах соматической нервной системы был выбран тубокурарин – алкалоид из лиан, растущих в бассейнах рек Амазонки и Ориноко. В этих растениях содержится несколько веществ, отличающихся заместителями в ароматических структурных элементах. Один из них – d-тубокурарин представлен формулой:
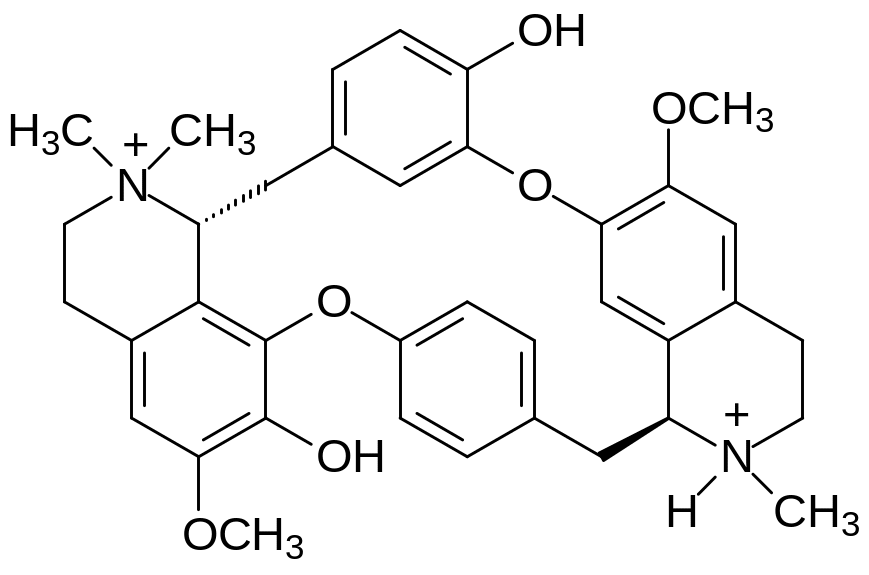
Индейцы используют концентрированный сок содержащих эти алкалоиды лиан для изготовления отравленных стрел, выстреливаемых из духовых трубок. Отсюда его название – трубочный кураре.
Блокировка М-холинорецепторов атропином в вегетативной нервной системе приводит к снижению секреторной активности слюнных, бронхиальных, потовых и других желез, к тахикардии и к снижению тонуса гадких мышц. Атропин преодолевает гематоэнцефалический барьер, вызывая помутнение сознания, галлюцинации и другие расстройства высшей нервной деятельности.
Действие тубокурарина в небольших дозах вызывает миорелаксацию в течение нескольких минут после введения. Его парализующее действие полностью обратимо. В больших дозах тубокурарин может вызывать блокировку и М-холинорецепторов. Расслабление мышц используется в хирургической практике при проведении операций, а также при вправлении сложных вывихов. Миорелаксанты могут быть использованы для снятия спазмов мышц при остеохондрозе, а также для симптоматического лечения эпилепсии или столбняка, вызываемого тетанотоксином анаэробной бактерии Clostridium Tetani. Широкое применение находят периферические релаксанты у ветеринаров и у зоологов. Обездвиживание животных позволяет проводить их лечение и обследование.
Строение тубокураринов с двумя оснóвными атомами азота предполагает его взаимодействие с анионоидными центрами в холинорецепторах, предназначенных для связывания с четвертичным атомом азота в молекуле ацетилхолина. Эта структурная особенность тубокурарина послужила основанием для изучения зависимости токсичности от строения в ряду соединений с двумя триметиламмонийными группами, разделенными несколькими метиленовыми группами формулы:
При этом оказалось, что максимальную токсичность демонстрируют соединения с двумя четвертичными аммонийными группами, у которых n принимает значения 6, 10 и 16. Десять атомов углерода и кислорода разделяют и аминные функциональные группы в молекулах тубокураринов. Для бисаммонийных соединений с гексаметиленовым спейсером (гексаметоний) предлагались различные механизмы взаимодействия с холинорецепторами. Сейчас считается, что гексаметоний взаимодействует с выступающими из мембран участками составляющих натриевый канал белков. В бисаммонийных соединениях с декаметиленовым и гексадекаметиленовым спейсерами атомы азота разделяет расстояние, равное, соответственно, 1,4 и 2,0 нм. Эти значения позволяли предположить, что N‑холинорецепторы расположены в мембране не в случайном порядке, а в виде тетрамеров. При этом анионные центры в расположенных около стороны составленного молекулами рецепторов квадрата разделяет расстояние 1,4 нм, а расстояние между ними по диагонали квадрата составляет 2,0 нм в соответствии с формулой Пифагора:
![]()
Автором этой гипотезы стал советский учёный Н.В.Хромов-Борисов (1958 г.). Он также предположил, что реагирующие на сложноэфирную группу в молекуле ацетилхолина центры, вызывающие перестройку третичной структуры гликопротеидных молекул рецепторов, находятся в рецепторах в центре тетрамера:

При изучении отклика мышечной ткани на бисаммонийные блокаторы N‑холинорецепторов было установлено, что действие многих из них со спейсером, допускающим изменение расстояния между атомами азота, начинается с хаотических сокращений мышц, и только после этого наступает полное обездвиживание. В отличие от этого тубокурарины и другие бисаммонийные соединения с жёстко фиксированным расстоянием между атомами азота вызывают только обездвиживание. В соответствии с этим первые стали называть деполяризующими миорелаксантами, а вторые недеполяризующими. В качестве недеполяризующего аналога тубокурарина можно привести Рокурон – одно из соединений, в которых роль спейсера между двумя атомами азота играет стероидный структурный элемент:
Как отмечалось выше, миорелаксанты находят применение при лечении многих болезненных состояний, связанных с перенапряжением скелетной мускулатуры, а также для обездвиживания животных. Это послужило основанием для получения ряда доступных и легко метаболизирующих соединений с четвертичными атомами азота. В качестве примера можно назвать дитилин, представляющий собой дихолиновый эфир янтарной кислоты (суксаметоний иодид) и имбретил, образующийся в реакции холина с гексаметилдиизоцианатом:
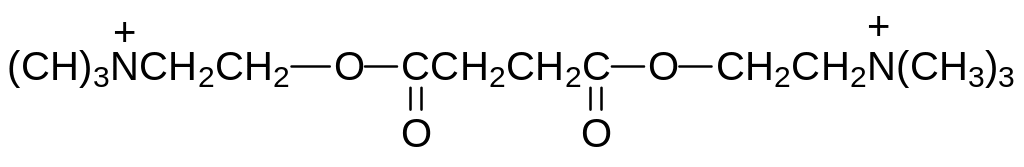
За рубежом чаще всего используют Пиролаксон (флакседил), представляющий собой трииодид триэфира 2-триэтиламмониоэтанола (триэтильного аналога холина) и пирогаллола:
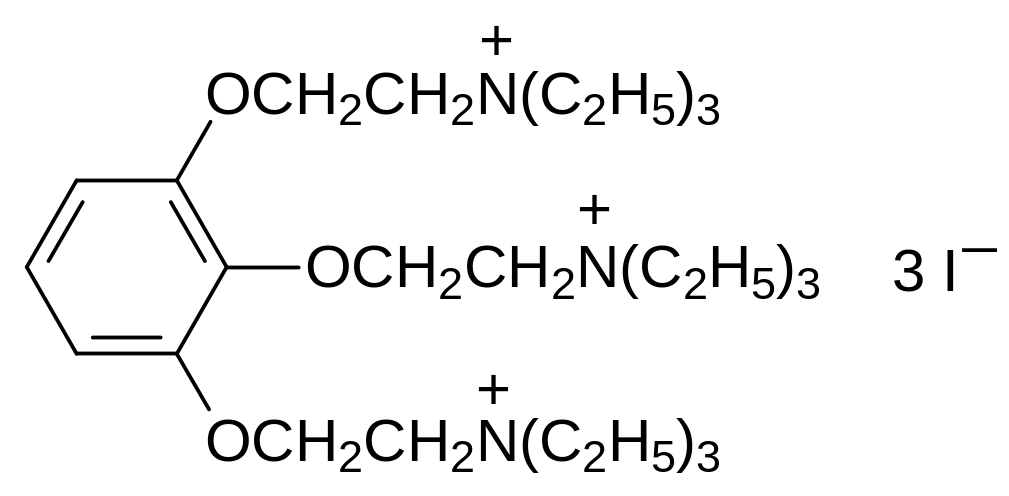
Пиролаксон представляет собой эффективный миорелаксант, близкий по свойствам к тубокураринам. Он противопоказан при гипертонии и сердечно-сосудистой недостаточности.
В конце 80-х годов прошлого века на фоне беспрецедентных уступок в сфере вооружений, сделанных руководителем СССР М.С.Горбачёвым в переговорах с президентом США, увидели свет несколько патентов США, защищающих группу соединений, которые, как говорилось в преамбуле патентов, можно использовать для поражения живой силы противника в виде аэрозолей и в боеприпасах в виде авиабомб, артиллерийских снарядов и боеголовок управляемых и неуправляемых ракет для нанесения так называемых смешанных (микстовых) поражений. Автором всех этих патентов был Харальд Зоммер, а держателем патентов министр обороны США.
В каждом патенте речь шла о веществах, общая формула которых представлялась, например, так:
 ,
,
где R и R1 означают метильную, этильную, пропильную, изопропильную группу, при этом по крайней мере один из остатков R и R1 должен означать метильную группу, а структурные элементы Z выбирают из остатков формул:
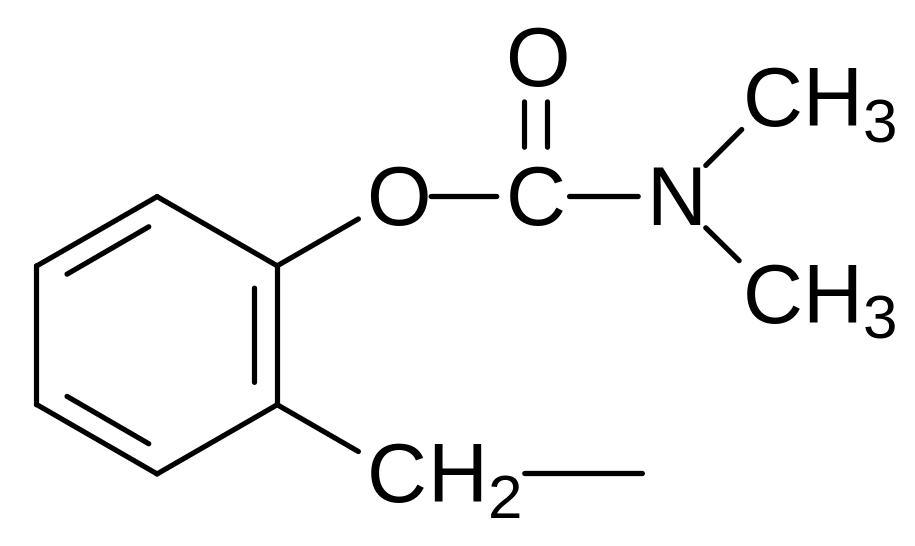 ,
,  или
или
В этих патентах противоионы для четвертичных аммонийных оснований представлены сульфатными, сульфонатными, галогенидными или другими анионами.
Все патенты различались лишь спейсерным элементом, соединяющим остатки Z. Основной способ получения заявленных соединений основан на алкилировании атома азота диметиламинной группы в составе исходного карбаматного соединения соответствующими дигалогенидами, например, по реакции с 4,4´-бис(хлорацетил)бифенилом:

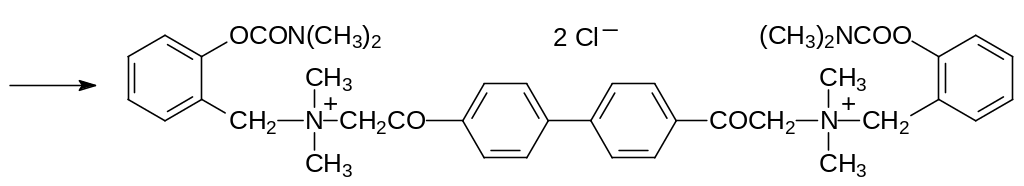
В полученных соединениях был реализован биорациональный подход к структуре новых соединений. В одной молекуле объединялись два действующих на холинорецепторы вещества: бисаммонийные миореласанты и структурные элементы известных холиномиметических карбаматов, использующихся в качестве лекарственных средств:
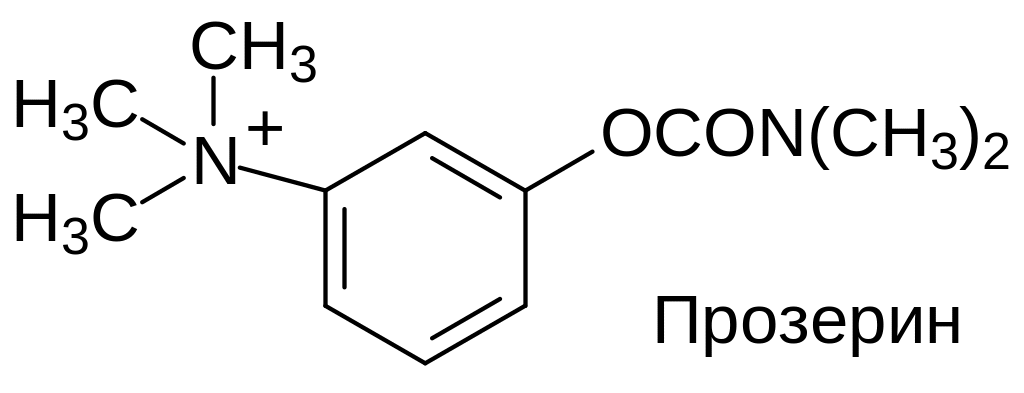
Т.е. прочно связывающиеся с анионными центрами в холинорецепторах четвертичные атомы азота были дополнены структурными элементами, которые взаимодействуют с полярным сайтом, предназначенным для взаимодействия со сложноэфирной группой в молекуле ацетилхолина. При этом сложноэфирной группой в токсикантах является карбаматная группа, которая не гидролизуется эстеразами или пептидазами. Сочетание этих структурных элементов приводит к получению очень эффективных и стабильных агонистов ацетилхолина.
Представленные в патентах вещества – это соли, у которых нет кожнорезорбтивной активности, кроме того, они не летучи. В организм они могут попасть только в виде аэрозоля или вместе с поражающими факторами, которыми могут быть пули, осколки боеприпасов или специальные поражающие элементы в виде, например, чугунных стрелок или пластмассовых шариков. Такие варианты снаряжения боеприпасов разрабатывались в США. При этом было установлено, что в оптимальном случае чугунная стрелка массой 1 г может нести около 1 мг токсиканта. Это означает, что для гарантированного нанесения смертельного поражения человеку таким токсикантом его летальная доза должна быть не более 0,01 мг/кг. Надо сказать, что все представленные в опубликованных патентах вещества имели токсичность в пределах от 0,1 до 0,04 мг/кг, т.е. они не соответствовали минимальным требованиям по токсичности для использования их в качестве средств для нанесения микстовых поражений. Очевидно, что были получены и более токсичные соединения, но их строение не рассекречено. Так, например, в патентах не говорится о том, что важную роль в токсических свойствах четвертичных аммонийных солей играет противоион. Известно, например, что использование в солях таких соединений тетрафенилборатного аниона В(С6Н5)4- повышает их токсичность иногда более чем на порядок.
