
- •Введение
- •Вещества, нарушающие течение биоэнергетических и метаболических процессов
- •Сернистый иприт
- •Азотистые иприты
- •Блокаторы пируватдегидрогеназы
- •Блокаторы цикла Кребса
- •Антивитамины
- •Брометалин
- •Тиомочевины
- •Яды крови
- •Токсиканты периферической нервной системы Нервномышечная передача
- •Вещества раздражающего действия, ирританты
Яды крови
Наиболее важными компонентами крови являются эритроциты. Они предназначены живой природой для переноса клеткам кислорода, обеспечивающего течение биоэнергетических процессов в аэробных организмах. Их форма всем известна – это плоские круглые безъядерные клетки. Такая форма нужна для того, чтобы диффузия кислорода воздуха в цитозоль эритроцита проходила равномерно, преодолевая минимальное расстояние. В эритроцитах кислород связывается с гемоглобином, представляющим собой комплекс из четырёх белковых молекул и четырёх молекул железопорфирина (гема), связанного с белковыми молекулами тиоэфирными связями. Тиоэфирные связи образуются в результате присоединения тиольных групп из включённых в пептидную цепь молекул цистеина к двойным связям винильных групп в составе гема. Включением в состав гемоглобина четырёх белковых молекул и четырёх молекул гема реализуется распространённый в живой природе принцип кооперативного связывания или кооперативного ответа на структурную перестройку одной из белковых молекул. Чем больше объединённых в комплекс компонент выполнило свою функцию, тем легче вовлекаются в соответствующий процесс другие. Механизм такого кооперативного отклика на десорбцию кислорода можно объяснить зависимостью прочности связи молекулы кислорода с гемом от кислотности среды. Кислотное окружение может генерироваться в результате перестройки глобулярной молекулы белка, но биодоступность связанного с гемом кислорода может повышаться и другими кислотами. Так, например, у жителей высокогорий, приспособившихся к жизни в атмосфере с пониженным парциальным давлением кислорода, в крови повышено содержание дифосфоглицериновой кислоты:
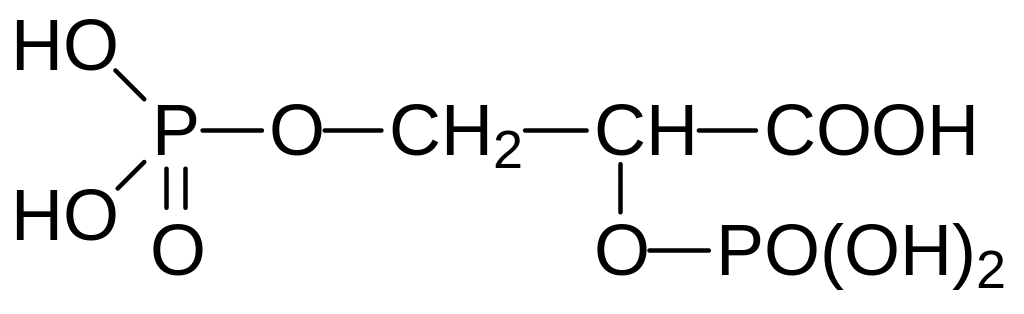
Другим фактором, определяющим кислотность в окружении гема, является угольная кислота, образующаяся из диоксида углерода параметаболическим путём или при катализе карбоангидразой. В соответствии с этим с помощью специальных упражнений можно значительно повысить время задержки дыхания, например, при погружении в воду.
Парциальное давление кислорода в воздухе на уровне моря составляет около 150 мм рт. ст., над артериальной кровью, выходящей из лёгких, парциальное давление кислорода в зависимости от возраста составляет от 70 до 100 мм рт. ст., а над венозной кровью – около 50 мм рт. ст. С разряжением воздуха при подъёме в высоту парциальное давление кислорода снижается и примерно на высоте 6000 м оно оказывается равным давлению кислорода над венозной кровью. Это значит, что без специальной адаптации нахождение на больших высотах опасно для жизни. Альпинисты при восхождении на горы высотой более 6000 м проходят адаптацию или используют кислород в баллонах.
Кровь растворяет кислород, но в связанном с гемоглобином состоянии кислорода в артериальной крови примерно в 70 раз больше. Кислород связывается с двухвалентным атомом железа в составе гема, занимая шестую его координацию. Связанный с кислородом гемоглобин называют оксигемоглобином. В молекуле гема четыре координации атома железа заняты атомами азота его порфириновой основы:
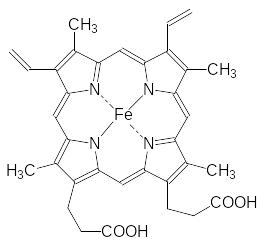
Пятая координация атома железа занята атомом азота имидазольного цикла гистидина в белковой молекуле. Пять атомов азота в окружении двухвалентного атома железа снижают его способность окисляться кислородом. Есть генетическое нарушение, при котором биосинтез белковой компоненты гемоглобина проходит с заменой представляющего для пятой координации имидазольный цикл гистидина на тирозин. Гидроксифенильная группа тирозина координируется на атом железа, но не защищает его от окисления кислородом. У людей с таким генетическим нарушением повышено содержание метгемоглобина, в составе которого атом железа находится в трёхвалентном состоянии. Метгемоглобин не может переносить кислород. У трёхвалентного атома железа в метгемоглобине все шесть координаций уже заняты, поскольку у шестой координации появляется анион для компенсации «лишней» валентности. У людей с генетическим отклонением, связанным с заменой в составе белковой компоненты гистидина на тирозин, содержание метгемоглобина может достигать 50 %, тогда как в нормальном состоянии метгемоглобина в крови около 1,0 %. Понятно, что клетки организма при повышенном содержании метгемоглобина (метгемоглобинемия) испытывают кислородное голодание. Но это не единственная проблема для здоровья. Дело в том, что одноэлектронное окисление атома железа молекулой кислорода переводит её в супероксид – анион-радикал, окисляющий все органические молекулы:
![]()
Для нейтрализации супероксида, образующегося и в нормальных условиях, в эритроцитах содержатся два фермента – супероксиддисмутаза, катализирующая диспропорционирование супероксида с образованием кислорода и пероксидного аниона, и каталаза, которая переводит пероксидный анион в кислород и анион воды.
Существует неферментативное восстановление метгемоглобина в гемоглобин, основанное на его восстановлении глютатионом или аскорбиновой кислотой. Но всё же главную роль в восстановлении метгемоглобина в гемоглобин играет фермент метгемоглобинредуктаза. Этот фермент блокируется многими соединениями, например, нитробензолом и анилином, а также лекарственными препаратами, среди которых некоторые сульфамиды и противомалярийные средства.
В каталитическом центре супероксиддисмутаз находятся ионы меди, марганца и реже железа и никеля. Эти металлы переходной валентности могут переходить в некаталитическое состояние в результате восстановления. Одним из наиболее известных токсикантов, действие которого направлено на восстановительное превращение ионов металлов в ферментах, является очень токсичный газообразный арсин AsH3. Он образуется при действии кислот на арсениды металлов, например:
![]()
Блокировка работы супероксиддисмутазы приводит к накоплению в клетках супероксида, который окисляет ненасыщенные гидрофобные остатки в липидах клеточных мембран эритроцитов. Это переводит эти структурные элементы в гидрофильное карбоксилатное состояние. В мембранах не может больше поддерживаться их двухслойное состояние, они частично растворяются, высвобождая заключенные в цитозоле эритроцитов белки и гемоглобин. Кровь от этого сильно густеет и плохо прокачивается через кровеносные сосуды, а обрывки мембран закупоривают капилляры и почечные канальцы. Часть гемоглобина поступает в мочу, окрашивая её в красный цвет. В тяжёлых случаях отравление арсином заканчивается летальным исходом. В соответствии с этим были планы по использованию арсина в качестве боевого отравляющего вещества.
Близок по токсическим характеристикам к арсину его аналог фосфин РН3, но у него ярко проявляются и общетоксические свойства. Как арсин, так и фосфин являются сильными восстановителями. Угольный противогаз не может быть использован для защиты от этих газов, поскольку на активированном угле идёт их окисление, сопровождающееся сильным экзотермическим эффектом. Фосфин при превышении определенной концентрации может даже поджечь шихту противогаза.
Фосфин образуется при диспропорционировании соединений фосфора с валентностью больше -3 и меньше +5. Так, например, он образуется при нагревании белого фосфора (валентность 0) в щёлочи. Диспропорционируют при нагревании фосфорноватистая и фосфористая кислота, а также неполные эфиры кислот фосфора с промежуточной его валентностью. В отличие от арсина, который не может образоваться в синтезах обычных органических соединений, с фосфином можно встретиться при работе с органическими производными кислот фосфора и в реакциях, сопровождающихся образованием фосфористой кислоты. В качестве примера можно привести получение газообразного бромистого водорода из брома и красного фосфора с добавлением в реакционную массу небольшого количества воды. Экзотермическая реакция разложения образующегося трибромида фосфора водой на бромистый водород и фосфористую кислоту сопровождается её диспропорционированием на фосфин и фосфорную кислоту. Ещё один пример представлен получением иодистоводородной кислоты без образующегося в результате её окисления иода. Для освобождения иодистоводородной кислоты от иода её перегоняют над красным фосфором. Иод реагирует с фосфором с образованием иодида состава Р2I4, разлагающегося водой с образованием иодистого водорода и кислот фосфора в низшей валентности, которые легко диспропорционируют с образованием фосфина и фосфорной кислоты. Это приводит к тому, что фосфин попадает в перегнанную иодистоводородную кислоту, образуя с ней соль.
Ещё один способ получения фосфина представлен взаимодействием фосфидов металлов с водой или с кислотами. Так, в качестве ратицида использовался фосфид цинка, образующийся при пропускании паров фосфора над расплавленным цинком или при восстановлении фосфата цинка прокаливанием с коксом:
![]()
Фосфид цинка не реагирует с водой, но в желудочном соке содержится разлагающая его соляная кислота. Сейчас использование фосфида цинка в качестве ратицида запрещено из-за отравлений птиц содержащими фосфид цинка пищевыми приманками.
Есть также фосфиды металлов, разлагающиеся водой. К ним относится фосфид алюминия. Прессованные из фосфида алюминия таблетки используют для защиты складских помещений от вредителей. Выделяющийся в реакции фосфида алюминия с влагой воздуха фосфин защищает складированную продукцию от всех видов вредителей, начиная с грызунов и кончая микроорганизмами.
Очень токсичен монооксид углерода, который связывается с атомом железа в геме примерно в 250 раз прочнее кислорода из-за карбенового характера атома углерода в его составе. Монооксид углерода образуется при неполном сгорании всех видов топлива. Так, например, в выхлопных газах может содержаться до 10 % этого вещества, называемого также угарным газом. Много его в пороховых газах и в газах, образующихся при взрывах боеприпасов. Для защиты от угарного газа противогазная коробка дополняется так называемым гопкалитовым патроном, заполненным оксидом марганца, который активирован оксидами меди и серебра. Гопкалит катализирует окисление монооксида углерода до диоксида, но при низких температурах гопкалит не защищает от СО, а при длительной работе он может разогреться до высоких температур.
В лабораторных условиях монооксид углерода можно получить, прибавляя муравьиную кислоту к концентрированной серной кислоте при нагревании:
![]()
Монооксид углерода представляет собой исходный продукт в химической промышленности. Основная область его применения – это оксосинтез, разные варианты которого используются для получения многих органических соединений, в числе которых альдегиды, карбоновые кислоты, уксусный ангидрид и многие другие продукты многотоннажного синтеза. Восстановлением монооксида углерода получают метанол и углеводороды.
В качестве катализаторов при получении альдегидов в оксосинтезе используют карбонилы металлов, в частности, тетракарбонил никеля. Карбонилы металлов представляют собой в основном жидкости, образующиеся из металлов и монооксида углерода при нагревании под давлением. Наиболее известны пентакарбонил железа и тетракарбонил никеля. Его каталитическая роль в оксосинтезе описывается уравнениями:
![]()
![]()
Образовавшееся после встраивания моноооксида углерода в связь атома никеля с алкильным остатком металлорганическое соединение разлагается водой с образованием кислоты, а водород разрывает связь карбонильной группы с атомом никеля с регенерацией исходного гидридного никелькарбонильного соединения и альдегида:
![]()
По аналогичной схеме, но с участием в реакции метилиодида при катализе соединениями родия, из метилового эфира уксусной кислоты и монооксида углерода получают ангидрид уксусной кислоты. В общем виде эта реакция представляется взаимодействием родиевого карбонильного комплекса с метилиодидом, встраиванием монооксида углерода в связь родия с метильной группой и разложением образовавшегося промежуточного соединения с образованием иодангидрида уксусной кислоты:
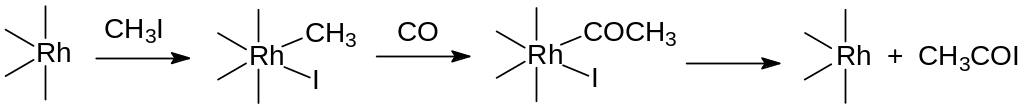
Иодангидрид угольной кислоты реагирует с метилацетатом с образованием уксусного ангидрида и метилиодида, который снова образует реагирующее с монооксидом углерода родийорганическое соединение:
![]()
Известны и другие реакции карбонилирования.
