
- •Введение
- •Вещества, нарушающие течение биоэнергетических и метаболических процессов
- •Сернистый иприт
- •Азотистые иприты
- •Блокаторы пируватдегидрогеназы
- •Блокаторы цикла Кребса
- •Антивитамины
- •Брометалин
- •Тиомочевины
- •Яды крови
- •Токсиканты периферической нервной системы Нервномышечная передача
- •Вещества раздражающего действия, ирританты
Вещества, нарушающие течение биоэнергетических и метаболических процессов
Ферментативные реакции, обеспечивающие течение биоэнергетических процессов, были мишенью первых полученных в алхимических и химических лабораториях ядов и отравляющих веществ.
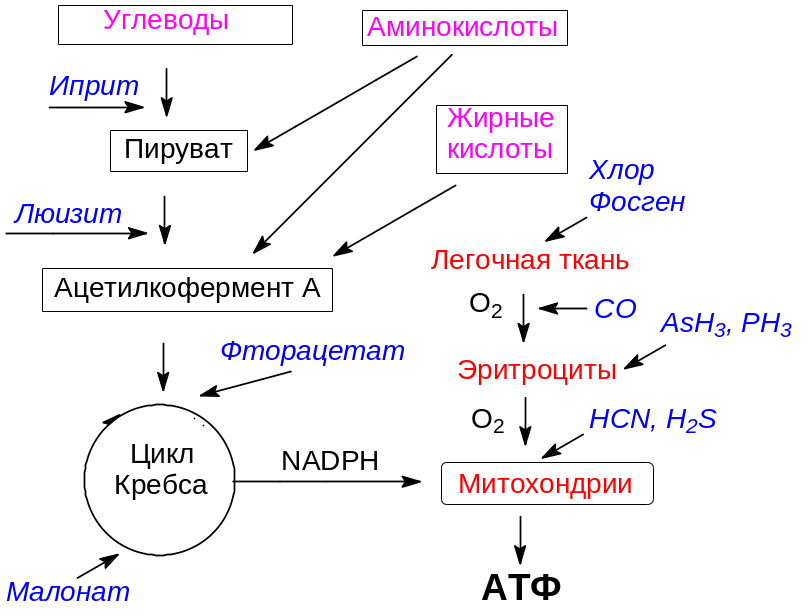
Основными быстро мобилизуемыми источниками главного носителя свободной химической энергии аденозинтрифосфата являются углеводы, в частности, глюкоза. Её катаболическое превращение начинается с реакции фосфорилирования, затем следует изомеризация 6-фосфоглюкозы в 6‑фосфофруктозу и фосфорилирование её с образованием 1,6‑дифосфофруктозы, разлагающейся в присутствии соответствующей альдолазы на фосфоглицериновый альдегид и фосфат диоксиацетона. Далее эти производные трехуглеродных карбонильных соединений в результате последовательных ферментативных реакций превращаются в анаэробных условиях в молочную кислоту и в аэробных условиях – в пировиноградную кислоту. Эти ключевые реакции катаболической ветви метаболизма сопровождаются образованием двух молекул аденозинтрифосфата из одной молекулы глюкозы, что соответствует генерированию всего лишь 7 % от той энергии, которая может быть получена при полном ферментативном окислении глюкозы до диоксида углерода и воды.
Изучение механизма действия одного из первых отравляющих веществ 2,2‑дихлордиэтилсульфида (иприта) показало, что главной мишенью этого вещества с алкилирующей способностью являются гексокиназы – ферменты, которые катализируют реакции фосфорилирования глюкозы и 6-фосфоглюкозы, лежащие в основе её катаболического превращения. Изучение структурных аналогов иприта привело к получению как более токсичных соединений, так и первых препаратов, использовавшихся для химиотерапии злокачественных опухолей.
Далее в катаболические превращения включается пировиноградная кислота, которая может также образовываться в результате превращения аминокислот и некоторых других трехуглеродных метаболитов, например, входящего в состав жиров глицерина. Пировиноградная кислота декарбоксилируется и дегидрируется, превращаясь в ацетильную группу, связанную с коферментом А (ацетилкофермент А). Эту последовательность реакций катализирует мультиферментный комплекс (пируватдегидрогеназный комплекс ферментов), в работе которого принимает участие кофермент тиаминпирофосфат (ТРР) и простетическая группа на основе липоевой кислоты. Она играет роль переносчика ацетильной группы и двух атомов водорода (реакция гидрирования-дегидрирования), когда входящий в её состав дитиолановый цикл раскрывается с образованием двух сульфгидрильных групп, одна из которых ацетилирована (остаток S-ацетилдигидролипоевой кислоты):
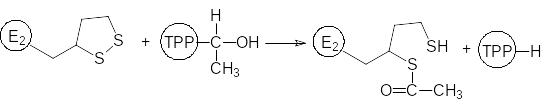
Далее ацетильная группа переносится на кофермент А и простетическая группа липоевой кислоты оказывается в гидрированном состоянии:
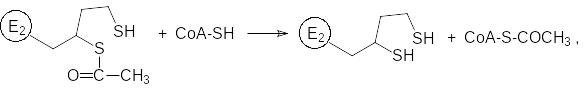
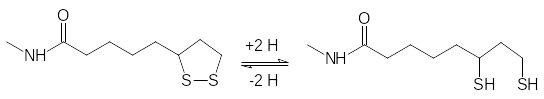
Восстановительный потенциал дигидролипоевой кислоты принимает на себя дегидрогеназный комплекс с флавопротеиновым и никотинамиддинуклеотидным коферментами.
Сульфгидрильные группы образуют прочные связи с многими тяжелыми металлами, но еще более прочными эти соединения оказываются в случае, когда, например, двухвалентный ион тяжелого металла связан с двумя атомами серы с образованием циклической структуры. Понятно, что такое производное дигидролипоевой кислоты не может принимать участие в ферментативных окислительно-восстановительных реакциях и превращение пировиноградной кислоты в ацетилкофермент А становится невозможным. Это объясняет высокую токсичность растворимых в воде солей ртути, кадмия, сурьмы, висмута, свинца, мышьяка, таллия и других подобных металлов.
Итак, при блокировке гексокиназ 2,2‑дихлордиэтилсульфидом полностью останавливается основной катаболический путь получения энергии из углеводов. При нарушении превращения пировиноградной кислоты в ацетилкофермент А остается гликолитический путь образования молочной кислоты из глюкозы, но это всего лишь 7 % от возможной энергии, что слишком мало для клеток теплокровных организмов. Кроме того, при блокировке пируватдегидрогеназного комплекса ферментов становится невозможным и катаболическое превращение той пировиноградной кислоты, которая образуется из аминокислот.
Токсичность соединений тяжелых металлов может быть значительно повышена путем введения их в состав органических соединений с липофильными группами, облегчающих их проникновение через кожные покровы и через клеточные мембраны. Так, например, еще в ХIХ веке врачи мыли руки раствором сулемы для стерилизации кожи, тогда как ртутьорганические соединения обладают уже кожнорезорбтивной активностью. В соответствии с этим некоторые мышьякорганические соединения стали сильнейшими ядами, использовавшимися в качестве отравляющих веществ.
Несмотря на блокировку разных ферментных систем, 2,2‑дихлордиэтилсульфид и такие моноорганодихлорарсины, как люизит, алкилдихлорарсины и фенилдихлорарсин при попадании на кожу оказывают практически одинаковое действие. Вызванное ими нарушение биоэнергетических процессов приводит к остановке работы энергозатратных систем поддержания водно-солевого баланса в клетках, вследствие чего осмотические процессы приводят к гибели клеток в результате исчерпания носителя свободной химической энергии и разрушения клеточных мембран. Внешним проявлением этого становится образование похожих на нарывы волдырей, что послужило основанием для объединения этих столь непохожих веществ в группу кожно-нарывных отравляющих веществ. При попадании во внутренние среды организма как 2,2‑дихлордиэтилсульфид, так и люизит оказываются веществами общеядовитого действия.
Если течение катаболических процессов не было нарушено представленными выше токсикантами, то образовавшийся из пировиноградной кислоты ацетилкофермент А включается в циклической процесс превращений трикарбоновых кислот (цикл Кребса), реагируя с щавелевоуксусной кислотой с образованием лимонной кислоты. Она изомеризуется в изолимонную, из которой далее последовательно образуются кетоглутаровая, янтарная, фумаровая, яблочная и щавелевоукусная кислота, с превращения которой в лимонную кислоту начинался этот процесс. В результате одного оборота цикла Кребса образуются две молекулы диоксида углерода и восстановительный потенциал в виде трех молекул никотинамидадениндинуклеотидфосфата и одной молекулы флавинадениндинуклеотида в восстановленной форме (соответственно 3 молекулы NADРH и одна FADH2). Вместе с молекулой никотинамидадениндинуклеотидфосфата в восстановленной форме, образовавшейся при дегидрировании и декарбоксилировании пировиноградной кислоты, этот восстановительный потенциал поступает в митохондрии, где в процессе окислительного фосфорилирования идёт его окисление до воды с генерированием аденозинтрифосфата – АТФ.
Течение цикла Кребса может быть нарушено веществами, которые похожи по строению на участвующие в естественном превращении метаболиты. Связываясь с соответствующими ферментами, они занимают место метаболитов в активном центре и останавливают работу ферментов, если их превращение по катализируемой ферментом реакции оказывается невозможным. Вещества, блокирующие работу ферментов по механизму конкурентного ингибирования ферментов, называют антиметаболитами. В частности, антиметаболитом уксусной кислоты является фторуксусная кислота. Она превращается в монофторацетилкофермент А, который включается в цикл Кребса, реагируя с оксалоацетатом с образованием фторлимонной кислоты:
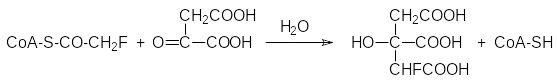
Изомеризация лимонной кислоты в изолимонную на начальном этапе цикла Кребса протекает с промежуточным образованием цис-аконитовой кислоты:
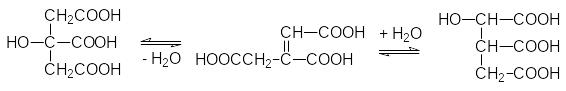
Когда в активный центр катализирующего это превращение фермента цис‑аконитазы попадает фторлимонная кислота, происходит его блокировка, так как образовавшаяся фтораконитовая кислота уже не гидратируется и не может покинуть активный центр фермента, поскольку для этого нужна структурная перестройка его белковой молекулы, которая вызывается только образованием изолимонной кислоты.
По аналогичному механизму может быть блокирована дегидрогеназа янтарной кислоты, катализирующая её превращение в фумаровую кислоту. В частности, антиметаболитом янтарной кислоты является малоновая кислота, у которой только одна метиленовая группа. Занимая место янтарной кислоты, она не может дегидрироваться и блокирует фермент.
Многие производные фторуксусной кислоты могут быть использованы в качестве средств для борьбы с насекомыми и клещами, а также в качестве зооцидов. Однако эти вещества слишком токсичны для теплокровных, вследствие чего применение их на практике строго регламентируется.
Понятно, что высокая избирательность по биохимическим мишеням характерна только для веществ с антиметаболитным механизмом действия. В отличие от этого такие вещества с высокой реакционной способностью, как иприт и люизит, могут реагировать и с другими биомолекулами, и указание на тот или иной механизм их действия относится только к наиболее яркому проявлению их токсических свойств. В частности, иприт является сильнейшим алкилатором и в соответствии с этим он взаимодействует с многими белковыми молекулами и с дезоксирибонуклеиновыми кислотами, показывая высокую мутагенную активность.
Образовавшийся в катаболическом превращении гексоз восстановительный потенциал в виде NADPH используется живой природой для биосинтеза АТФ в митохондриях. Для этого NADPH отдаёт протоны в межмембранное пространство митохондрий, а электроны переходят по пигментам электронпереносящей цепи во внутренней мембране митохондрий, совершая при этом работу по переносу протонов по разным механизмам из внутренней среды митохондрий – матрикса в межмембранное пространство. Путь электронов завершается переносом на молекулу кислорода парой цитохромов а и а3. При этом одновременный перенос четырёх электронов на два атома кислород его молекулы маловероятен. Из этого следует, что восстановление молекулы кислорода должно проходить с максимальной скоростью, для того, чтобы избежать ухода от сайта связывания молекулы кислорода его активных форм, образующихся в результате переноса одного, двух или трёх электронов. АТФ образуется в АТФ-синтазе, в состав которой входят более двадцати белков, в результате диффузии по градиенту концентраций протонов через её часть, встроенную во внутреннюю мембрану митохондрий. В обход АТФ синтазы могут переносить протоны вещества, называемые разобщителями окислительного фосфорилирования. Эти вещества хорошо совместимы с гидрофобными алкильными группами липидов мембран, образующими её внутренний слой, как в анионном, так и протонированном виде. В качестве примеров таких соединений можно назвать замещенные динитрофенолы и 4-гидроксикумарин.
В соответствии с изложенным течение биоэнергетических процессов в клетках аэробных организмов обеспечивается не только генерированием восстановительного потенциала в катаболическом превращении гексоз и в цикле Кребса, но и транспортом кислорода для его окисления.
Кислород переносится клеточными составляющими крови – эритроцитами. Для извлечения его из воздуха у многих животных предназначена лёгочная ткань, где кровь обменивает диоксид углерода на кислород. Капилляры легочной ткани отделены от воздуха в альвеолах минимальным количеством клеточных мембран для максимальной интенсификации его диффузии. Входящие в состав мембран этого барьера белки очень уязвимы. Их третичная и четвертичная структура легко нарушается изменением рН крови или химическими воздействиями. Изменение пространственной структуры этих белков делает включающие их мембраны проницаемыми для плазмы крови. Так, например, некоторые болезненные состояния сопровождаются ацидозом – подкислением крови. Следствием этого становится отёк лёгких – заполнение лёгочных альвеол плазмой крови и связанная с этим кислородная недостаточность из-за сокращения доступа воздуха к капиллярам с кровью.
Отёк лёгких вызывает также присутствие в воздухе паров кислот и оснований (хлористый водород, оксиды серы, аммиак и др.). Сильнейшими токсикантами, действие которых направлено на лёгочную ткань, являются хлор, пары брома, нитрозные газы, хлорангидриды кислот и другие реакционноспособные вещества. Из них хлор и фосген – хлорангидрид угольной кислоты – использовались в качестве боевых отравляющих веществ.
В организме кислород переносится клеточными составляющими крови эритроцитами, которые содержат обратимо связывающий с кислородом гемоглобин – связанный с гемом белок. Атом железа в геме находится в двухвалентном состоянии. Т.е. он образует две связи с двумя атомами азота в полициклической структуре гема:
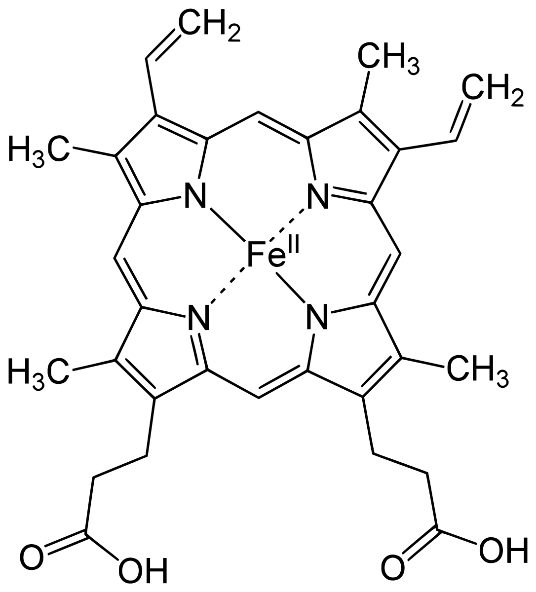
При координационном числе у железа равном 6 пять координаций атома железа в молекуле гема заняты атомами азота – четыре в молекуле самого гема, пятая – атомом азота в имидазольном структурном элементе входящей в состав белковой молекулы гемоглобина, а шестая координация свободна. Именно её и занимает молекула кислорода, выполняя роль лиганда, компенсирующего координационную ненасыщенность атома железа. Эта связь лабильна и при пониженном содержании кислорода в окружении оксигенированного гема молекула кислорода уходит. Это как раз и происходит в организме в тканях, потребляющих кислород для окислительного фосфорилирования. Есть, конечно, вещества, координационная связь которых с атомом железа в геме намного прочнее. Одним из них является монооксид углерода СО. Прочно связываясь с гемоглобином, он лишает кровь возможности переносить кислород, и клетки организма испытывают кислородное голодание, которое может иметь фатальные последствия.
Эритроциты обогащены кислородом и поэтому в них повышена вероятность образования его активных форм. Для их нейтрализации в эритроцитах содержатся супероксиддисмутаза и каталаза. В активном центре супероксиддисмутазы находятся металлы переменной валентности, чаще всего это двухвалентная медь в качестве каталитического кофактора и цинк в качестве кофактора стабилизации третичной структуры. Есть каталазы с ионами марганца и очень редко с ионами железа и никеля. Сильные восстановители переводят, например, двухвалентную медь в одновалентную, которая уже не может выполнять возложенные на неё каталитические функции. Это приводит к накоплению в эритроцитах супероксида, окисляющего липидные компоненты мембран. Окисленные липиды не могут поддерживать двухслойное состояние клеточной мембраны, она лизируется и цитозоль эритроцитов поступает в кровь. Кровь густеет, частички мембран засоряют капилляры и почечные канальцы. В тяжёлых случаях это имеет летальный исход. Главными токсикантами с таким эффектом являются арсин AsH3 и фосфин РН3.
И, наконец, митохондрии. Электронпереносящая цепь внутренней мембраны митохондрий совершает работу по переносу протонов из матрикса в межмембранное пространство. Проходя затем по градиенту концентраций через АТФ-синтазу, эти электроны создадут условия для образования АТФ. Окислительно-восстановительные потенциалы пигментов электронпереносящей цепи по мере переноса электронов от NADPH до кислорода изменяют своё значение в очень узких пределах: разница от -0,32 до +0,82 В распределена на 7 пигментов. В соответствии с этим даже незначительное увеличение потенциала, требуемого, например, для восстановления Fe3+ до Fe2+ в составе цитохрома остановит движение электронов. Дыхательная цепь прервется и прекратится перенос протонов в межмембранное пространство. Следствием этого станет прекращение биосинтеза АТФ соответствующей транслоказой. В обычном транспорте электронов образование трёхвалентного железа подразумевает подход к нему аниона для нейтрализации дополнительного заряда. Обычно это карбоксилатная группа из белковой составляющей цитохрома. Если же вместо карбоксилатной группы трёхвалентное железо свяжется с другим анионом, образующим более прочную связь за счёт особенностей его электронного облака, то это приведет к изменению потенциала восстановления. Но, предшествующий восстановитель в цепи переноса электронов имеет чётко фиксированный восстановительный потенциал и его может оказаться недостаточно для восстановления трёхвалентного железа с таким анионным лигандом. Самыми известными противоионами, блокирующим транспорт электронов в дыхательной цепи, являются цианидный ион, анион азотистоводородной кислоты и сульфидный анион. Присутствие генерирующих эти анионы кислот останавливает синтез АТФ, и клетки лишаются носителя свободной химической энергии. В первую очередь от этого страдает центральная нервная система.
