
- •Введение
- •Вещества, нарушающие течение биоэнергетических и метаболических процессов
- •Сернистый иприт
- •Азотистые иприты
- •Блокаторы пируватдегидрогеназы
- •Блокаторы цикла Кребса
- •Антивитамины
- •Брометалин
- •Тиомочевины
- •Яды крови
- •Токсиканты периферической нервной системы Нервномышечная передача
- •Вещества раздражающего действия, ирританты
Блокаторы цикла Кребса
Круг биохимических превращений трикарбоновых кислот, входящих в цикл Кребса, может быть разорван монофторуксусной кислотой. Фторорганические соединения отличаются высокой химической стабильностью. Поэтому перфторированные алифатические группы часто вводят в молекулы биологически активных веществ для повышения их гидрофобности. Известны также примеры, когда замещение атомом фтора СН-вязи в составе метаболита приводит к получению вещества с антиметаболитной активностью. Размеры и электронные эффекты атомов водорода и фтора различаются достаточно значимо для того, чтобы чувствительные к структурным отличиям ферменты оказались не в состоянии провести превращения с фторированными аналогами метаболитов. В качестве примеров можно назвать 5-фторурацил и монофторуксусную кислоту.
Токсичность монофторуксусной кислоты была обнаружена примерно одновременно в тридцатые годы прошлого века в Германии и в Южной Африке. В Германии токсический эффект фторацетата был выявлен в проводившихся на клеточных культурах опытах по изучению метаболизма различных простейших органических соединений, а в Южной Африке искали причины падежа привезённого из Европы скота на засушливых пастбищах со скудной растительностью. Оказалось, что одно из произрастающих там растений Dichapetalum cymosum содержит фторацетат калия, который и является токсикантом. Травоядные представители местной фауны это растение не ели. Приехавшие из Европы буры назвали его Gifblaar – ядовитый лист. Аборигенные племена знали о токсических свойствах растения и использовали его для приготовления отравленных приманок и стрел. В других растениях этого рода и в некоторых растениях Австралии содержатся ω-фторолеиновая и ω‑фторпальмитиновая кислоты с аналогичным токсическим эффектом.
Механизм действия фторацетата основан на превращении его во фторлимонную кислоту на начальной стадии метаболической деградации ацетата. В реакции с коферментом А фторацетат при катализе ацетилкофермент-А-синтетазой превращается во фторацетилкофермент А, из которого в катализируемой цитратсинтазой реакции с оксалоацетатом образуется фторлимонная кислота. Цитратсинтаза не различает ацетилкофермент А и фторацетилкофермент А, но следующий фермент в цикле Кребса – цисаконитаза блокируется фторцитратом. В активном центре этого фермента находится ион Fе2+, который образует координационную связь с атомом фтора в молекуле фторлимонной кислоты, и превращение цитрата в цисаконитат и далее в изоцитрат становится невозможным.
Токсичность фторацетата для разных представителей животного мира изменяется в пределах от 0,07 до 30 мг/кг. Несмотря на общий характер биоэнергетических процессов у различных представителей животного мира, сопровождающие их метаболические процессы могут различаться интенсивностью по разным направлениям, механизмами транспорта метаболитов и ксенобиотиков. Этим можно объяснить достаточно высокую избирательность такого универсального блокатора биоэнергетических процессов, как монофторуксусная кислота. Очень чувствительны к фторацетатам животные с высокоорганизованной нервной системой. Так, например, ЛД50 натриевой соли монофторуксусной кислоты составляет для кошек от 0,3 до 0,5 мг/кг, для собак от 0,07 до 0,2 мг/кг. Менее токсична эта соль для крыс и мышей с ЛД50 соответственно 2,5 мг/кг и 17 мг/кг. Ещё менее чувствительны к этому яду птицы, для них летальная доза может составлять несколько десятков мг/кг. Это позволяет использовать пищевые приманки с солями фторуксусной кислоты для борьбы с крысами в птичниках. Для человека летальная доза составляет около 5 мг/кг. Отравление фторацетатами развивается в течение нескольких часов, появляются тошнота, рвота, боли желудке, судороги, смерть наступает от нарушения сердечной деятельности. Противоядия от фторацетатов не существует. Небольшой положительный эффект достигается введением успокаивающих и снотворных средств, снижающих потребность организма в АТФ. Все растения практически нечувствительны к фторацетатам, поскольку у них основным поставщиком АТФ является фотосинтез, в котором фторацетат и фторцитрат не участвуют.
Токсичны также фторорганические соединения, метаболические превращения которых могут заканчиваться образованием монофторуксусной кислоты. Выше отмечалось, что токсичными соединениями в некоторых растениях являются также ω‑фторпальмитиновая и ω‑фторолеиновая кислоты. Оказалось, что токсичными являются все ω‑фторзамещенные карбоновые кислоты линейного строения с чётным числом атомов углерода, поскольку они по схеме β-окисления метаболизируются с образованием монофторуксусной кислоты.
В качестве ратицида используется глифтор c токсичностью для грызунов от 4 до 75 мг/кг, при этом его токсичность для птиц составляет более 1000 мг/кг. Глифтор представляет собой смесь продуктов реакции эпихлоргидрина с бифторидом калия, содержащей около 70 % 2-гидрокси-1,3-дифторпропана. Реакцию проводят в диэтиленгликоле при температуре до 150°С:
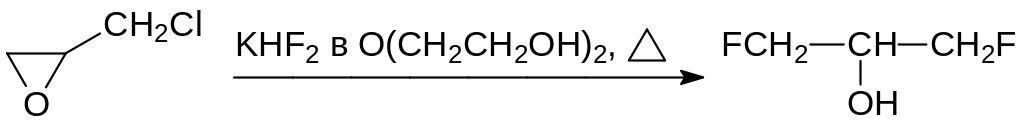
В метаболических процессах легко превращается в монофторуксусную кислоту 2-фторэтанол. Это соединение с высоким давлением паров нельзя использовать в приманках или в составах для борьбы с насекомыми вредителями, но некоторые его производные с более низкой летучестью производились в качестве афицидов (средств для борьбы с тлёй), например:
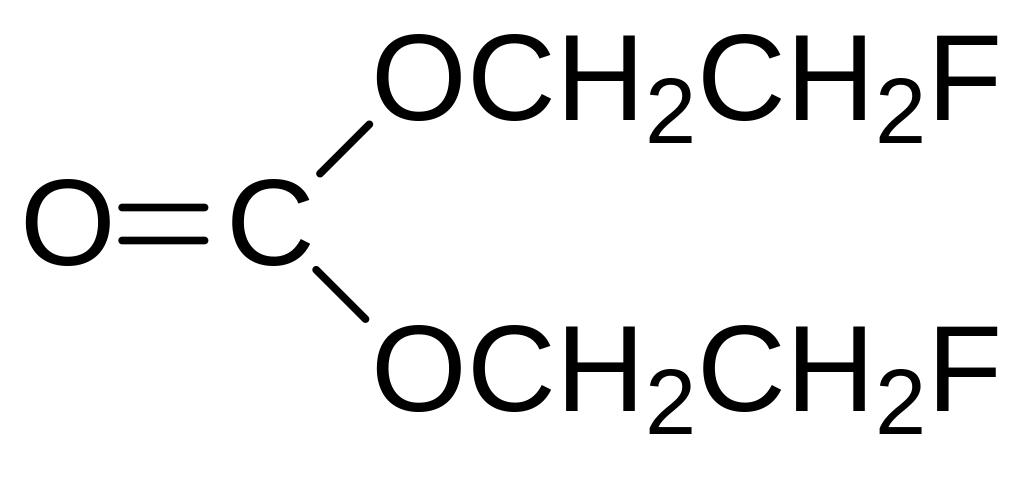

Под названиями Флуракил 100, Мегатокс, Афитокс и др. использовался для обработки пораженных тлёй растений амид монофторуксусной кислоты с ЛД50 для крыс 15 мг/кг, но даже 4‑броманилид с токсичностью около 150 мг/кг не соответствует современным требованиям по безопасности.
Фторуксусную кислоту получают обменным фторированием эфиров хлоруксусной кислоты. При нагревании во вращающемся автоклаве метилхлорацетата и безводного фторида калия при температуре до 220°С образуется метилфторацетат:
![]()
Низкокипящие эфиры фторуксусной кислоты очень опасны в обращении. При концентрации в воздухе 0,1 мг/л приятно пахнущий метилфторацетат убивает кроликов после экспозиции в течение 10 минут. Гидролиз метилового эфира монофторуксусной кислоты идёт при нагревании его со щелочами. Кипячение этого эфира с 10 %-ным раствором гидроксида калия приводит к омылению сложноэфирной группы и к образованию натриевой соли монофторуксусной кислоты, а для гидролитического отщепления атома фтора требуется нагревание кислоты с 30 %-ной щелочью. Это один из немногих способов детоксикации фторацетатов.
В отличие от этиленхлоргидрина этиленфторгидрин нельзя получить с хорошим выходом действием фтористого водорода на этиленоксид. Взаимодействие этих реагентов протекает в основном по пути катализа фтористым водородом полимеризации этиленоксида. Это объясняется низкой нуклеофильностью аниона фтора: нуклеофильность атома кислорода в этиленоксиде значительно выше.
Для синтеза 2 фторэтанола используют реакцию этиленхлоргидрина с фторидом калия, протекающую во вращающемся автоклаве при температуре 130-135°С:
![]()
Ратицидной активностью обладают простые эфиры этиленфторгидрина и фенолов – β-фторфенетолы. Одно из соединений этого ряда, полученное впервые на кафедре ХТОС РХТУ им. Д.И.Менделеева представляет собой 4-(2-фторэтокси)анилид уксусной кислоты. Под названием Монофторин он некоторое время выпускался небольшими партиями в СССР. Для его получения можно использовать реакцию 4-ацетаминофенола с 2-фторэтилгалогенидами. В частности, 1‑бром-2-фторэтан образуется в реакции дибромэтана с безводным фторидом ртути по реакции:
![]()
Обменное фторирование дибромэтана нельзя проводить фторидами щелочных металлов. Они представляют собой сильные основания, вызывающие дегидробромирование дибромэтана с образованием винилбромида.
Для производства Монофторина был разработан способ обменного фторирования дихлорэтана смесью фторида и дифторида калия (KF и KHF2) в диэтиленгликоле.
Монофторин получают по реакции Вильямсона действием 1-фтор-2-хлорэтана или 1-бром-2-фторэтана на 4-ацетиламинофенолят натрия, например:
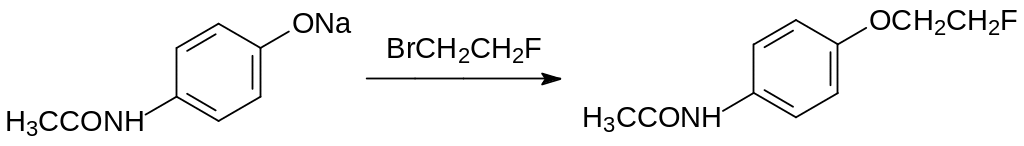
Механизм образования фторацетата из Монофторина не исследовался, но по аналогии с метаболическими превращениями лекарственных средств, в частности, 4-ацетиламинофенетола можно предположить, что окисление этого вещества кислородом при катализе монооксигеназами (Сyt P450), предназначенными для метаболизма ксенобиотиков, приводит к образованию полуацеталя 4-ацетиламинофенола и фторуксусного альдегида. В соответствии с этим метаболизм Монофторина можно представить уравнениями:

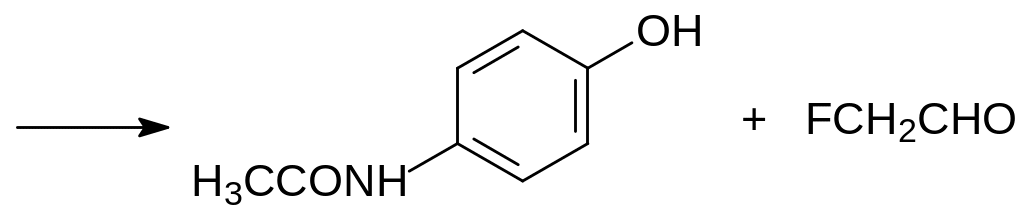
Т.е. образовавшееся в результате окисления Монофторина гидроксильное производное распадается на парацетамол и фторацетальдегид, превращающийся далее в монофторацетат.
Монофторин оказался системным ядом. Это означает, что при отравлении им погибает не только животное, но и эктопаразиты – блохи, вши, клещи, являющиеся переносчиками многих в том числе и эпидемических заболеваний. Системность обязательна для борьбы с грызунами в условиях эпидемий. Её лишены все используемые сегодня ратициды с антикоагулянт ной активностью.
