- •Часть 1. История и общая микробиология.
- •Эндогенные:
- •31) Индикация и идентификация вирусов при различных методах культивирования.
- •§ 96 % Спирт (30 мин.).
- •Часть 2. Инфекция и иммунитет.
- •2. Клеточные факторы врожденного иммунитета. Фагоцитоз.
- •3. Иммунная система организма. Основные клетки иммунной системы и их характеристика.
- •4. Гуморальные факторы врождённого иммунитета.
- •Часть 3. Частная микробиология.
- •Микробиологическая диагностика менингококковой инфекции
- •Бактериологический метод
- •1 Этап – вчк.
- •Морфологические и тинкториальные свойств
- •Культуральные свойства
- •Биохимические свойства
- •Антигенная структура
- •Фагочувствительность
- •Резистентность холерного вибриона
- •Эпидемиология
- •Факторы патогенности холерного вибриона
- •Патогенез холеры
- •Клиническая картина холеры
- •Диагностика
- •Иммунитет
- •Лечение холеры
- •Профилактика холеры
- •Пищевые отравления.
- •Пищевые отравления микробной этиологии
- •Лабораторная диагностика пищевых токсикоинфекций (пти).
- •Профилактика отравлений микробной природы Профилактика токсикоинфекций включает:
- •Профилактика стафилококковых токсикозов:
- •Общая вирусология
- •1. Таксономия, классификация
- •2. Морфология, размеры, особенности генома
- •3. Этапы репродукции
- •4. Эпидемиология
- •5. Патогенез и клинические проявления;
- •6. Лабораторная диагностика, характер исследуемого материала;
- •7. Особенности вирусологического метода диагностики (культивирование, индикация, идентификация вируса);
- •8. Противовирусный иммунитет;
- •9. Специфическая профилактика;
- •10. Лечение
- •5. Терминальная стадия.
- •1. Прямые методы диагностики.
- •2. Косвенные методы диагностики.
- •1. Этиотропное лечение
- •1. Вирусологический (культуральный) метод
- •2. Молекулярно-генетические методы
- •4. Методы детекции антител
- •1. Этиотропное лечение
- •2. Патогенетическая терапия
- •3. Симптоматическая терапия часть 4. Санитарная микробиология.
- •Методы косвенной индикации возможного присутствия возбудителя во внешней среде.
- •Часть 5. Микробиология инфекций, связанных с оказанием медицинской помощи (исмп).
- •Лабораторная диагностика гнойно-воспалительных заболеваний (гвз)
- •Микробиологическое исследование крови
- •Этиологическая структура бактериемий
- •Микробиологическое исследование мочи
- •Полуколичественный метод определения степени бактериурии
- •Внутрибольничная пневмония
- •Послеоперационные инфекции
- •Раневые инфекции
2. Клеточные факторы врожденного иммунитета. Фагоцитоз.
К клеточным факторам врожденного иммунитета относят все фагоциты, объединенные в единую мононуклеарную фагоцитирующую систему. В неё включены: макрофаги и микрофаги. Фагоцитоз-процесс, обеспечивающий резистентность организма, защиту от инородных веществ, в том числе микробов.
Стадии фагоцитоза:
1)хемотаксис;
2)адсорбция микроорганизмов;
3)поглощение объекта путём инвагинации клеточной мембраны;
4)слияние фагосомы с лизосомой клетки;
5)киллинг;
6) презентация.
Для внутренней среды организма большое значение имеют следующие компоненты.
Пропердин - белок свертывающей системы крови. В отношении иммунитета он выступает как активатор системы комплемента.
Цитокины - вещества белковой природы, выделяемые клетками тканей. Главная роль состоит в передаче сигналов меду клетками.
Интерфероны - особый класс цитокинов, обладающий двояким действием. Они синтезируются клеткам, которые подверглись "атаке" вирусов, и выделяются в окружающее их пространство Их выделение сигнализирует о проникновении вирусов в клетку – первое их предназначение. Второе – борьба с возбудителями.
Различают несколько видов интерферонов.
альфа-интерферон.
бетта-интерферон.
Оба продуцируются
клетками при заражении вирусами.
гамма-интерферон синтезируется некоторыми клетками иммунной системы. Т-лимфоциты. Основная биологическая роль состоит в стимулировании некоторых звеньев клеточного иммунитета.
3. Иммунная система организма. Основные клетки иммунной системы и их характеристика.
Иммунная система-это совокупность клеток лимфоидной ткани, которая производит специфический контроль генетического постоянства внутренней среды, гомеостаза и постоянно взаимодействует с другими органами и системами. Лимфоциты-выполняют высокоспецифичное распознавание антигенов. CD-антигены – имеют диагностическое значение при иммунодефицитных состояниях, при аллергических заболеваниях, аутоиммунных заболеваниях, гемобластозах. Т-лимфоциты: 1)CD4+ лимфоциты (Т-хелперы – стимулируют пролиферацию лимфоцитов и трансформацию в плазматические клетки; Т-клетки ГЗТ – опосредуют реакции гиперчувствительности замедленного типа); 2)CD8+ лимфоциты – экспрессируют субпопуляции Т-клеток (Т-супрессоры, Т-киллеры); 3) Т-лимфоциты памяти – сохраняют информацию об антигенах и передают её другим клеткам. В-лимфоциты: 1)В-Т-независимые – участвуют в образовании антител без взаимодействия с Т-лимфоцитами; 2)В-Т-зависимые – превращаются в плазматические клетки при помощи Т-хелперов; 3)В-киллеры – разрушают клетки-мишени без комплемента, но при участии антител; 4)В-супрессоры – угнетают пролиферацию Т-лимфоцитов; 5)В-лимфоциты памяти. NK-клетки – уничтожают опухолевые клетки, а также клетки, инфицированные вирусами, бактериями и простейшими.
4. Гуморальные факторы врождённого иммунитета.
Лизоцим-протеолитический фермент мурамидаза, содержится в крови, лимфе, слезах, молоке, сперме, слизи кишечника, дыхательных путях. Механизм действия – расщепление гликозидных связей в пептидогликане клеточной стенки бактерий, что ведёт к их лизису и способствует фагоцитозу поврежденных клеток. Интерфероны – факторы врожденного противовирусного иммунитета. Представляют собой семейство гликопротеидов. Выработка интерферона резко возрастает при инфицировании вирусами, также интерферон обладает противоопухолевой защитой. Другие защитные белки сыворотки крови: С-реактивный белок, маннозосвязывающий белок, пропердин, фибронектин, бета-лизин.
Гуморальный иммунитет. Понятие. Особенности первичного и вторичного иммунного ответа.
Гуморальный иммунитет – это функция B-клеток. Т-хелперы, получившие антигенную информацию, передают ее В-лимфоцитам. В-лимфоциты формируют клон антителопродуцирующих клеток. При этом происходит преобразование B-клеток в плазматические клетки, секретирующие иммуноглобулины (антитела), которые имеют специфическую активность против внедрившегося антигена.
Иммунный ответ – это цепь последовательных сложных кооперативных процессов, идущих в иммунной системе в ответ на действие антигена в организме.
Различают:
1) первичный иммунный ответ;
2) вторичный иммунный ответ.
Любой иммунный ответ состоит из двух фаз:
1) индуктивной(представление и распознавание антигена);
2) продуктивной(обнаруживаются продукты иммунного ответа).
Далее иммунный ответ возможен в виде по одного из трех вариантов:
1) клеточный иммунный ответ;
2) гуморальный иммунный ответ;
3) иммунологическая толерантность.
Клеточный иммунный ответ – это функция T-лимфоцитов. Происходит образование эффекторных клеток – T-киллеров, способных уничтожать клетки, имеющие антигенную структуру путем прямой цитотоксичности и путем синтеза лимфокинов, которые участвуют в процессах взаимодействия клеток (макрофагов, T-клеток, B-клеток) при иммунном ответе. В регуляции иммунного ответа участвуют два подтипа T-клеток: T-хелперы усиливают иммунный ответ, T-супрессоры оказывают противоположное влияние.
Образующиеся антитела вступают во взаимодействие с антигеном с образованием комплекса АГ – АТ, который запускает в действие неспецифические механизмы защитной реакции. Эти комплексы активируют систему комплемента. Взаимодействие комплекса АГ – АТ с тучными клетками приводит к дегрануляции и выделению медиаторов воспаления – гистамина и серотонина.
При низкой дозе антигена развивается иммунологическая толерантность. При этом антиген распознается, но в результате этого не происходит ни продукции клеток, ни развития гуморального иммунного ответа.
Иммунный ответ характеризуется:
1) специфичностью (реактивность направлена только на определенный агент, который называется антигеном);
2) потенцированием (способностью производить усиленный ответ при постоянном поступлении в организм одного и того же антигена);
3) иммунологической памятью (способностью распознавать и производить усиленный ответ против того же самого антигена при повторном его попадании в организм, даже если первое и последующие попадания происходят через большие промежутки времени).
Вторичный иммунный ответ характеризуется следующими признаками: 1. Более ранним развитием, иногда – даже молниеносным. 2. Меньшей дозой антигена, необходимой для достижения оптимального иммунного ответа. 3. Увеличением силы и продолжительности иммунного ответа за счёт более интенсивной продукции цитокинов (Тh 1 или Th 2 профиля, в зависимости от природы патогена). 4. Усилением клеточных иммунных реакций за счёт более интенсивного образования специфических Т-хелперов 1 типа и цитотоксических Т-лимфоцитов. 5. Усилением образования антител за счёт формирования большего количества Т-хелперов 2 типа и плазматических клеток. 6. Повышением специфичности распознавания иммуногенных пептидов Т-лимфоцитами за счёт увеличения аффинности их антиген-специфических рецепторов. 7. Повышением специфичности синтезируемых антител за счёт изначальной продукции IgG высокой аффинности/авидности.
Формы иммунного ответа. Понятие об иммунопатологии.
Формы иммунного ответа
Иммунный ответ – это цепь последовательных сложных кооперативных процессов, идущих в иммунной системе в ответ на действие антигена в организме.
Различают:
1) первичный иммунный ответ (возникает при первой встрече с антигеном);
2) вторичный иммунный ответ (возникает при повторной встрече с антигеном).
Любой иммунный ответ состоит из двух фаз:
1) индуктивной; представление и распознавание антигена. Возникает сложная кооперация клеток с последующей пролиферацией и дифференцировкой;
2) продуктивной; обнаруживаются продукты иммунного ответа.
При первичном иммунном ответе индуктивная фаза может длиться неделю, при вторичном – до 3 дней за счет клеток памяти.
В иммунном ответе антигены, попавшие в организм, взаимодействуют с антигенпредставляющими клетками (макрофагами), которые экспрессируют антигенные детерминанты на поверхности клетки и доставляют информацию об антигене в периферические органы иммунной системы, где происходит стимуляция Т-хелперов.
Далее иммунный ответ возможен в виде по одного из трех вариантов:
1) клеточный иммунный ответ;
2) гуморальный иммунный ответ;
3) иммунологическая толерантность.
Клеточный иммунный ответ – это функция T-лимфоцитов. Происходит образование эффекторных клеток – T-киллеров, способных уничтожать клетки, имеющие антигенную структуру путем прямой цитотоксичности и путем синтеза лимфокинов, которые участвуют в процессах взаимодействия клеток (макрофагов, T-клеток, B-клеток) при иммунном ответе. В регуляции иммунного ответа участвуют два подтипа T-клеток: T-хелперы усиливают иммунный ответ, T-супрессоры оказывают противоположное влияние.
Гуморальный иммунитет – это функция B-клеток. Т-хелперы, получившие антигенную информацию, передают ее В-лимфоцитам. В-лимфоциты формируют клон антителопродуцирующих клеток. При этом происходит преобразование B-клеток в плазматические клетки, секретирующие иммуноглобулины (антитела), которые имеют специфическую активность против внедрившегося антигена.
Образующиеся антитела вступают во взаимодействие с антигеном с образованием комплекса АГ – АТ, который запускает в действие неспецифические механизмы защитной реакции. Эти комплексы активируют систему комплемента. Взаимодействие комплекса АГ – АТ с тучными клетками приводит к дегрануляции и выделению медиаторов воспаления – гистамина и серотонина.
При низкой дозе антигена развивается иммунологическая толерантность. При этом антиген распознается, но в результате этого не происходит ни продукции клеток, ни развития гуморального иммунного ответа.
Иммунный ответ характеризуется:
1) специфичностью (реактивность направлена только на определенный агент, который называется антигеном);
2) потенцированием (способностью производить усиленный ответ при постоянном поступлении в организм одного и того же антигена);
3) иммунологической памятью (способностью распознавать и производить усиленный ответ против того же самого антигена при повторном его попадании в организм, даже если первое и последующие попадания происходят через большие промежутки времени).
Серодиагностика инфекционных заболеваний. Принципы. Понятия о титре и диагностическом титре.
Серодиагностика инфекционных заболеваний
СЕРОИДЕНТИФИКАЦИЯ |
СЕРОИНДИКАЦИЯ |
СЕРОДИАГНОСТИКА |
||||
От больного исследуемый материал в виде чистой культуры возбудителя |
Обнаружение возбудителя в исследуемом материале |
Обнаружение наличия и количества антител в сыворотке больного |
||||
АГ на поверхности РА |
АГ внутри кл., разруш. кл., гаптен РП, РСК |
РН РП РИФ РИА ИФА |
Много АТ РПГА, РП, РА, РФ, РСК, РИФ, РИА, ИФА, РН |
Мало АТ РСК, РН, РИФ, РИА, ИФА |
||
АГ токсин РФ, РН |
АГ капсид вируса РСК, РТГА, РН |
|||||
Неполные АТ РИФ, ИФА, РИА, Р.Кумбса |
||||||
В серологических реакциях участвуют два специфических комплементарных по отношению друг к другу компонента: антиген (АГ) и антитело (АТ). Они составляют одну специфическую систему типа "ключ+замок". Поэтому, зная один из ингредиентов, например, АГ, можно определить гомологичное ему AT, и наоборот. Смысл любой серологической реакции – визуализировать взаимодействие АГ и АТ в лабораторных условиях.
Серологические реакции ставят в различных направлениях:
1-сероидентификация- определение вида возбудителя при помощи иммунных диагностических сывороток в объеме метода выделения чистой культуры (микробиологического метода). При постановке реакции в данном направлении от больного выделяется чистая культура неизвестного возбудителя, которая используется в качестве АГ (исследуемого материала). В лаборатории необходимо иметь иммунную диагностическую сыворотку, которую получают путем гипериммунизации лабораторных животных (чаще всего кроликов) убитой микробной клеткой известного вида. То есть, иммунная диагностическая сыворотка содержит в себе известныеAT, которые способны вступить в специфическую связь со строго определенным АГ. В зависимости от того, чем представлен видовой АГ (целая микробная клетка, гаптен, часть клетки, экзотоксин, вирус) используются различные серологические реакции.
2 – серодиагностика- определение специфическихATв сыворотке больного при помощи диагностикума (определение напряженности гуморального иммунного ответа). При постановке серологической реакции в направлении серодиагностики от больного в качестве исследуемого материала берется сыворотка крови (AT). В лаборатории должен быть диагностикум.Диагностикум- это стандартная взвесь убитой микробной клетки известного вида (АГ).
3 – сероиндикация- обнаружение возбудителя непосредственно в исследуемом материале от больного при помощи иммунных диагностических сывороток. При постановке серологической реакции в направлении сероиндикации от больного берется исследуемый материал, в составе которого находится предполагаемый возбудитель (АГ). В лаборатории необходимо иметь иммунную диагностическую сыворотку, содержащую специфические известныеAT.
Любая серологическая реакция протекает в две фазы:
1 - специфическая фаза - соединение АГ бактерий с AT, содержащимися в иммунной сыворотке (невидимая фаза реакции);
2 - неспецифическая фаза - образование видимого невооруженным глазом изменения (осадка, кольца, гемолоза и т.д.).
Для диагностики инфекционных заболеваний чаще всего используются следующие реакции: реакция агглютинации (РА), реакция непрямой гемаг- глютинации (РНГА), реакция преципитации (РП), реакция флокуляции (РФ), реакция торможения гемагглютинации (РТГА), реакция связывания комплемента (РСК), реакция нейтрализации (РН) экзотоксинов и вирусов.

Понятие об антигенах и гаптенах. Адъюванты. Антигенная структура бактериальной клетки.
Вещества, которые стимулируют ту или иную форму специфического ответа со стороны иммунной системы, называются антигенами (АГ). Исходя из определения иммунитета как способа защиты организма от живых тел и веществ, несущих признаки генетической чужеродности, понятие антигена может быть сформулировано так: антигены - это генетически чужеродные вещества коллоидной структуры, на введение которых организм отвечает образованием антител или другой формой иммунного ответа.
Адъюванты (лат. adjuvans (adjuvantis) — помогающий, способствующий) — вспомогательные факторы различного происхождения и различной химической природы, оказывающие неспецифическое стимулирующее действие на иммунный ответ при совместном их применении со специфическими антигенами или, другими словами, вещества, повышающие иммунный потенциал вакцин
Антигенные вещества представляют собой высокомолекулярные соединения. Минимальная молекулярная масса, необходимая для проявления антигенности, должна быть не менееI0 000. Антигены обладают определенными свойствами: чужеродностью, антигенностью, специфичностью, иммуногенностью.
Чужеродность– это способность вещества нести на себе признаки генетического отличия. Все клетки организма человека маркированы белками МНС-системы (главный комплекс гистосовместимости). Эти поверхностные белки подразделяются на четыре группы НLA- антигенов.HLA-А,B,C есть на всех клетках человеческого организма,HLA-D– на поверхности иммуннокомпетентных клеток. Эта система обеспечивает разделение «свой-чужой» и используется, например, в трансплантологии.
Антигенность– это большая или меньшая способность вещества вызывать образование антител или сенсибилизацию лимфоцитов.
Специфичность– те особенности, которые позволяют антигену вступать во взаимодействие со строго определенными антителами или сенсибилизированными лимфоцитами. Все естественные белки обладают антигенной специфичностью, которая определяется аминокислотной последовательностью, вторичной и третичной структурой белковой молекулы. Но в наибольшей степени специфичность антигена определяется поверхностно расположенными аминокислотными остатками, называемыми антигенными детерминантами. На поверхности молекулы антигена обычно располагается несколько детерминантных групп, обладающих одинаковой или близкой специфичностью, что обуславливает поливалентность антигена. Детерминантная группа может быть отделена от белкового носителя, и тогда она не вызывает образования антител, но обладает способностью реагировать с ними.
Иммуногенность– способность вызывать состояние иммунологической памяти. Это понятие относится, главным образом, к микробным антигенам, обеспечивающим создание иммунитета (невосприимчивости) к инфекциям.
Антигенными свойствами обладают яды растительного происхождения (рицин, робин, кортин и др.), яды животного происхождения (яд змей, пауков, фаланг, пчел), ферменты, нативные чужеродные белки, различные клеточные элементы тканей и органов, бактерии и их токсины, риккетсии и вирусы. Антигены подразделяют на полноценные и неполноценные (гаптены).
Полноценные антигены– вещества коллоидной структуры, способные вызывать как образование антител, так и вступать с ними в специфическую связь.
Неполноценные антигены (гаптены) имеют свой специфический облик, но не вызывают иммунологических реакций (в частности, выработку антител) при введении в организм. Однако с готовыми антителами они взаимодействуют. К гаптенам принадлежат липиды, сложные углеводы и другие вещества. Эти вещества имеют признаки чужеродности, но не обладают определенными качествами, необходимыми для проявления полноценных антигенных свойств. Гаптены приобретают свойства полноценных антигенов после соединения их с крупномолекулярными веществами, например, с белками. В данном случае белки выполняют несущую (шлепперную) функцию.
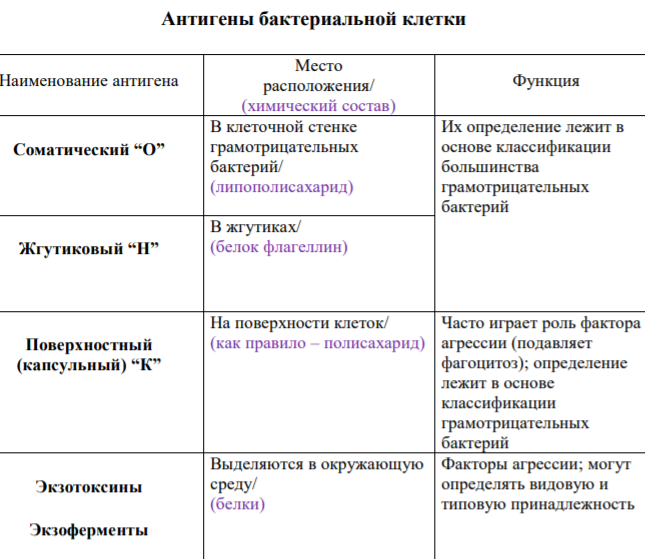
Каждый микроорганизм, как бы примитивно он ни был устроен, содержит несколько антигенов. Среди бактериальных антигенов различают: Н, О, K,Vi, протективный, экзотоксин.
Жгутиковые,Н-антигены, представляют собой белок флагеллин, входят в состав бактериальных жгутиков, термолабильны, разрушаются при температуре 56 - 60° С, но после обработки фенолом сохраняют свои антигенные свойства.
Соматические,О-антигены – располагаются в бактериальной клеточной стенке, термостабильны. Они сохраняются при кипячении более двух часов, не разрушаются после обработки спиртом и формалином. При иммунизации животных живыми культурами, имеющими жгутики, образуются антитела к О- и Н-антигенам, а при иммунизации кипяченой культурой образуются антитела только к О-антигену.
Капсульные, К-антигены – хорошо изучены у сальмонелл и эшерихий. Они тесно связаны с клеточной стенкой и капсулой. По отношению к температуре К-антигены делятся на А, В,L-фракции. А-фракция капсульного антигена термостабильна, выдерживает кипячение в течение двух часов. В-фракция выдерживает нагревание до 60° С в течение часа.L-фракция разрушается при нагревании до 60 °С.
К-антигены располагаются более поверхностно, чем 0-антигены, и часто маскируют последние. Поэтому для выявления 0-антигена необходимо предварительно разрушить К-антигены, что достигается кипячением культуры.
ПоверхностныйVi-антиген – антиген вирулентности у брюшнотифозных и некоторых других энтеробактерий, обладающих высокой вирулентностью. Он относительно термостабилен и представляет собою полисахарид.
Протективныеантигены найдены в экссудатах сибиреязвенного карбункула. Они обладают сильно выраженными иммуногенными свойствами. Подобные вещества были найдены также у возбудителей коклюша, бруцеллеза, туляремии.
+Антигенные свойства бактериальных токсинов. Экзотоксины рассматриваются как внеклеточные антигены. Они обладают полноценными антигенными свойствами в том случае, если являются растворимыми соединениями белковой природы. Экзотоксины, обработанные формалином, утрачивают свои токсигенные свойства, но сохраняют антигенные функции. В данном случае они получили названиеанатоксинов
Интерфероны. Природа, свойства, механизм действия. Основные продуценты. Практическое применение.
Интерферон относится к важным защитным белкам иммунной системы. Открыт при изучении интерференции вирусов, т. е. явления, когда животные или культуры клеток, инфицированные одним вирусом, становились нечувствительными к заражению другим вирусом. Оказалось, что интерференция обусловлена образующимся при этом белком, обладающим защитным противовирусным свойством. Этот белок назвали интерфероном.
Интерферон представляет собой семейство белков-гликопротеидов, которые синтезируются клетками иммунной системы и соединительной ткани. В зависимости от того, какими клетками синтезируется интерферон, выделяют три типа: α, β и γ-интерфероны.
Альфа-интерферон вырабатывается лейкоцитами и он получил название лейкоцитарного; бета-интерферон называют фибробластным, поскольку он синтезируется фибробластами — клетками соединительной ткани, а гамма-интерферон — иммунным, так как он вырабатывается активированными Т-лимфоцитами, макрофагами, естественными киллерами, т. е. иммунными клетками.
Интерферон синтезируется в организме постоянно, и его концентрация в крови держится на уровне примерно 2 МЕ/мл (1 международная единица — ME — это количество интерферона, защищающее культуру клеток от 1 ЦПД50 вируса). Выработка интерферона резко возрастает при инфицировании вирусами, а также при воздействии индукторов интерферона, например РНК, ДНК, сложных полимеров. Такие индукторы интерферона получили название интерфероногенов.
Помимо противовирусного действия интерферон обладает противоопухолевой защитой, так как задерживает пролиферацию (размножение) опухолевых клеток, а также иммуномодулирующей активностью, стимулируя фагоцитоз, естественные киллеры, регулируя антителообразование В-клетками, активируя экспрессию главного комплекса гистосовместимости.
Механизм действия интерферона сложен. Интерферон непосредственно на вирус вне клетки не действует, а связывается со специальными рецепторами клеток и оказывает влияние на процесс репродукции вируса внутри клетки на стадии синтеза белков.
Применение интерферона. Действие интерферона тем эффективнее, чем раньше он начинает синтезироваться или поступать в организм извне. Поэтому его используют с профилактической целью при многих вирусных инфекциях, например гриппе, а также с лечебной целью при хронических вирусных инфекциях, таких как парентеральные гепатиты (В, С, D), герпес, рассеянный склероз и др. Интерферон дает положительные результаты при лечении злокачественных опухолей и заболеваний, связанных с иммунодефицитами.
Интерфероны обладают видоспецифичностью, т. е. интерферон человека менее эффективен для животных и наоборот. Однако эта видоспецифичность относительна.
Получение интерферона. Получают интерферон двумя способами: а) путем инфицирования лейкоцитов или лимфоцитов крови человека безопасным вирусом, в результате чего инфицированные клетки синтезируют интерферон, который затем выделяют и конструируют из него препараты интерферона; б) генно-инженерным способом — путем выращивания в производственных условиях рекомбинантных штаммов бактерий, способных продуцировать интерферон. Обычно используют рекомбинантные штаммы псевдомонад, кишечной палочки со встроенными в их ДНК генами интерферона. Интерферон, полученный генно-инженерным способом, носит название рекомбинантного. В нашей стране рекомбинантный интерферон получил официальное название «Реаферон». Производство этого препарата во многом эффективнее и дешевле, чем лейкоцитарного.
Рекомбинантный интерферон нашел широкое применение в медицине как профилактическое и лечебное средство при вирусных инфекциях, новообразованиях и при иммунодефицитах.
Классы иммуноглобулинов (антитела) Структура. Свойства. Функции.
1. Иммуноглобулины G – это мономеры, включающие в себя четыре субкласса (IgG1; IgG2; IgG3; IgG4), которые отличаются друг от друга по аминокислотному составу и антигенным свойствам. Антитела субклассов IgG1 и IgG4 специфически связываются через Fc-фрагменты с возбудителем (иммунное опсонирование), а благодаря Fc-фрагментам взаимодействуют с Fc-рецепторами фагоцитов, способствуя фагоцитозу возбудителя. IgG4 участвует в аллергических реакциях и неспособен фиксировать комплемент.
Свойства иммуноглобулинов G:
1) играют основополагающую роль в гуморальном иммунитете при инфекционных заболеваниях;
2) проникают через плаценту и формируют антиинфекционный иммунитет у новорожденных;
3) способны нейтрализовать бактериальные экзотоксины, связывать комплемент, участвовать в реакции преципитации.
2. Иммуноглобулины М включают в себя два субкласса: IgM1 и IgM2.
Свойства иммуноглобулинов М:
1) не проникают через плаценту;
2) появляются у плода и участвуют в антиинфекционной защите;
3) способны агглютинировать бактерии, нейтрализовать вирусы, активировать комплемент;
4) играют важную роль в элиминации возбудителя из кровеносного русла, активации фагоцитоза;
5) образуются на ранних сроках инфекционного процесса;
6) отличаются высокой активностью в реакциях агглютинации, лизиса и связывания эндотоксинов грамотрицательных бактерий.
3. Иммуноглобулины А – это секреторные иммуноглобулины, включающие в себя два субкласса: IgA1 и IgA2. В состав IgA входит секреторный компонент, состоящий из нескольких полипептидов, который повышает устойчивость IgA к действию ферментов.
Свойства иммуноглобулинов А:
1) содержатся в молоке, молозиве, слюне, слезном, бронхиальном и желудочно-кишечном секрете, желчи, моче;
2) участвуют в местном иммунитете;
3) препятствуют прикреплению бактерий к слизистой;
4) нейтрализуют энтеротоксин, активируют фагоцитоз и комплемент.
4. Иммуноглобулины Е – это мономеры, содержание которых в сыворотке крови ничтожно мало. К этому классу относится основная масса аллергических антител – реагинов. Уровень IgE значительно повышается у людей, страдающих аллергией и зараженных гельминтами. IgE связывается с Fc-рецепторами тучных клеток и базофилов.
Свойства иммуноглобулинов Е: при контакте с аллергеном образуются мостики, что сопровождается выделением БАВ, вызывающих аллергические реакции немедленного типа.
5. Иммуноглобулины D – это мономеры. Функционируют в основном в качестве мембранных рецепторов для антигена. Плазматические клетки, секретирующие IgD, локализуются преимущественно в миндалинах и аденоидной ткани.
Свойства иммуноглобулинов D:
1) участвуют в развитии местного иммунитета;
2) обладают антивирусной активностью;
3) активируют комплемент (в редких случаях);
4) участвуют в дифференцировке В-клеток, способствуют развитию антиидиотипического ответа;
5) участвуют в аутоиммунных процессах.
Антитоксические сыворотки. Методы получения. Диаферм. Применение антитоксических сывороток в медицине
СЫВОРОТКИ АНТИТОКСИЧЕСКИЕ ЛЕЧЕБНЫЕ - препараты для лечения и экстренной профилактики заболеваний, вызываемых токсигенными бактериями. Содержат антитела против экзотоксинов. Получаются путем иммунизации лошадей анатоксинами. Титруются в реакции флоккуляции. Активность антитоксических сывороток измеряется в международных единицах (МЕ).
Антитоксические сыворотки выпускают с определенным содержанием антитоксинов, измеряемым в международных или антитоксических единицах (МЕ или АЕ). Количество ME в I мл сыворотки называется титром антитоксической сыворотки. Антитела антитоксических сывороток способны нейтрализовать токсины возбудителей дифтерии, столбняка, ботулизма, газовой гангрены. Их применяют как для лечения, так и для экстренной профилактики этих заболеваний. Например, при непосредственной опасности заражения столбняком или анаэробной раневой инфекцией в случае ранения и попадания в рану пыли или почвы.
Антитоксические сыворотки получают иммунизацией лошадей возрастающими дозами анатоксинов, а затем и соответствующими токсинами. Сыворотки подвергают очистке и концентрации методом «Диаферм-3»,контролю на безвредность, апирогенность, затем титруют т. е. определяют содержание антитоксинов в 1 мл препарата. Специфическая активность сывороток или количество антител измеряется с помощью специальных методов, основанных на способности сывороток in vitro и in vivo нейтрализовать соответствующие токсины и выражается в международных антитоксических единицах (ME), принятых ВОЗ. За 1 ME принимается то минимальное количество сыворотки, которое способно нейтрализовать определенную дозу токсина, выражающуюся в стандартных единицах, обозначаемых как смертельные, некротические или реактивные дозы в зависимости от вида токсина и способа титрования.
Титрование антитоксических сывороток может проводиться тремя методами — методами Эрлиха, Рёмера, Района. Титрование сывороток по методу Района осуществляется с помощью реакции флоккуляции по известному анатоксину или токсину, одну Lf (Limes flocculationis —порог флоккуляции) которых нейтрализует одна единица дифтерийного антитоксина. Первичная или инициальная реакция флоккуляции наступает при соответствии количества антигенных единиц анатоксина количеству антитоксинов в исследуемой сыворотке. Исходя из результатов первичной реакции флоккуляции и ведется расчет антитоксических единиц в 1 мл испытуемой сыворотки. Однако метод Рамона является только ориентировочным.
Метод Эрлиха. Перед титрованием сывороток по методу Эрлиха проводят определение условной смертельной (опытной) дозы токсина Lt (Limes tod). Lt определяется с помощью стандартной антитоксической сыворотки, к определенному количеству которой добавляют различные объемы токсина и после выдерживания смеси при комнатной температуре (в течение 45 минут) вводят белым .мышам или морским свинкам. Затем наблюдают за животными четверо суток. За опытную дозу токсина (Lt) принимается то количество токсина, которое в смеси с 1 ME стандартной сыворотки вызывает гибель 50% взятых в опыт животных.
На втором этапе титрования к различным разведениям испытуемой сыворотки добавляют опытную дозу токсина, смесь также выдерживают и вводят животным. По получаемым результатам производят расчет титра испытуемой антитоксической сыворотки.
Метод Рёмера. Титрование антитоксических сывороток по методу Рёмера проводится также в два этапа, но является более экономичным, т. к. опыт проводится на одном животном. Предварительно определяется опытная некротическая доза токсина — Ln (limes necrosis) введением внутрикожно морской свинке различного количества токсина со стандартной сывороткой. За некротическую дозу токсина принимается то его наименьшее количество, которое при внутрикожном введении морской свинке в смеси с 1/50 ME стандартной противодифтериГ'ной сыворотки вызывает на месте введения некроз на 4—5-й день. Затем различные объемы испытуемой сыворотки в смеси с оттитрованной некротической дозой токсина вводятся внутрикожно морской свинке и по результатам проводится расчет титра сыворотки. По методу Рёмера титруется противодифтерийная сыворотка.
В настоящее время выпускаются и применяются следующие антитоксические сыворотки.
1. Противодифтерийную сыворотку получгют гипериммунизацией лошадей дифтерийным анатоксином и применяют, главным образом, с терапевтической целью.
За 1 ME стандартной противодифтерийной сыворотки принимается то ее минимальное количество, которое нейтрализует 100 Dim стандартного токсина для морской свинки весом 250 г. В 1 мл сыворотки должно содержаться не менее 2006 ME. Доза вводимой сыворотки зависит от тяжести заболевания: 5000—15000 ME при легких формах и от 30000—50000 ME при токсических. Сыворотку вводят подкожно или внутримышечно.
2. Противостолбнячная сыворотка представляет собой препарат, получаемый из сыворотки крови лошадей, гипериммунизированных столбнячным анатоксином или токсином.
За 1 ME противостолбнячной сыворотки принимается то количество сыворотки, которое нейтрализует 1000 Dim стандартного токсина для морской свинки весом 350 г.
В 1 мл противостолбнячной сыворотки должно содержаться не менее 1500 ME.
Одна профилактическая доза, равная 3000 ME столбнячного антитоксина, вводится подкожно. С лечебной целью сыворотку вводят в значительно больших дозах (100000—200000 ME) внутримышечно, внутривенно или в спинномозговой канал в зависимости от тяжести заболевания.
3. Противогангренозные моно- и поливалентные сыворотки получают гипериммунизацией лошадей анатоксинами или токсинами возбудителей газовой гангрены (Cl. perfringens, C1.oedematiens, Cl. septicum). Доза каждого типа антитоксинов— 10000 ME в 1 мл сыворотки.
Противогангренозные сыворотки применяются для лечения и профилактики газовой гангрены. С профилактической целью сыворотку вводят внутримышечно, с лечебной — внутривенно, очень медленно, капельным методом.
До установления бактериологического диагноза необходимо вводить смесь моновалентных сывороток или поливалентную сыворотку. После определения вида возбудителя, вызвавшего газовую гангрену, вводится сыворотка соответствующего вида.
4. Противоботулинические антитоксические сыворотки А,В, Е получают от лошадей, гипериммунизированных анатоксинами соответствующих типов, и выпускают в виде моновалентных сывороток, включающих по 1 ампуле сыворотки каждого типа, или в виде поливалентной сывсротки, содержащей в ампуле антитела ко всем 3 типам токсинов клостридий ботулизма.
За I ME противоботулинической сыворотки принимается то наименьшее количество ее, которое обладает способностью нейтрализовать 10000 Dim токсина для мышей весом 18—20г.
Одна лечебная доза антитоксина типа А— 10000 ME, типа В — 5000 ME и типа Е— 10000 ME. Антитоксины типов С и F в настоящее время не включаются в поливалентную сыворотку, так как заболевания, вызываемые возбудителями этих типов, встречаются редко.
При первых признаках заболевания больному вводят поливалентную сыворотку (внутримышечно или внутривенно).
После установления типа токсина назначается соответствующая моновалентная сыворотка.
+С профилактической целью сыворотки вводят людям, употреблявшим продукты, вызвавшие отравление.
Реакция агглютинации, ее разновидности (ориентировочная, непрямая, развернутая). Механизм. Практическое применение.


Реакция агглютинации - определение антигенов по заведомо известной иммунной сыворотке (например, определение вида и антигенной структуры шигелл) - РА на стекле детерминантные группы антигенов связываются с активными центрами антител и наблюдают агглютинацию. Сыворотки получают иммунизацией животных. Поиск антител в сыворотке крови пациента - специфические антитела Ig (возбудитель вызвал иммунную реакцию). Количество антител (титр) - разведение. Затем добавляем диагностикум (инактивированные шигеллы). Титр - максимальное разведение сыворотки, при котором проходит агглютинация.
Реакция непрямой (пассивной) гемагглютиниции. Механизм. Практическое использование.

Реакция ставится:
1) для обнаружения полисахаридов, белков, экстрактов бактерий и других высокодисперстных веществ, риккетсий и вирусов, комплексы которых с агглютининами в обычных РА увидеть не удается,
2) для выявления антител в сыворотках больных к этим высокодисперстным веществам и мельчайшим микроорганизмам.
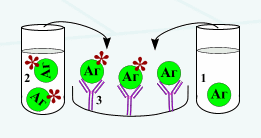
Под непрямой, или пассивной, агглютинацией понимают реакцию, в которой антитела взаимодействуют с антигенами, предварительно адсорбированными на инертных частицах (латекс, целлюлоза, полистерол, оксид бария и др. или эритроциты барана, I(0)-группы крови человека)
В реакции пассивной гемагглютинации (РПГА) в качестве носителя используют эритроциты. Нагруженные антигеном эритроциты склеиваются в присутствии специфических антител к данному антигену и выпадают в осадок. Сенсибилизированные антигеном эритроциты используют в РПГА как эритроцитарный диагностикум для обнаружения антител (серодиагностика). Если нагрузить эритроциты антителами (эритроцитарный антительный диагностикум), то можно применять для выявления антигенов.

Рис. 3. Схема РПГА: эритроциты (1), нагруженные антигеном (3), связываются специфическими антителами (4).
Постановка. В лунках полистироловых планшетов готовят ряд последовательных разведений сыворотки. В предпоследнюю лунку вносят - 0,5 мл заведомо положительной сыворотки и в последнюю 0,5 мл физиологического раствора (контроли). Затем во все лунки добавляют по 0,1 мл разведенного эритроцитарного диагностикума, встряхивают и помещают в термостат на 2 ч.
Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном - оседают в виде пуговки или колечка.
+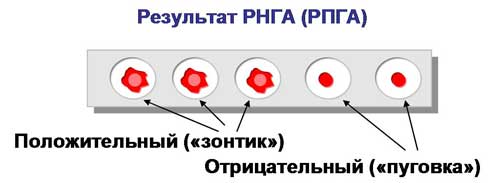
Учет результатов рнга, поставленной с целью обнаружения ботулотоксина.
Возбудитель ботулизма - Clostridium botulinum вырабатывает токсины семи сероваров (А, B, C, D, E, F, G), однако чаще других встречаются серовары А, В, Е. Все токсины отличаются по антигенным свойствам и могут быть дифференцированы в реакциях типоспецифическими сыворотками. Для этой цели можно поставить реакцию пассивной (непрямой) гемагглютинации с сывороткой больного, в которой предполагается наличие токсина, и эритроцитами, нагруженными антителами антитоксических противоботулинических сывороток типов А, В, Е. Контролем служит нормальная сыворотка.
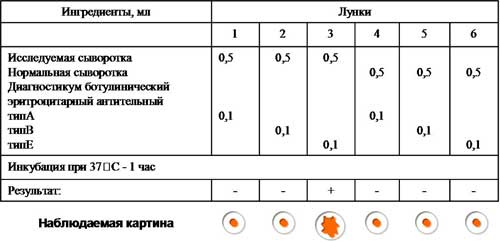
Рис. 3. Постановка и результат РНГА.
Учет. В положительном случае эритроциты оседают на дне лунки в виде ровного слоя клеток со складчатым или зазубренным краем (перевернутый зонтик), в отрицательном - оседают в виде пуговки или колечка.
Вывод: В сыворотке больного обнаружен ботулотоксин тип Е.
Реакция преципитации. Механизм. Разновидности (кольцепреципитация, реакция преципитации в геле). Применение в медицинской практике.
Реакции преципитации (РП) основаны на фенoмене образования видимого осадка (преципитата) или общего помутнения среды после взаимодействия растворимых либо находящихся в коллоидном дисперсном состоянии Аг с АТ. РП ставят в специальных узких пробирках. В качестве реагентов используют гипериммунные преципитирующие сыворотки с высокими титрами АТ к гомологичным Аг. РП позволяет быстро (в течение нескольких секунд) выявлять незначительные количества Аг (можно выявить антиген в таких малых количествах, которые не обнаруживаются химическим путем). Они очень чувствительны, и их применяют для тонкого иммунохимического анализа, выявляющего отдельные компоненты в смеси антигена.
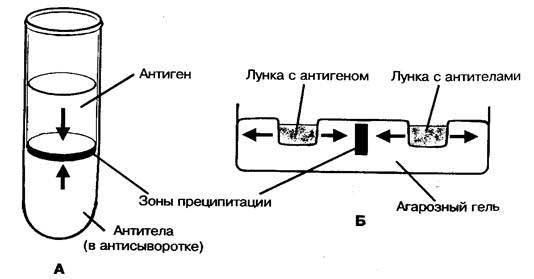
Рис. 5. Схемы реакций преципитации в пробирке (А) и агаре (Б).
Реакция кольцепреципитации Асколи
Постановка. В узкую пробирку диаметром 0,5 см с неразведенной преципитирующей сывороткой в количестве 0,3-0,5 мл, держа ее в наклонном положении, пастеровской пипеткой медленно по стенке наслаивается такой же объем антигена. Пробирку осторожно, чтобы не смешать жидкости, ставят вертикально. При правильном наслоении преципитиногена на сыворотку четко обозначается граница между двумя слоями жидкости. Постановка реакции обязательно сопровождается контролями сыворотки и антигена.
Учет. Результаты реакции учитывают в зависимости от вида антигена и антител через 5-10 мин, 1-2 ч или через 20-24 ч. В случае положительной реакции в пробирке на границе между сывороткой и исследуемым экстрактом появляется преципитат в виде кольца белого цвета.
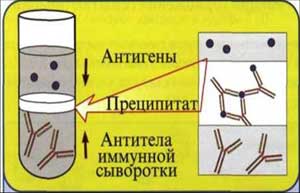
Рис. 4. Реакция кольцепреципитации.
Определение токсигенности коринебактерий дифтерии в реакции преципитации в агаре.
Эта издавна используемая реакция преципитации, предложенная для определения токсичности коринебактерий дифтерии, ставится на фосфатно-пептонном агаре в чашке Петри. Вдоль ее посередине помещают полоску стерильной фильтровальной бумаги, смоченной антитоксической сывороткой. После подсушивания на расстоянии 1 см от края полоски бляшками диаметром 10 мм подсевают выделенные культуры. В одной чашке можно сеять от 3 до 10 культур, одна из которых, контрольная, должна быть заведомо токсигенной. Посевы помещают в термостат.
Учет реакций проводят через 24-48-72 ч. Если культура токсигенная, на некотором расстоянии от полоски бумаги возникают линии преципитата, совпадающие с линиями преципитата контрольной культуры. Они имеют вид «стрел-усиков», которые хорошо видны в проходящем свете.
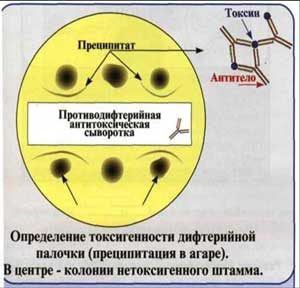
Рис. 5. Реакция преципитации в агаре.
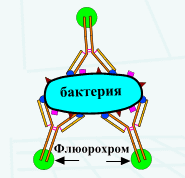
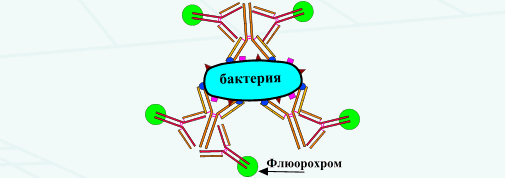
Реакция иммунофлуоресценции (прямая и непрямая). Механизм. Использование в диагностике.
Данный метод является экспрессным и высокочувствительным. Существуют две его разновидности.
При прямом методе к исследуемой взвеси микробов, фиксированной на стекле, добавляют сыворотку, меченную флуорохромом. Образующийся комплекс антиген-антитело при освещении ультрафиолетовыми (сине-фиолетовыми) лучами дает ярко-зеленое свечение.
При непрямом РИФ используют обычные диагностические сыворотки против какого-либо вида микробов. Добавление этой сыворотки к испытуемой взвеси микробов вызывает образование комплекса антиген-антитело. Этот комплекс выявляется с помощью универсальной флюоресцирующей сыворотки, содержащей антитела к гаммаглобулиновой фракции крови того вида животного, от которого была получена диагностическая сыворотка.
Светящийся комплекс выявляют при люминесцентной микроскопии.

Рис. 7. Реакция иммунофлюоресценции (схема).
+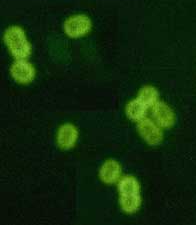
Реакция иммунофлюоресценции - РИФ (метод Кунса).Различают три разновидности метода прямой, непрямой, с комплементом. Реакция Кунса является методом экспресс-диагностики для выявления антигенов микробов или определения антител. Прямой метод РИФ основан на том, что антигены тканей или микробы, обработанные иммунными сыворотками с антителами, меченными флюорохромами, способны светиться в УФ-лучах люминесцентного микроскопа. Бактерии в мазке, обработанные такой люминесцирующей сывороткой, светятся по периферии клетки в виде каймы зеленого цвета. Непрямой метод РИФ заключается в выявлении комплекса антиген - антитело с помощью антиглобулиновой (против антитела) сыворотки, меченной флюорохромом. Для этого мазки из взвеси микробов обрабатывают антителами антимикробной кроличьей диагностической сыворотки. Затем антитела, не связавшиеся антигенами микробов, отмывают, а оставшиеся на микробах антитела выявляют, обрабатывая мазок антиглобулиновой (антикроличьей) сывороткой, меченной флюорохромами. В результате образуется комплекс микроб + антимикробные кроличьи антитела + антикроличьи антитела, меченные флюорохромом. Этот комплекс наблюдают в люминесцентном микроскопе, как и при прямом методе.
Прямая РИФ |
Непрямая РИФ |
|
|
Применяется для экспресс-диагностики инфекционных заболеваний (идентификация возбудителя в исследуемом материале), а также для определения Ат и поверхностных рецепторов и маркеров лейкоцитов (иммунофенотипирование) и др. клеток.
Обнаружение бактериальных и вирусных антигенов в инфекционных материалах, тканях животных и культурах клеток при помощи флюоресцирующих антител (сывороток) получило широкое применение в диагностической практике. Приготовление флюоресцирующих сывороток основано на способности некоторых флюорохромов (например, изотиоцианата флюоресцеина) вступать в химическую связь с сывороточными белками, не нарушая их иммунологической специфичности.
Реакция нейтрализации. Принцип. Механизм. Использование в микробиологии при бактериальных и вирусных инфекциях.
Антитела иммунной сыворотки способны нейтрализовать повреждающее действие микробов или их токсинов на чувствительные кшетки и ткани, что связано с блокадой микробных антигенов антителами, т.е. их нейтрализацией.
Реакцию нейтрализации (РН) проводят путем введения смеси антиген - антитело животным или в чувствительные тест-объекты (культуру клеток, эмбрионы). При отсутствии у животных и тест-объектов повреждающего действия микроорганизмов или их антигенов, токсинов говорят о нейтрализующем действии иммунной сыворотки и, следовательно, о специфичности взаимодействия комплекса антиген - антитело. См. также: реакция флоккуляции.
Реакция нейтрализации вирусов в культуре клеток: А - цитопатогенный эффект (ЦПЭ) в результате размножения вирусов; Б - ЦПЭ отсутствует в результате нейтрализации вирусов антителами. |
|
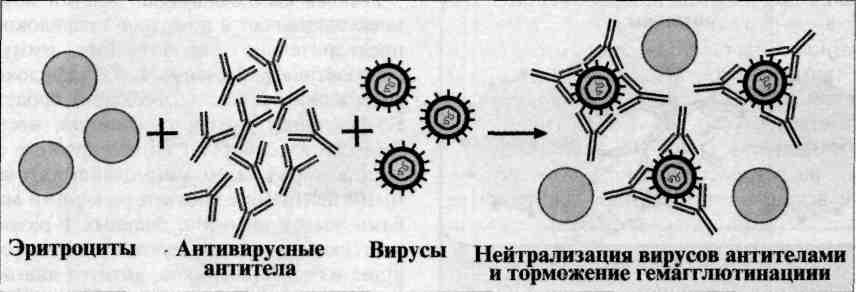
Реакция гемагглютинации и торможения гемагглютинации в вирусологии.
Реакция торможения гемагглютинации (РТГА) - метод идентификации вируса или выявления противовирусных антител в сыворотке крови больного, основанный на феномене отсутствия агглютинации эритроцитов препаратом, содержащим вирус, в присутствии иммунной к нему сыворотки крови.
Реакция торможения гемагглютинации (РТГА) основана на блокаде, подавлении антигенов вирусов антителами иммунной сыворотки, в результате чего вирусы теряют свойство агглютинировать эритроциты.
РТГА применяют для диагностики многих вирусных болезней, возбудители которых (вирусы гриппа, кори, краснухи, клещевого энцефалита и др.) могут агглютинировать эритроциты различных животных.
Механизм. Типирование вируса проводят в реакции торможения гемаг-глютинации (РТГА) с набором типоспецифических сывороток. Результаты реакции учитывают по отсутствию гемагглютинации. Подтипы вируса А с антигенами H0N1, H1N1, Н2N2, H3N2 и др. могут быть дифференцированы в РТГА с набором гомологичных типоспецифических сывороток.
+
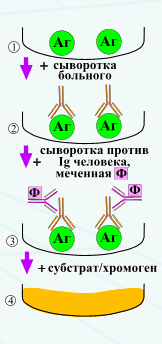
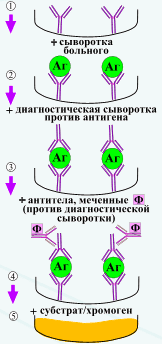
Иммуноферментный метод исследования. Принцип метода. Определение антигенов и антител с помощью ИФА.
Иммунофериентный анализ, или метод (ИФА) - выявление антигенов с помощью соответствующих им антител, конъюгированных с ферментом-меткой (пероксидазой хрена, бета-галактозидазной и или щелочной фосфатазой). После соединения антигена с меченой ферментом иммунной сывороткой в смесь добавляют субстрат/хромоген. Субстрат расщепляется ферментом и изменяется цвет продукта реакции - интенсивность окраски прямо пропорциональна количеству связавшихся молекул антигена и антител. ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики сальмонеллеза, микоплазмозов и др., а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях - 1010 - 1012 г/л.
Твердофазный
ИФА - вариант теста, когда один
из компонентов иммунной -реакции
(антиген |
|
Конкурентный ИФА для определения антигенов: искомый антиген(1) и меченый ферментом антиген(2) конкурируют друг с другом за антитела (3), сорбированные на твердой фазе. |
|
Конкурентный ИФА для определения антител: искомые антитела и меченые ферментом антитела конкурируют друг с другом за антигены, сорбированные на твердой фазе.
ИФА применяют для диагностики вирусных, бактериальных и паразитарных болезней, в частности для диагностики ВИЧ-инфекций, гепатита В и др., а также определения гормонов, ферментов, лекарственных препаратов и других биологически активных веществ, содержащихся в исследуемом материале в минорных концентрациях (1010-1012 г/л).
Гиперчувствительность замедленного типа. Механизм ее проявления. Аллергические пробы. Практическое использование в диагностике инфекционных заболеваний.
К аллергическим реакциям относят два типа реагирования на чужеродное вещество: гиперчувствительность немедленного типа (ГНТ) и гиперчувствительность замедленного типа (ГЗТ). К ГНТ относятся аллергические реакции, проявляющиеся уже через 20--30 мин после повторной встречи с антигеном, а к ГЗТ -- реакции, возникающие не ранее чем через 24--48 ч. Механизм и клинические проявления ГНТ и ГЗТ различны. ГНТ связана с выработкой антител, а ГЗТ -- с клеточными реакциями.
ГЗТ впервые описана Р. Кохом (1890). Эта форма проявления не связана с антителами, опосредована клеточными механизмами с участием Т-лимфоцитов. К ГЗТ относятся следующие формы проявления: туберкулиновая реакция, замедленная аллергия к белкам, контактная аллергия.
В отличие от реакций I, II и III типов реакции IV типа не связаны с антителами, а обусловлены клеточными реакциями, прежде всего Т-лимфоцитами. Реакции замедленного типа могут возникать при сенсибилизации организма:
1. Микроорганизмами и микробными антигенами (бактериальными, грибковыми, протозойными, вирусными); 2. Гельминтами; 3. Природными и искусственно синтезированными гаптенами (лекарственные препараты, красители); 4. Некоторыми белками.
Следовательно, реакция замедленного типа может вызываться практически всеми антигенами. Но наиболее ярко она проявляется на введение полисахаридов, низкомолекулярных пептидов, т. е. малоиммуногенных антигенов. При этом реакцию вызывают малые дозы антигенов и лучше всего при внутрикожном введении.
Механизм аллергической реакции этого типа состоит в сенсибилизации Т-лимфоцитов-хелперов антигеном. Сенсибилизация лимфоцитов вызывает выделение медиаторов, в частности интерлейкина-2, которые активируют макрофаги и тем самым вовлекают их в процесс разрушения антигена, вызвавшего сенсибилизацию лимфоцитов. Цитотоксичность проявляют также и сами Т-лимфоциты. О роли лимфоцитов в возникновении аллергий клеточного типа свидетельствуют возможность передачи аллергии от сенсибилизированного животного несенсибилизированному с помощью введения лимфоцитов, а также подавление реакции при помощи антилимфоцитарной сыворотки.
Морфологическая картина при аллергиях клеточного типа носит воспалительный характер, обусловленный реакцией лимфоцитов и макрофагов на образующийся комплекс антигена с сенсибилизированными лимфоцитами.
Аллергические реакции клеточного типа проявляются в виде туберкулиновой реакции, замедленной аллергии к белкам, контактной аллергии.
Туберкулиновая реакция возникает через 5--6 ч после внутрикожного введения сенсибилизированным туберкулезной палочкой животным или человеку туберкулина, т. е. антигенов туберкулезной палочки. Выражается реакция в виде покраснения, припухлости, уплотнения на месте введения туберкулина. Сопровождается иногда повышением температуры тела, лимфопенией. Развитие реакции достигает максимума через 24--48 ч. Туберкулиновая реакция используется с диагностической целью для выявления заболеваний туберкулезом или контактов организма с туберкулезной палочкой.
Замедленная аллергия возникает при сенсибилизации малыми дозами белковых антигенов с адъювантом, а также конъю-гатами белков с гаптенами. В этих случаях аллергическая реакция возникает не раньше чем через 5 дней и длится 2--3 нед. Видимо, здесь играют роль замедленное действие конъюгированных белков на лимфоидную ткань и сенсибилизация Т-лимфо-цитов.
Контактная аллергия возникает, если антигенами являются низкомолекулярные органические и неорганические вещества, которые в организме соединяются с белками, образуя конъюга-ты. Конъюгированные соединения, выполняя роль гаптенов, вызывают сенсибилизацию. Контактная аллергия может возникать при длительном контакте с химическими веществами, в том числе фармацевтическими препаратами, красками, косметическими препаратами (губная помада, краска для ресниц). Проявляется контактная аллергия в виде всевозможных дерматитов, т. е. поражений поверхностных слоев кожи.
Значение. Все реакции гиперчувствительности, в том числе и ГЗТ имеют большое значение. Их механизмы лежат в основе воспаления, которое способствует локализации инфекционного агента или иного антигена в пределах определённых тканей и формированию полноценной иммунной реакции защитного характера.
Аллергические пробы - биологические реакции для диагностики ряда заболеваний, основанные на повышенной чувствительности организма, вызванной аллергеном.
При многих инфекционных заболеваниях за счет активации клеточного иммунитета развивается повышенная чувствительность организма к возбудителям и продуктам их жизнедеятельности.
На этом основаны аллергические пробы, используемые для диагностики бактериальных, вирусных, протозойных инфекций, микозов и гельминтозов. Аллергические пробы обладают специфичностью, но нередко они бывают положительными у переболевших и привитых.
Все аллергические пробы подразделяют на две группы -- пробы in vivo и in vitro.
К первой группе {in vivo) относятся кожные пробы, осуществляемые непосредственно на пациенте и выявляющие аллергию немедленного (через 20 мин) и замедленного (через 24 -- 48 ч) типов.
Аллергические пробы in vitro основаны на выявлении сенсибилизации вне организма больного. Их применяют тогда, когда по тем или иным причинам нельзя произвести кожные пробы, либо в тех случаях, когда кожные реакции дают неясные результаты.
Для проведения аллергических проб используют аллергены -- диагностические препараты, предназначенные для выявления специфической сенсибилизации организма. Инфекционные аллергены, используемые в диагностике инфекционных заболеваний, представляют собой очищенные фильтраты бульонных культур, реже взвеси убитых микроорганизмов или АГ, выделенные из них.
Кожные пробы. Инфекционные аллергены вводят, как правило, внутрикожно или накожно, путем втирания в скарифицированные участки кожи. При внутрикожном способе в среднюю треть передней поверхности предплечья специальной тонкой иглой вводят 0,1 мл аллергена. Через 28 -- 48 ч оценивают результаты реакции ГЗТ, определяя на месте введения размеры папулы.
Неинфекционные аллергены (пыльца растений, бытовая пыль, пищевые продукты, лекарственные и химические препараты) вводят в кожу уколом (прик-тест), накожно путем скарификации и втирания или внутрикожной инъекцией разведенного раствора аллергена.
В качестве отрицательного контроля используют ИХН, в качестве положительного -- раствор гистамина. Результаты учитывают в течение 20 мин (ГНТ) по величине папулы (иногда до 20 мм в диаметре), наличию отека и зуда. Внутрикожные пробы ставят в случае отрицательного или сомнительного результата прик-теста. По сравнению с последним, дозу аллергена уменьшают в 100-5000 раз.
Кожные пробы на наличие ГЗТ широко применяют для выявления инфицированности людей микобактериями туберкулеза (проба Манту), возбудителями бруцеллеза (проба Бюрне), лепры (реакция Митсуды), туляремии, сапа, актиномикоза, дерматомикозов, токсоплазмоза, некоторых гельминтозов и др.
Пробы in vitro. Эти методы исследования безопасны для больного, достаточно чувствительны, позволяют количественно оценить уровень аллергизации организма.
В настоящее время разработаны тесты для определения сенсибилизации, основанные на реакциях Т- и B-лимфоцитов, тканевых базофилов, выявлении общих специфических IgE в сыворотке крови и др. К ним относятся реакции торможения миграции лейкоцитов и бласттрансформации лимфоцитов, специфическое розеткообразование, базофильный тест Шелли, реакция дегрануляции тканевых базофилов, а также аллергосорбентные методы (определение специфических IgE в сыворотке крови).
Реакция торможения миграции лейкоцитов (РТМЛ). РТМЛ основана на подавлении миграции моноцитов и других лейкоцитов под действием медиаторов, вырабатываемых сенсибилизированными лимфоцитами, в присутствии специфического аллергена.
Реакция бласттрансформации лимфоцитов (РБТ). В основе этой реакции лежит способность нормальных лимфоцитов периферической крови вступать в митоз и превращаться в бластные формы при культивировании их in vitro под действием специфических факторов -- аллергенов и неспецифических стимуляторов митогенеза -- митогенов (фитогемагглютинин, конканавалин А, липополисахариды и другие вещества).
Реакция специфического розеткообразования. Розетки -- характерные образования, возникающие in vitro в результате прилипания эритроцитов к поверхности иммунокомпетентных клеток. Розеткообразование может происходить спонтанно, поскольку Т-лимфоциты человека содержат рецепторы к эритроцитам барана. Спонтанное розеткообразование здоровых людей составляет 52 -- 53% и служит показателем функционального состояния Т-лимфоцитов. Этот феномен воспроизводится также и в том случае, если используют эритроциты, на которых фиксированы соответствующие аллергены.
Реакция дегрануляции тканевых базофилов. Методика основана на том, что под действием аллергена происходит дегрануляция тканевых базофилов крысы, предварительно сенсибилизированных цитофильными AT из сыворотки крови больного.
Базофильный тест Шелли. Известно, что базофильные гранулоциты человека или кролика также дегранулируются в присутствии сыворотки больного и аллергена, к которому чувствителен данный пациент.
Определение антител класса IgE in vitro. Лабораторная диагностика заболеваний, в основе которых лежит ГНТ, основана на определении аллергенспецифических IgEанти-IgE. При использовании радиоактивной метки метод носит название радиоаллергосорбентного теста (PACT), но чаще в качестве метки используют фермент или флюоресцирующее вещество (ФАСТ). Время анализа -- 6 -- 7 часов. Принцип метода: фиксированный на твердой основе известный аллерген инкубируют с сывороткой крови больного; находящиеся в сыворотке специфические IgEанти-IgE связываются с аллергеном и, таким образом, остаются фиксированными на основе и могут вступать в специфическое взаимодействие с добавляемыми мечеными анти-IgE.
Гиперчувствительность немедленного типа. Анафилаксия. Механизм ее возникновения. Методы предупреждения.
Гиперчувствительность немедленного типа (ГНТ) -- гиперчувствительность, обусловленная антителами (IgE, IgG, IgM) против аллергенов. Развивается через несколько минут или часов после воздействия аллергена: расширяются сосуды, повышается их проницаемость, развиваются зуд, бронхоспазм, сыпь, отеки. Поздняя фаза ГНТ дополняется действием продуктов эозинофилов и нейтрофилов.
К ГНТ относятся I, II и III типы аллергических реакций (по Джеллу и Кумбсу): I тип -- анафилактический, обусловленный главным образом действием IgE; II тип -- цитотоксический, обусловленный действием IgG, IgM; III тип -- иммунокомплексный, развивающийся при образовании иммунного комплекса IgG, IgM с антигенами. В отдельный тип выделяют антирецепторные реакции.
Основные типы реакций гиперчувствительности
I тип -- анафилактический. При первичном контакте с антигеном образуются IgE, которые прикрепляются Fc-фрагментом к тучным клеткам и базофилам. Повторно введенный антиген перекрестно связывается с IgE на клетках, вызывая их дегрануляцию, выброс гистамина и других медиаторов аллергии.
Первичное поступление аллергена вызывает продукцию плазмацитами IgE, IgG4. Синтезированные IgE прикрепляются Fc-фрагментом к Fc-pe цепторам (FceRl) базофилов в крови и тучных клеток в слизистых оболочках, соединительной ткани. При повторном поступлении аллергена на тучных клетках и базофилах образуюто комплексы IgE с аллергеном (перекрестная сшивка FceRl антигеном), вызывающие дегрануляцию клеток.
Клинические проявления гиперчувствительности I типа.
Клинические проявления гиперчувствительности I типа могут протекать на фоне атопии. Атопия -- наследственная предрасположенность к развитию ГНТ, обусловленная повышенной выработкой IgE-антител к аллергену, повышенным количеством Fc-рецепторов для этих антител на тучных клетках, особенностями распределения тучных клеток и повышенной проницаемостью тканевых барьеров.
Анафилактический шок -- протекает остро с развитием коллапса, отеков, спазма гладкой мускулатуры; часто заканчивается смертью. Крапивница -- увеличивается проницаемость сосудов, кожа краснеет, появляются пузыри, зуд. Бронхиальная астма -- развиваются воспаление, бронхо-спазм, усиливается секреция слизи в бронхах.
II тип -- цитотоксический. Антиген, расположенный на клетке «узнается» антителами классов IgG, IgM. При взаимодействии типа «клетка-антиген-антитело» происходит активация комплемента и разрушение клетки по трем направлениям: комплементзависимый цитолиз; фагоцитоз; антителозависимая клеточная цитотоксичность. Время реакции -- минуты или часы.
Ко II типу гиперчувствительности близки антирецепторные реакции (так называемый IV тип гиперчувствительности), основой которых являются антирецепторные антитела, например антитела против рецепторов к гормонам.
Клинические проявления II типа. По II типу гиперчувствительности развиваются некоторые аутоиммунные болезни, обусловленные появлением аутоантител к антигенам собственных тканей: злокачественная миастения, аутоиммунная гемолитическая анемия, вульгарная пузырчатка, синдром Гудпасчера, аутоиммунный гипертиреоидизм, инсулинозави-симый диабет II типа.
Аутоиммунную гемолитическую анемию вызывают антитела против Rh-антигена эритроцитов; эритроциты разрушаются в результате активации комплемента и фагоцитоза. Лекарственно-индуцируемые гемолитическая анемия, гранулоцитопения и тромбоцитопения сопровождаются появлением антител против лекарства -- гаптена и цитолизом клеток, содержащих этот антиген.
III тип -- иммунокомплексный. Антитела классов IgG, IgM образуют с растворимыми антигенами иммунные комплексы, которые активируют комплемент. При избытке антигенов или недостатке комплемента иммунные комплексы откладываются на стенке сосудов, базальных мембранах, т. е. структурах, имеющих Fc-рецепторы.
Первичными компонентами III типа гиперчувствительности являются растворимые иммунные комплексы антиген-антитело и комплемент (анафилатоксины С4а, СЗа, С5а). При избытке антигенов или недостатке комплемента иммунные комплексы откладываются на стенке сосудов, базальных мембранах, т.е. структурах, имеющих Fc-рецепторы. Повреждения обусловлены тромбоцитами, нейтрофилами, иммунными комплексами, комплементом. Привлекаются провоспалительные цитокины, включая TNF-a и хемокины. На поздних стадиях в процесс вовлекаются макрофаги.
Реакция может быть общей (например, сывороточная болезнь) или вовлекать отдельные органы, ткани, включая кожу (например, системная эритематозная волчанка, реакция Артюса), почки (например, волчаночный нефрит), легкие (например, аспергиллез) или другие органы. Эта реакция может быть обусловлена многими микроорганизмами. Она развивается через 3-10 часов после экспозиции антигена, как в реакции Артюса. Антиген может быть экзогенный (хронические бактериальные, вирусные, грибковые или прото-зойные инфекции) или эндогенный, как при системной эри-тематозной волчанке.
Клинические проявления III типа. Сывороточная болезнь происходит при введении высоких доз антигена, например лошадиной противостолбнячной сыворотки. Через 6-7 дней в крови появляются антитела против лошадиного белка, которые, взаимодействуя с данным антигеном, образуют иммунные комплексы, откладывающиеся в стенках кровеносных сосудов и тканях. Развиваются системные васкулиты, артриты (отложение комплексов в суставах), нефрит (отложение комплексов в почках).
Реакция Артюса развивается при повторном внутрикожном введении антигена, который локально образует иммунные комплексы с ранее накопившимися антителами. Проявляется отеком, геморрагическим воспалением и некрозом.
Анафилаксия представляет собой реакцию немедленного типа, возникающую при парентеральном повторном введении антигена в ответ на повреждающее действие комплекса антиген -- антитело и характеризующуюся стереотипно протекающей клинической и морфологической картиной.
Основную роль в анафилаксии играет цитотропный IgE, имеющий сродство к клеткам, в частности базофилам и тучным клеткам. После первого контакта организма с антигеном образуется IgE, который вследствие цитотропности адсорбируется на поверхности названных выше клеток. При повторном попадании в организм этого же антигена IgE связывает антиген с образованием на мембране клеток комплекса IgE -- антиген. Комплекс повреждает клетки, которые в ответ на это выделяют медиаторы -- гистамин и гистаминоподобные вещества (серотонин, кинин). Эти медиаторы связываются рецепторами, имеющимися на поверхности функциональных мышечных, секреторных, слизистых и других клеток, вызывая их соответствующие реакции. Это ведет к сокращению гладкой мускулатуры бронхов, кишечника, мочевого пузыря, повышению проницаемости сосудов и другим функциональным и морфологическим изменениям, которые сопровождаются клиническим проявлением. Клинически анафилаксия проявляется в виде одышки, удушья, слабости, беспокойства, судорог, непроизвольного мочеиспускания, дефекации и др. Анафилактическая реакция протекает в три фазы: в 1-й фазе происходит сама реакция антиген антитело; во 2-й фазе выделяются медиаторы анафилактической реакции; в 3-й фазе проявляются функциональные изменения.
Анафилактическая реакция возникает спустя несколько минут или часов после повторного введения антигена. Протекает в виде анафилактического шока или как местные проявления. Интенсивность реакции зависит от дозы антигена, количества образующихся антител, вида животного и может закончиться выздоровлением или смертью. Анафилаксию легко можно вызвать в эксперименте на животных. Оптимальной моделью для воспроизведения анафилаксии является морская свинка. Анафилаксия может возникать на введение любого антигена любым способом (подкожно, через дыхательные пути, пищеварительный тракт) при условии, что антиген вызывает образование иммуноглобулинов. Доза антигена, вызывающая сенсибилизацию, т. е. повышенную чувствительность, называется сенсибилизирующей. Она обычно очень мала, так как большие дозы могут вызвать не сенсибилизацию, а развитие иммунной защиты. Доза антигена, введенная уже сенсибилизированному к нему животному и вызывающая проявление анафилаксии, называется разрешающей. Разрешающая доза должна быть значительно больше, чем сенсибилизирующая.
Состояние сенсибилизации после встречи с антигеном сохраняется месяцами, иногда годами; интенсивность сенсибилизации можно искусственно уменьшить введением малых разрешающих доз антигена, которые связывают и выводят из циркуляции в организме часть антител. Этот принцип был использован для десенсибилизации (гипосенсибилизации), т.е. предупреждения анафилактического шока при повторных введениях антигена. Впервые способ десенсибилизации предложил русский ученый А. Безредка (1907), поэтому он называется способом Безредки. Способ состоит в том, что человеку, ранее получавшему какой-либо антигенный препарат (вакцину, сыворотку, антибиотики, препараты крови и др.), при повторном введении (при наличии у него повышенной чувствительности к препарату) вначале вводят небольшую дозу (0,01; 0,1 мл), а затем, через 1--1'/2 ч, -- основную. Таким приемом пользуются во всех клиниках для избежания развития анафилактического шока; этот прием является обязательным.
Возможен пассивный перенос анафилаксии с антителами.
Сывороточной болезнью называют реакцию, возникающую при разовом парентеральном введении больших доз сывороточных и других белковых препаратов. Обычно реакция возникает спустя 10--15 сут. Механизм сывороточной болезни связан с образованием антител против введенного чужеродного белка (антигена) и повреждающим действием на клетки комплексов антиген -- антитело. Клинически сывороточная болезнь проявляется отеком кожи и слизистых оболочек, повышением температуры тела, при-пуханием суставов, сыпью и зудом кожи; наблюдаются изменения в крови (увеличение СОЭ, лейкоцитоз и др.). Сроки проявления и тяжесть сывороточной болезни зависят от содержания циркулирующих антител и дозы препарата. Это объясняется тем, что ко 2-й неделе после введения белков сыворотки вырабатываются антитела к белкам сыворотки и образуется комплекс антиген -- антитело. Профилактика сывороточной болезни осуществляется по способу Безредки.
Вакцины. Определение. Типы вакцин. Их получение. Вакцинопрофилактика и вакцинотерапия.
Вакцина — медицинский препарат, предназначенный для создания иммунитета к инфекционным болезням.
Классификации вакцин:
1.Живые вакцины - препараты, действующим началом в которых являются ослабленные тем или иным способом, потерявшие свою вирулентность, но сохранившие специфическую антигенность штаммы патогенных бактерий. Примером таких вакцин являются БЦЖ и вакцина против натуральной оспы человека, в качестве которой используется непатогенный для человека вирус оспы коров.
2.Инактивированные (убитые) вакцины – препараты, в качестве действующего начала включающие убитые химическим или физическим способом культуры патогенных вирусов или бактерий, (клеточные, вирионные) или же извлечённые из патогенных микробов комплексы антигенов, содержащие в своём составе проективные антигены (субклеточные, субвирионные вакцины). В препараты иногда добавляют консерванты и адьюванты.
Молекулярные вакцины – в них антиген находится в молекулярной форме или даже в виде фрагментов его молекул, определяющих специфичность т. е. в виде эпитопов, детерминант.
Корпускулярные вакцины – содержащие в своем составе протективный антиген
3.Анатоксины относятся к числу наиболее эффективных препаратов. Принцип получения – токсин соответствующей бактерии в молекулярном виде превращают в нетоксичную, но сохранившую свою антигенную специфичность форму путем воздействия 0.4% формальдегида при 37t в течение 3-4 недель, далее анатоксин концентрируют, очищают, добавляют адьюванты.
4.Синтетические вакцины. Молекулы эпитопов сами по себе не обладают высокой иммуногенностью для повышения их антигенных свойств эти молекулы сшиваются с полимерным крупномолекулярным безвредным веществом, иногда добавляют адьюванты.
5.Ассоциированные вакцины – препараты, включающие несколько разнородных антигенов.
Требования, предъявляемые к современным вакцинам:
Иммуногенность;
Низкая реактогенность (аллергенность);
Не должны обладать тератогенностью, онкогенностью;
Штаммы, из которых приготовлена вакцина, должны быть генетически стабильны;
Длительный срок хранения;
Технологичность производства;
Простота и доступность в применении.
Преимущества живых вакцин:
По механизму действия они напоминают дикие штаммы и вытесняют последние из организма;
Формируют эффективный гуморальный и клеточный иммунитет, так как размножаются и циркулируют в организме;
Легко проводить вакцинацию, так как необходимы небольшие дозы и требуется только однократная вакцинация.
Недостатки:
Содержат до 99% балласта – реактогенны (много побочных действий);
Способны вызывать мутации клеток организма;
Содержат вирусы-загрязнители;
Трудно дозируются, требуют особых условий хранения;
Есть возможность возвращения в вирулентную форму.
!!!Живые вакцины не ставят людям с иммунодефицитами!!!
Между введениями живых вакцин рекомендован интервал не менее 1 месяца, в противном случае возможны тяжелые побочные реакции, иммунный ответ может быть пониженным.
УБТЬЫЕ Преимущества:
Стабильны и безопасны;
Легко дозируются.
Недостатки:
Реактогенны;
Содержат фенол;
Требуется вакцинация.
Ассоциированные вакцины.
Это комбинированные вакцины, в результате действия которых иммунтет формируется одновременно к нескольким инфекциям.
АКДС (ассоциированная коклюшно-дифтерийная столбнячная) – из убитых коклюшных бактерий и инактивированных экзотоксинов дифтерии и столбняка.
+Тривакцина – из аттенуированных (ослабленных) вирусов кори, краснухи и праротита.
Тетракокк – из анатоксинов дифтерии и столбняка и убитых коклюшных бактерий и инактивированных вирусов полиомиелита.
Анатоксины. Общая характеристика, получение и применение. Значение в профилактике инфекционных болезней.
Анатоксины готовятся из экзотоксинов различных видов микробов. Токсины подвергаются обезвреживанию формалином 0,4% раствором, при 40 С, в течение 4 недель. При этом они не теряют иммуногенные свойства и способность вызывать образование антител (антитоксинов). Очищенный осадок балластных веществ и концентрированный анатоксин сорбируют на гидроксиде алюминия. В случае недостаточной инактивации анатоксина могут возникать признаки интоксикации, характерные для данного заболевания.
Анатоксины обеспечивают формирование антитоксического иммунитета, который, естественно, уступает иммунитету, образующемуся после перенесенного заболевания, и не предотвращают появление бак-терионосительства. В связи с этим не прекращаются попытки создания более сложных вакцин, содержащих, кроме анатоксина, другие антигены бактерий
Анатоксины применяются для профилактики и реже, для лечения токсинемических инфекций дифтерия, газовая гангрена, ботулизм, столбняк). Так же анатоксины применяются для получения антитоксических сывороток путем гипериммунизации животных.
+Примеры препаратов: АКДС, АДС, адсорбированный стафилококковый анатоксин, ботулинистический анатоксин, анатоксины из экзотоксинов возбудителей газовых инфекций.
Иммунные сыворотки. Классификация. Получение. Применение. Понятие о серотерапии и серопрофилактике.
Иммунные сыворотки: иммунологические препараты на основе антител.
1. Антитоксические - сыворотки против дифтерии, столбняка, ботулизма, газовой гангрены, т.е. сыворотки, содержащие в качестве антител антитоксины, которые нейтрализуют специфические токсины.
2. Антибактериальные - сыворотки, содержащие агглютинины, преципитины, комплементсвязывающие антитела к возбудителям брюшного тифа, дизентерии, чумы, коклюша.
3. Противовирусные сыворотки (коревая, гриппозная, антирабическая) содержат вируснейтрализующие, комплементсвязывающие противовирусные антитела.
Иммунные сыворотки получают путем гипериммунизации животных (лошади) специфическим антигеном (анатоксином, бактериальными или вирусными культурами и их антигенами) с последующим, в период максимального антителообразования, выделением из крови иммунной сыворотки. Иммунные сыворотки, полученные от животных, называют гетерогенными, так как они содержат чужеродные для человека сывороточные белки.
Для получения гомологичных нечужеродных иммунных сывороток используют сыворотки переболевших людей (коревая, оспенная сыворотки) или специально иммунизированных людей-доноров (противостолбнячная, противоботулиническая), содержащие антитела к ряду возбудителей инфекционных болезней вследствие вакцинации или перенесенного заболевания.
Нативные иммунные сыворотки содержат ненужные белки (альбумин), из этих сывороток выделяют и подвергают очистке специфические белки- иммуноглобулины. Методы очистки: осаждение спиртом, ацетоном на холоде, обработка ферментами.
Иммунные сыворотки создают пассивный специфический иммунитет сразу после введения. Применяют с лечебной и профилактической целью. Для лечения токсинемических инфекций (столбняк, ботулизм, дифтерия, газовая гангрена), а также для лечения бактериальных и вирусных инфекций (корь, краснуха, чума, сибирская язва). С лечебной целью сывороточные препараты в/м. Профилактически: в/м лицам, имевшим контакт с больным, для создания пассивного иммунитета.
Иммуноглобулины (гамма-глобулины) гомологичные и гетерологичные. Получение и применение.
Нативные иммунные сыворотки содержат ненужные белки (альбумин), из этих сывороток выделяют и подвергают очистке специфические белки- иммуноглобулины.
Иммуноглобулины, иммунные сыворотки подразделяют на:
1. Антитоксические - сыворотки против дифтерии, столбняка, ботулизма, газовой гангрены, т.е. сыворотки, содержащие в качестве антител антитоксины, которые нейтрализуют специфические токсины.
2. Антибактериальные - сыворотки, содержащие агглютинины, преципитины, комплементсвязывающие антитела к возбудителям брюшного тифа, дизентерии, чумы, коклюша.
3. Противовирусные сыворотки (коревая, гриппозная, антирабическая) содержат вируснейтрализующие, комплементсвязывающие противовирусные антитела.
Методы очистки: осаждение спиртом, ацетоном на холоде, обработка ферментами, аффинная хроматография, ультрафильтрация.
Активность иммуноглобулинов выражают в антитоксических единицах, в титрах вируснейтрализующей, гемагглютинирующей, агглютинирующей активности, т.е. тем наименьшим количеством антител, которое вызывает видимую реакцию с определенным количеством специфического антигена.
Иммуноглобулины создают пассивный специфический иммунитет сразу после введения. Применяют с лечебной и профилактической целью. Для лечения токсинемических инфекций (столбняк, ботулизм, дифтерия, газовая гангрена), а также для лечения бактериальных и вирусных инфекций (корь, краснуха, чума, сибирская язва). С лечебной целью сывороточные препараты в/м. Профилактически: в/м лицам, имевшим контакт с больным, для создания пассивного иммунитета.
При необходимости экстренного создания иммунитета, для лечения развивающейся инфекции применяют иммуноглобулины, содержащие готовые антитела.