
- •Часть 1. История и общая микробиология.
- •Эндогенные:
- •31) Индикация и идентификация вирусов при различных методах культивирования.
- •§ 96 % Спирт (30 мин.).
- •Часть 2. Инфекция и иммунитет.
- •2. Клеточные факторы врожденного иммунитета. Фагоцитоз.
- •3. Иммунная система организма. Основные клетки иммунной системы и их характеристика.
- •4. Гуморальные факторы врождённого иммунитета.
- •Часть 3. Частная микробиология.
- •Микробиологическая диагностика менингококковой инфекции
- •Бактериологический метод
- •1 Этап – вчк.
- •Морфологические и тинкториальные свойств
- •Культуральные свойства
- •Биохимические свойства
- •Антигенная структура
- •Фагочувствительность
- •Резистентность холерного вибриона
- •Эпидемиология
- •Факторы патогенности холерного вибриона
- •Патогенез холеры
- •Клиническая картина холеры
- •Диагностика
- •Иммунитет
- •Лечение холеры
- •Профилактика холеры
- •Пищевые отравления.
- •Пищевые отравления микробной этиологии
- •Лабораторная диагностика пищевых токсикоинфекций (пти).
- •Профилактика отравлений микробной природы Профилактика токсикоинфекций включает:
- •Профилактика стафилококковых токсикозов:
- •Общая вирусология
- •1. Таксономия, классификация
- •2. Морфология, размеры, особенности генома
- •3. Этапы репродукции
- •4. Эпидемиология
- •5. Патогенез и клинические проявления;
- •6. Лабораторная диагностика, характер исследуемого материала;
- •7. Особенности вирусологического метода диагностики (культивирование, индикация, идентификация вируса);
- •8. Противовирусный иммунитет;
- •9. Специфическая профилактика;
- •10. Лечение
- •5. Терминальная стадия.
- •1. Прямые методы диагностики.
- •2. Косвенные методы диагностики.
- •1. Этиотропное лечение
- •1. Вирусологический (культуральный) метод
- •2. Молекулярно-генетические методы
- •4. Методы детекции антител
- •1. Этиотропное лечение
- •2. Патогенетическая терапия
- •3. Симптоматическая терапия часть 4. Санитарная микробиология.
- •Методы косвенной индикации возможного присутствия возбудителя во внешней среде.
- •Часть 5. Микробиология инфекций, связанных с оказанием медицинской помощи (исмп).
- •Лабораторная диагностика гнойно-воспалительных заболеваний (гвз)
- •Микробиологическое исследование крови
- •Этиологическая структура бактериемий
- •Микробиологическое исследование мочи
- •Полуколичественный метод определения степени бактериурии
- •Внутрибольничная пневмония
- •Послеоперационные инфекции
- •Раневые инфекции
31) Индикация и идентификация вирусов при различных методах культивирования.
Индикация вирусов
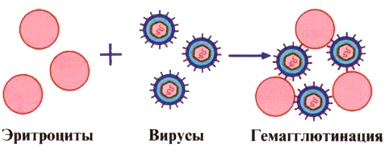
Индикацию вирусов, имеющих в суперкапсидной оболочке фермент «гемагг-лютинин», можно проводить с помощью реакции гемагглютинации (РГА). Под действием вирусного гемагглютинина in vitro происходит склеивание эритроцитов. В результате формируется осадок эритроцитов с неровными, фестончатыми краями, в виде «перевернутого зонтика». При отрицательной реакции, в случае отсутствия вируса в исследуемом материале, осадок эритроцитов имеет вид «пуговицы» с ровными краями. РГА - неспецифическая, несерологическая реакция. Несерологическая, т.к. в ней не участвует иммунная диагностическая сыворотка. Неспецифическая, т.к. разные вирусы могут агглютинировать эритроциты животных разных видов. В частности, вирус гриппа хорошо агглютинирует куриные и человеческие эритроциты, вирус клещевого энцефалита - гусиные эритроциты.
Индикацию вирусов можно проводить по их цитопатогеныому действию (ЦПД) на культуру клеток. Это действие выражается в повреждении монослоя зараженной культуры клеток и изменении их морфологии (дегенерация). При этом клетки округляются, темнеют, теряют отростки, в них появляется зернистость. Возможно образование многоядерных клеток (симпласт), в частности, под действием респираторно-синцитиального вируса. В дальнейшем происходит отслойка клеток от стекла - нарушение монослоя.
Методы титрования (количественное определение) вирусов.
Титрование вирусов осуществляют на различных биологических моделях.
Если вирусом заражают лабораторных животных, то единицей измерения силы (дозы) вируса будет LD50.
— LD50— то количество вирусов, которое вызывает гибель 50% взятых в опыт животных определенного веса, определенного вида (иногда пола) в определенный срок.
Если исследуемым вирусом заражают куриные эмбрионы, то титр (доза) вируса определяется в ED50 (эмбриональная доза).
— ЕДзо - то количество вирусов, которое вызывает гибель 50% взятых в опыт куриных эмбрионов.
Если исследуемым вирусом заражают культуру клеток, то титр вируса измеряется в ТЦД50 (тканевая цитопатогенная доза) и БОЕ (бляшкообразующая единица).
— ТЦДм — то количество вирусов, которое вызывает гибель 50% взятых в опыт культур клеток.
Более точным является второй метод, определяющий абсолютное количество вирусов в исследуемом материале по количеству бляшек (БОЕ), т.е. участков по гибших клеток культуры ткани под действием инфицирующего агента. Сколько образуется бляшек, столько и вирусных частиц в исследуемом материале.
Идентификация вирусов.
Идентификацию вирусов по антигенным свойствам осуществляют постановкой серологических реакций со специфическими диагностическими противовирусными сыворотками. Основными серологическими реакциями, используемыми для идентификации вирусов, являются: реакция торможения гемахтлютинации, реакция нейтрализации в культуре клеток и иммуноферментный метод (ИФА).
Реакция торможения гемагглютинации ГРТГА) — 2-х компонентная, сложная серологическая реакция. Компоненты реакции:
а) исследуемая вируссодержащая жидкость (Аг);
б) типовые противовирусные диагностические сыворотки (Ат);
в) 1% взвесь эритроцитов (как индикатор).
Постановка FIT А состоит из следующих этапов: вначале соединяют вируссо-держашую жидкость с разведениями диагностических сывороток в лунках полистироловой пластины и оставляют для контакта на 30-40 минут при комнатной температуре. Затем во все лунки вносят взвесь эритроцитов. Учет реакции производят через 1 -2 часа.
Если тип вируса соответствует типу сыворотки, то вирусный гемагглютинин будет блокироваться антителами сыворотки, что проявляется отсутствием агглютинации эритроцитов. Такая реакция учитывается как положительная. Визуально в лунках определяется осадок эритроцитов с ровными краями, в виде «пуговицы».
С другими диагностическими противовирусными сыворотками, взятыми для постановки РТГА, реакция будет отрицательной из-за несоответствия типа вируса типу сыворотки. Визуально определяется осадок эритроцитов с неровными фестончатыми краями, в виде «перевернутого зонтика» (гемагглютинация).
РТГА применяется для идентификации вирусов гриппа, клещевого энцефалита.
Реакция нейтрализации (РН) в культуре клеток - 2-х компонентная, сложная серологическая реакция. Компоненты реакции:
а) исследуемая вируссодержащая жидкость (Аг);
б) типовые противовирусные диагностические сыворотки (Ат);
в) культура клеток (в качестве индикатора).
Постановка РН состоит из следующих этапов: вначале выделенный цитопато-генный вирус смешивают в пробирках со специфическими диагностическими сыворотками. Смеси выдерживают 1 час при комнатной температуре. Затем этими смесями заражают флаконы с культурой клеток. Если тип вируса соответствует типу сыворотки, то произойдет нейтрализация вируса антителами сыворотки и культура клеток будет без изменений (положительная реакция).
32) Особенности лабораторной диагностики вирусных инфекций
Методы лабораторной диагностики вирусных инфекций подразделяются на несколько больших групп.
Прямые методы диагностики клинического материала
-это методы, которые позволяют обнаружить вирус, вирусный антиген или вирусную нуклеиновую кислоту (НК) непосредственно в клиническом материале, то есть являются наиболее быстрыми (2–24 ч). Однако из-за ряда особенностей возбудителей прямые методы имеют свои ограничения (возможность получения ложноположительных и ложноотрицательных результатов). Поэтому они часто требуют подтверждения непрямыми методами.
Электронная микроскопия (ЭМ)
Иммунная электронная микроскопия (ИЭМ)
Реакция иммунофлюоресценции (РИФ)
Иммуноферментный анализ (ИФА)
Твердофазный ИФА,
Радиоиммунный анализ (РИА)
Молекулярные методы.
Молекулярная гибридизация нуклеиновых кислот.
ПЦР
Цитологические методы
- Прямые методы, состоящие в выявлении непосредственно в биологическом материале самого вируса или антител к нему.
Непрямые методы диагностики
Выделение вирусов – один из самых старых и трудоемких методов диагностики. Однако и сегодня выделение вируса с последующей идентификацией с помощью одного из современных методов (ИФА с моноклональными антителами или ПЦР) является наиболее достоверным методом диагностики – так называемый "золотой стандарт".
Как правило, берутся:
– при респираторных инфекциях – носоглоточный смыв; – при энтеровирусных инфекциях – смыв и фекалии (рео-, энтеровирусы); – при поражениях кожи и слизистых оболочек – соскобы, содержимое пузырьков (герпес, ветряная оспа); – при экзантемных инфекциях – смывы (корь, краснуха); – при арбовирусных инфекциях – кровь, спинномозговая жидкость.
Серодиагностика
Серологическая диагностика, основанная на реакции антиген – антитело, может быть использована для определения как тех, так и других, и играет роль в определении этиологии вирусной инфекции даже при отрицательных результатах выделения вируса.
Реакцию связывания комплемента (РСК).
Реакция торможения гемагглютинации (РТГА), РСК, РИФ)
Реакции пассивной и обратной пассивной гемагглютинации (РПГА, РОПГА),
РТГА
РПГА
РНГА
ИФ
Моноклональные антитела
- Непрямые методы-заключаются в искусственной наработке вируса в значительных количествах, и его дальнейшем анализе.
К наиболее актуальным в повседневной практике методам диагностики относятся:
Серологические методы диагностики - выявление в сыворотке крови пациента определенных антител или антигенов в результате реакции антиген-антитело(АГ-АТ). То есть, при поиске у пациента определенного антигена используется соответствующее искусственно синтезированное антитело, и, соответственно, наоборот-при выявлении антител используют синтезированные антигены.
Реакция иммунофлуоресценции (РИФ)
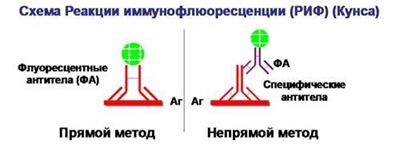
Основана на использовании меченых красителями антител. При наличии вирусного антигена он связывается с мечеными антителами, и под микроскопом наблюдается специфическая окраска, которая говорит о положительном результате. При этом методе, к сожалению, невозможна количественная интерпретация результата, а только лишь качественная.
Возможность количественного определения дает иммуноферментный анализ(ИФА). Он похож на РИФ, однако в качестве маркеров используют не красители, а ферменты, превращающие бесцветные субстраты в окрашенные продукты, что и дает возможность количественной оценки содержания как антигенов, так и антител.
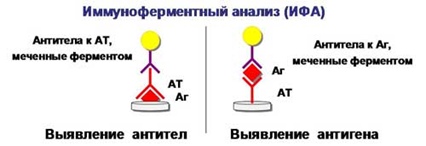
- Отмывают не связавшиеся антитела и антигены.
- Добавляют бесцветный субстрат, и в лунках с антигеном, который мы определяем, произойдет окрашивание, т.к. там будет связанный с антигеном фермент, после чего на специальном приборе оценивают интенсивность свечения окрашенного продукта.
По похожей схеме происходит и выявление антител.
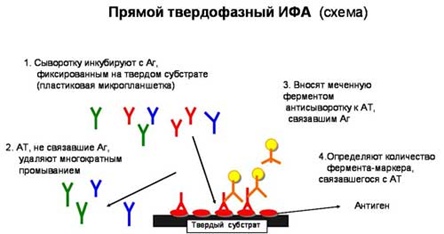
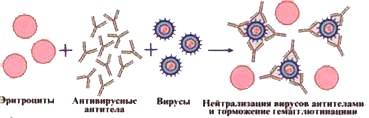
Реакция непрямой(пассивной) гемаглютинации (РПГА).
Метод основан на способности вирусов связывать эритроциты. В норме эритроциты падают на дно планшета, образуя так называемую пуговку. Однако если в исследуемом биологическом материале находится вирус, он свяжет эритроциты в так называемый зонтик, который не упадет на дно лунки.
Если стоит задача выявления антител, то сделать это возможно при помощи реакции торможения гемагглютинации (РТГА). В лунку с вирусом и эритроцитами закапывают различные пробы. При наличии антител они свяжут вирус, и эритроциты упадут на дно с образованием «пуговки».
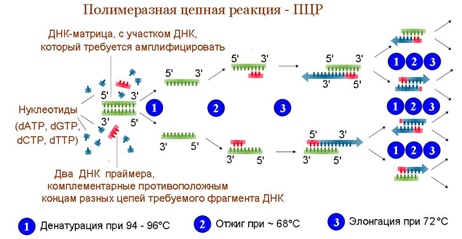
Теперь остановимся на методах диагностики непосредственно нуклеиновых кислот исследуемых вирусов, и прежде всего о ПЦР ( Полимеразная Цепная Реакция) .
Суть этого метода заключается в обнаружении специфического фрагмента ДНК или РНК вируса путём его многократного копирования в искусственных условиях. ПЦР можно проводить только с ДНК, то есть для РНК-вирусов предварительно необходимо произвести реакцию обратной транскрипции.
Непосредственно ПЦР проводят в специальном приборе, под названием амплификатор, или термоциклер, который поддерживает необходимый температурный режим. ПЦР-смесь состоит из добавленной ДНК, которая содержит интересующий нас фрагмент, праймеров (короткий фрагмент нуклеиновой кислоты, комплиментарный ДНК-мишени, служит затравкой для синтеза комплиментарной цепи), ДНК-полимеразы и нуклеотидов.
Стадии цикла ПЦР:
- Деннатурация-первая стадия. Температура повышается до 95 градусов, цепочки ДНК расходятся друг относительно друга.
- Отжиг праймеров. Температуру понижают до 50-60 градусов. Праймеры находят комплиментарный участок цепи и связываются с ним.
- Синтез. Температуру вновь повышают до 72, это рабочая температура для ДНК-полимеразы, которая, отталкиваясь от праймеров, строит дочерние цепи.
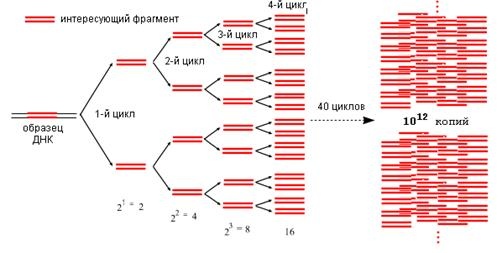
Цикл многократно повторяется. Через 40 циклов из одной молекулы ДНК получается 10*12 степени копий копий искомого фрагмента.
При проведении ПЦР в режиме реального времени синтезируемые копии фрагмента ДНК метятся красителем. Прибор регистрирует интенсивность свечения и по ходу реакции строит графики накопления искомого фрагмента.
Современные методы лабораторной диагностики с высокой достоверностью позволяют выявить присутствие вируса - возбудителя в организме, нередко, задолго до появления первых симптомов заболевания.
Антибиотики. Определение. История открытия. Классификация. Механизм действия на микробов.
Антибиотики — химиотерапевтические вещества, продуцируемые микроорганизмами, животными клетками, растениями, а также их производные и синтетические продукты, которые обладают избирательной способностью угнетать и задерживать рост микроорганизмов, а также подавлять развитие злокачественных новообразований.
1896 г. – Б. Гозио из жидкости, содержащей культуру грибка из рода Penicillium (Penicillium brevicompactum), выделил кристаллическое соединение – микофеноловую кислоту, подавляющую рост бактерий сибирской язвы. 1899 г. – Р. Эммерих и О. Лоу сообщили об антибиотическом соединении, образуемом бактериями Pseudomonas pyocyanea, и назвали его пиоцианазой; препарат использовался как местный антисептик. 1929 г. – А. Флеминг открыл пенициллин, однако ему не удалось выделить достаточно стабильный "экстракт". 1937 г. – М. Вельш описал первый антибиотик стрептомицетного происхождения – актиномицетин. 1939 г. – Н.А. Красильников и А.И. Кореняко получили мицетин; Р. Дюбо – тиротрицин. 1940 г. – Э. Чейн выделил пенициллин в кристаллическом виде. 1942 г. – З. Ваксман впервые ввел термин "антибиотик".
В основу главной классификации антибиотиков положено их химическое строение.
Наиболее важными классами синтетических антибиотиков являются хинолоны и фторхинолоны (например, ципрофлоксацин), сульфаниламиды (сульфадиметоксин), имидазолы (метронидазол), нитрофураны (фурадонин, фурагин).
По спектру действия антибиотики делят на пять групп в зависимости от того, на какие микроорганизмы они оказывают воздействие. Кроме того, существуют противоопухолевые антибиотики, продуцентами которых также являются актиномицеты. Каждая из этих групп включает две подгруппы: антибиотики широкого и узкого спектра действия.
Антибактериальные антибиотики составляют самую многочисленную группу препаратов. Преобладают в ней антибиотики широкого спектра действия, оказывающие влияние на представителей всех трех отделов бактерий. К антибиотикам широкого спектра действия относятся аминогликозиды, тетрациклины и др. Антибиотики узкого спектра действия эффективны в отношении небольшого круга бактерий, например полет-миксины действуют на грациликутные, ванкомицин влияет на грамположительные бактерии.
В отдельные группы выделяют противотуберкулезные, противолепрозные, противосифилитические препараты.
Противогрибковые антибиотики включают значительно меньшее число препаратов. Широким спектром действия обладает, например, амфотерицин В, эффективный при кандидозах, бластомикозах, аспергиллезах; в то же время нистатин, действующий на грибы рода Candida, является антибиотиком узкого спектра действия.
Антипротозойные и антивирусные антибиотики насчитывают небольшое число препаратов.
Противоопухолевые антибиотики представлены препаратами, обладающими цитотоксическим действием. Большинство из них применяют при многих видах опухолей, например митоми-цин С.
Действие антибиотиков на микроорганизмы связано с их способностью подавлять те или иные биохимические реакции, происходящие в микробной клетке.
В зависимости от механизма действия различают пять групп антибиотиков:
антибиотики, нарушающие синтез клеточной стенки. К этой группе относятся, например, β-лактамы. Препараты этой группы характеризуются самой высокой избирательностью действия: они убивают бактерии и не оказывают влияния на клетки микроорганизма, так как последние не имеют главного компонента клеточной стенки бактерий — пептидогликана. В связи с этим β -лактамные антибиотики являются наименее токсичными для макроорганизма;
2. антибиотики, нарушающие молекулярную организацию и синтез клеточных мембран. Примерами подобных препаратов являются полимиксины, полиены;
3. антибиотики, нарушающие синтез белка; это наиболее многочисленная группа препаратов. Представителями этой группы являются аминогликозиды, тетрациклины, макроли-ды, левомицетин, вызывающие нарушение синтеза белка на разных уровнях;
4. антибиотики — ингибиторы синтеза нуклеиновых кислот. Например, хинолоны нарушают синтез ДНК, рифампицин — синтез РНК;
5. антибиотики, подавляющие синтез пуринов и аминокислот. К этой группе относятся, например, сульфаниламиды.
Механизмы действия антибиотиков на микроорганизмы
По механизму действия на микроорганизмы антибактериальные химиопрепараты делятся на: ингибирующие синтез клеточной стенки; вызывающие повреждение цитоплазматической мембраны; подавляющие белковый синтез; ингибирующие синтез нуклеиновых кислот.
Антибиотики, ингибирующие синтез клеточной стенки. Пептидогликан — основа клеточной стенки бактерий — уникален и жизненно необходим для прокариот, он есть у большинства бактерий, за исключением не имеющих клеточной стенки. Синтез предшественников пептидогликана начинается в цитоплазме. Затем они транспортируются через ЦПМ, где происходит их объединение в гликопептидные цепи (эту стадию ингибируют гликопептиды). Образование полноценного пептидогликана происходит на внешней поверхности ЦПМ. Этот этап совершается при участии белков-ферментов, которые называют пенициллинсвязывающими белками, так как именно они служат мишенью для пенициллина и других бета-лактамных антибиотиков. Ингибирование пенициллинсвязывающих белков приводит к накоплению предшественников пептидогликана в бактериальной клетке. В результате ненормально большое количество этих предшественниковзапускает в бактериальной клетке систему их уничтожения — аутентические ферменты,которые в норме расщепляют пептидогликан при делении бактериальных клеток. В результате действия аутолитических ферментов и происходит лизис бактериальной клетки. Поскольку пептидогликана нет в стенках животных клеток, то эти антибиотики обладают очень низкой токсичностью для макроорганизма, и их можно применять в высоких дозах (мегатерапия).
бета-лактамные антибиотики — пенициллины, цефалоспорины, монобактамы и карбопенемы
гликопептиды — ванкомицин, клиндамицин
Антибиотики, вызывающие повреждение цитоплазматической мембраны (блокирование фосфолипидных или белковых компонентов, нарушение проницаемости клеточных мембран, изменение мембранного потенциала и т. д.).
ЦПМ есть у всех живых клеток, но у прокариот (бактерий) и эукариот ее структура различна. У грибов больше общего с клетками макроорганизма, хотя есть и различия. Поэтому противогрибковые препараты — антимикотики — более токсичны для организма человека, так что лишь немногие препараты из этой группы допустимо принимать внутрь. Число антибиотиков, специфическидействующих на мембраны бактерий, невелико. Наиболее известны полимиксины (полипептиды), к которым чувствительны только грамотрицательные бактерии. Они лизируют клетки, повреждая фосфолипиды клеточных мембран. Из-за токсичности они применялись лишь для лечения местных процессов и не вводились парентерально. В настоящее время на практике не используются. Противогрибковые препараты (антимикотики) повреждают эргостеролы (полиеновые антибиотики) и ингибируют один из ключевых ферментов биосинтеза эргостеролов (имидазолы).
полиеновые антибиотики
полипептидные антибиотики
Антибиотики, подавляющие белковый синтез. По ряду признаков белоксинтезирующий аппарат прокариот отличается от рибосом эукариотических клеток, что может быть использовано для достижения селективной токсичности действующих на них препаратов. Синтез белка — многоступенчатый процесс, в котором задействовано множество ферментов и структурных субъединиц. Известно несколько точек приложения действия различных препаратов: присоединение тРНК с образованием инициального комплекса на 70S рибосоме (аминогликозиды), перемещение тРНК с акцепторного сайта на донорский сайт, присоединение нового аминоацила тРНК к акцепторному сайту (тетрациклины), формирование пептида, катализируемого пептидил-трансферазой (хлорамфеникол, линкозамиды), транслокация пептидил тРНК (эритромицин), удлинение пептидной цепи (фузидиевая кислота), терминация и высвобождение пептидной цепи. Таким образом, аминогликозиды и тетрациклины связываются с 30S-субъединицей, блокируя процесс еще до начала синтеза белка. Аминогликозиды необратимо ингибируют процесс присоединения транспортной РНК, а тетрациклиныобратимо блокируют следующую стадию присоединения к рибосомам транспортной РНК. Макролиды, хлорамфеникол, линкозамиды соединяются с 50S-субъединицей. Это обрывает удлинение пептидных цепей. После удаления этих антибиотиков процесс возобновляется, т. е. эффект бактериостатичен.
аминогликозиды(гентамицин, угнетая белковый синтез в бактериальной клетке, способен нарушать синтез белковой оболочки вирусов и поэтому может обладать противовирусным действием)
макролиды
тетрациклины
хлорамфеникол(левомицетин), нарушающий синтез белка микробной клетки
Антибиотики, ингибирующие синтез нуклеиновых кислот. Нарушение синтеза и функций нуклеиновых кислот достигается тремя способами:
1) ингибирование синтеза предшественников пурин-пиримидиновых оснований (сульфаниламиды, триметоприм)
2) подавление репликации и функций ДНК (хинолоны/фторхинолоны.нитроимидазолы, нитрофураны)
3) ингибирование РНК-полимеразы (рифамицины). В большинстве своем в эту группу входят синтетические препараты, из антибиотиков подобным механизмом действия обладаюттолько рифамицины, которые присоединяются к РНК-полимеразе и блокируют синтез м-РНК. Действие фторхинолонов связано, в основном, с инактивацией ДНК-гиразы - фермента, обеспечивающего суперспирализацию бактериальной хромосомы. Сульфаниламиды - структурные аналоги парааминобензойнойкислоты - могут конкурентно связываться и ингибировать фермент, который нужен для перевода парааминобензойной кислоты в фолиевую кислоту - предшественник пуриновых и пиримидиновых оснований. Эти основаниянеобходимы для синтеза нуклеиновых кислот.
Асептика и антисептика. Определения. Методы.
Асептика — комплекс мероприятий, направленных на предупреждение попадания микробов в рану.
Асептика — безгнилостный способ лечения ран. Асептику следует отличать от антисептики, которая имеет целью уничтожить возбудителей воспаления, уже имеющихся в ране, посредством определённых химических веществ, как карболовой кислоты, сулемы и др.
Одним из основателей асептики считается немецкий хирург Эрнст фон Бергманн. Он предложил физические методики обеззараживания — кипячение, обжигание, автоклавирование. Это произошло на X конгрессе хирургов в Берлине. Помимо их существует химический способ и механический.
При асептическом способе лечения ран пользуются исключительно обеспложенной путём кипячения водой; весь перевязочный материал и инструменты также обеспложиваются текучим паром или кипячением.
Асептика применима до и во время операций на здоровых тканях, но неприменима там, где можно предполагать присутствие возбудителей воспаления в ране.
Асептика обладает несомненными преимуществами перед антисептикой в смысле результатов лечения, а также потому, что при асептическом способе лечения ран не бывает отравлений, которые возможны при применении некоторых антисептических средств.
Асептика — метод предупреждения раневой инфекции. Профилактическое уничтожение микробов, предупреждение их попадания в рану. Соблюдение стерильности в ходе операции, стерилизация приборов, инструментов.
Основой асептики является стерилизация.
Способы стерилизации:
§ паром под давлением (бельё);
§ кипячение (металлические инструменты, кроме режущих);
§ суховоздушные шкафы (можно обжигать инструмент над пламенем);
§ холодная стерилизация (погружение резиновых перчаток в хлорамин);
