
- •ВВЕДЕНИЕ
- •1. ТЕРМОХИМИЯ И ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.1. Термохимия
- •1.2. Химическая термодинамика
- •1.3. Первый закон термодинамики
- •1.4. Энтропия
- •2. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •2.1. Основные понятия химической кинетики
- •2.2. Влияние различных факторов на скорость химической реакции
- •2.3. Механизм химической реакции. Каталитические реакции
- •2.4. Химическое равновесие
- •3. РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ
- •3.2. Особые свойства поверхностных молекул
- •3.3. Процесс адсорбции
- •4. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
- •4.1. Истинные растворы. Растворимость
- •5.2. Классификация окислительно-восстановительных реакций
- •6. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- •6.1. Электрохимические системы
- •6.2. Устройство гальванического элемента
- •6.3. Концентрационный гальванический элемент
- •7. КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ
- •7.1. Понятие о коррозии и её виды
- •7.3. Электрохимическая коррозия
- •7.4. Влияние различных факторов на скорость коррозии
- •7.5. Защита металлов от коррозии
- •8.1. Понятие об электролизе. Законы Фарадея
- •8.2. Электролиз расплавов электролитов
- •8.4. Растворимые и нерастворимые аноды
- •9.ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- •9.1. Положение металлов в периодической таблице
- •9.2. Физические свойства металлов
- •9.3. Химические свойства металлов
- •11.ОРГАНИЗМ И СРЕДА. ЭКОЛОГИЧЕСКИЕ ФАКТОРЫ
- •11.1. Понятие о среде обитания и экологических факторах
- •11.3. Биотические факторы
- •11.4. Лимитирующий фактор
- •11.5. Виды адаптации
- •12.1. «Парниковый» эффект
- •12.2. «Озоновые дыры»
- •12.3. Кислотные осадки
- •12.4. Энергетический кризис
- •12.5. «Демографический взрыв» и продовольственная проблема
- •12.6. Сокращение биоразнообразия
- •13.1. Нормирование качества окружающей природной среды
- •13.2.Нормативы качества окружающей среды
- •13.3. Нормативы допустимого воздействия на окружающую среду
- •13.4. Экологический мониторинг
- •14.3. Экозащитная техника и технологии
- •Библиографический список
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Приложение 4
4. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
4.1. Истинные растворы. Растворимость
Истинным раствором называется многокомпонентная система, состав которой в определенных пределах можно изменять без нарушения гомогенности (однородности). Раствор состоит из, как минимум, двух компонентов: растворителя и растворенного вещества. Растворителем принято считать тот из компонентов, который преобладает количественно и агрегатное состояние которого не изменяется в растворе. Для водных растворов растворителем всегда считается вода. Растворенное вещество – тот из компонентов, количество кото-
рого меньше, чем растворителя, и агрегатное состояние которого при переходе в раствор может изменяться. НапримерИ, в растворе соды
(Na2CO3) растворителем является вода, а растворенным веществом – сода (при растворении сода из твердогоДкристаллического состояния перешла в жидкое состояние раствора).
растворимы в полярных растворителях (например, в воде), а другие – в
Строгой теории, объясняющейА, почему одни вещества хорошо
неполярных (например, в гексане), до сих пор не создано. Но существует эмпирическое (опытноеБ) правило: «подобное растворяется в по-
добном», то есть вещества с ионной или сильно полярной ковалентной связью (такие как NaCl,ИK2CO3, HCl, Ba(OH)2) хорошо растворяются в полярных растворителях (например, вода). Вещества, в молекулах которых атомы Ссвязаны неполярной или слабо полярной ковалентной связью, хорошо растворяются в неполярных растворителях.
На величину растворимости влияют природа растворенного вещества и растворителя, температура, а на растворимость газов – давление над раствором.
Количественной характеристикой растворимости служит коэффициент растворимости kS. Он показывает, сколько граммов вещества может раствориться в 100 г растворителя при данной температуре с образованием насыщенного раствора. Если kS > 10 г, вещество считается хорошо растворимым, если 0,01 < kS < 1 г, вещество считается малорастворимым, если kS < 0,01 г, вещество считается практически нерастворимым.
Ненасыщенным раствором называется гомогенная (однородная) система, в которой содержание растворенного вещества в расчете на 100 г растворителя меньше kS.
41
Насыщенным раствором называется гетерогенная (неоднородная) система, в которой растворенное вещество (осадок) находится в равновесии с раствором этого вещества. В насыщенном растворе количество вещества, переходящее в раствор, равно количеству вещества, выделяющегося из раствора в виде твердой фазы.
Пересыщенным раствором называется метастабильная (неустойчивая) гомогенная система, в которой содержание растворенного вещества больше, чем в насыщенном растворе. Такие растворы удается получить медленным охлаждением жидкой части насыщенного раствора, отделенного от твердой фазы. Обычно для твердых веществ с понижением температуры растворимость уменьшается, но выделение самостоятельной твердой фазы из таких растворов происходит не
сразу. Если такой раствор встряхнуть, перемешать, добавить в него кристаллик растворенного вещества, то из раствора в виде осадка выделится все избыточное количество (по сравнению с насыщенным при данной температуре раствором) растворенного вещества.
шением температуры обычно растворимостьИэтого вещества уменьшается. Растворы газов в жидкостях подчиняются закону Генри: при
Если в жидкости растворено газообразное вещество, то с повы-
данной температуре концентрация растворенного газа пропорцио- |
|
нальна его парциальному давлению: |
Д |
|
|
Ci Ki pi , |
|
А |
|
где Сi – концентрация растворенного газа; |
|
Кi – константа Генри, которая зависит от природы газа и растворителя |
||
|
Б |
|
(приводится в справочниках); |
|
|
рi – парциальное давление газа. |
|
|
Растворение сопровождаетсяИ |
тепловыми и объемными эффек- |
|
С |
|
|
тами. Тепловым эффектом растворения называется поглощение или выделение тепловой энергии в процессе растворения. Для того чтобы понять причину этого эффекта, рассмотрим механизм растворения. Процесс растворения включает две стадии. Первая стадия – разрыв связей между молекулами, атомами или ионами растворяемого вещества. Для этого необходимо затратить энергию Е1. Вторая стадия – взаимодействие молекул, атомов или ионов растворяемого вещества с молекулами растворителя. Эта стадия называется сольватацией (если растворитель вода, то процесс взаимодействия частиц растворяемого вещества с молекулами воды называют гидратацией). Образование межмолекулярных связей в процессе сольватации сопровождается выделением энергии Е2. Если затраты энергии на разрыв связей больше
42
энергии, выделяющейся при сольватации (Е1 > Е2), то процесс растворения будет сопровождаться поглощением энергии (эндотермический процесс). С поглощением тепла растворяются многие нитраты, тиосульфат натрия и т.п. Если энергия сольватации больше энергии, необходимой для разрыва связей, растворение будет сопровождаться выделением тепла (экзотермический процесс). Так растворяются гидроксиды натрия, калия, серная кислота. Именно по причине выделения большого количества тепла в процессе растворения серной кислоты в воде следует при приготовлении растворов серной кислоты добавлять небольшими порциями кислоту в воду, а не наоборот.
Объемным эффектом растворения называется изменение объ-
ема раствора по сравнению с суммарным объемом растворителя и
Причина объемных эффектов растворения заключается в различии
растворяемого вещества. Так, например, при смешивании 50 мл этилового спирта и 50 мл воды объем раствораИсоставит не 100 мл, а
молекулами разных веществ. Если сила взаимодействия между моле-
только 95 мл. В других случаях объем приготовленного раствора может оказаться больше, чем суммарныйДобъем исходных компонентов.
сил взаимодействия между молекуламиАодного и того же вещества и
кулами растворяемого вещества и молекулами растворителя оказывается больше, чем сила взаимодействияБ молекул растворителя друг с
другом, то в растворе молекулы будут сильнее притягиваться, что приведет к уменьшениюИобъема раствора. И наоборот, если молекулы растворяемого вещества взаимодействуют с молекулами растворителя слабее, чем молекулыСрастворителя друг с другом, то в растворе молекул будут слабее притягиваться, общий объем раствора увеличится.
4.2. пособы выражения концентрации растворов
Для характеристики раствора важно знать соотношение в нем растворенного вещества и растворителя. В зависимости от этого растворы делятся на разбавленные, в которых растворенного вещества намного меньше, чем растворителя, и концентрированные, в которых содержание растворенного вещества в расчете на 100 г растворителя приближается к значению коэффициента растворимости. Для более точной количественной характеристики растворов используют величину концентрации. В зависимости от того, к массе или объему раствора или растворителя относится количество растворенного вещест-
ва, концентрации бывают массовые (весовые) и объемные.
43

К массовым относят процентную (массовую долю) и моляльную концентрации. Процентной концентрацией называется содержание растворенного вещества на 100 г раствора (не путать с коэффициентом растворимости!). Процентную концентрацию можно вычислить по следующим формулам:
m1 100 , m2
где ω – процентная концентрация (массовая доля), %; т1 – масса растворенного вещества, г; т2 – масса раствора, г;
|
|
m1 |
|
100, |
|
|
m m |
|
|||||
|
|
1 |
3 |
|
|
|
где т3 – масса растворителя, г; |
|
|
|
|
||
|
m1 |
100, |
|
|||
|
|
|||||
|
|
V |
Д |
|||
|
|
2 |
|
|
И |
|
где V2 – объем раствора, см3; |
А |
|||||
ρ – плотность раствора, г/см3. |
||||||
|
|
|
||||
Моляльной концентрацией называется число молей растворен- |
||||||
Б1 |
|
|
|
|||
ного вещества в 1 кг (1000 г) раствора. Моляльная концентрация используется реже, чем процентная, но её знание необходимо, например, при определении температуры замерзания растворов различных веществ. Моляльная концентрация определяется по формуле
С |
C |
m 1000 |
|
|
, |
||
|
|
||
где Сμ – моляльная концентрацияИ |
M1 m3 |
||
, моль/кг растворителя; |
|||
М1 – молярная масса растворенного вещества, моль/дм3.
К объемным концентрациям относятся молярная концентрация
и молярная концентрация эквивалента (эквивалентная или нормаль-
ная). Молярная концентрация показывает, сколько молей вещества растворено в 1 дм3 раствора, и вычисляется по формуле
CM Mm1V ,
1
где СМ – молярная концентрация, моль/дм3;
V – объем раствора, дм3. (Обратите внимание, что при вычислении процентной концентрации и молярной концентрации единицы измерения объемов различны!)
44

Молярная концентрация эквивалента показывает, сколько мо-
лей эквивалента вещества растворено в 1 дм3 раствора, и вычисляется по формуле
C |
H |
|
m1 |
, |
|
|
|||||
|
|
Э1 |
V |
|
|
|
|
|
|
||
где СН – молярная концентрация эквивалента, моль эквивалента/дм3; Э1 – эквивалентная масса растворенного вещества.
Эквивалентная масса растворенного вещества вычисляется по следующим формулам:
• для оксидов: Э |
M |
, |
|
|
|
|||
|
|
|
|
|
||||
|
|
n B |
|
|
|
|||
где М – молярная масса оксида, г/моль; |
|
|
|
|
|
|
|
|
п – количество атомов металла в молекуле оксида; |
|
|
|
|||||
В – валентность металла в молекуле оксида. |
И |
|
|
|
||||
|
|
|
|
|
|
|||
Например, для оксида Al2O3 эквивалентная масса равна Э |
M |
; |
||||||
|
||||||||
|
Д |
2 |
3 |
|
||||
|
|
|
|
|
|
|
||
|
Э |
M |
|
|
|
|
||
• для кислот: |
|
, |
|
|
|
|||
|
|
nH |
|
|
|
|||
где пН – количество атомов водорода в молекуле кислоты, которые |
|||||
Б |
|
|
|
|
|
могут быть замещены на атомы металла в реакциях обмена. |
|
|
|
||
И |
1 |
|
|
M |
|
Например, для Н3РО4 эквивалентнаяА |
масса будет равна |
Э |
3 |
, |
|
|
|
|
|
|
|
так как все три атома водорода в молекуле фосфорной кислоты могут
С |
|
|
|
|
быть замещены на атомы металла. Для уксусной кислоты СН3СООН |
||||
эквивалентная масса будет равна |
Э |
M |
, |
так как только один атом |
|
|
|
||
водорода, связанный с атомом кислорода сильнополярной ковалентной связью, может замещаться на атом металла. Три остальных атома водорода связаны слабополярной ковалентной связью с атомом углерода, и не могут быть замещены на атомы металла;
• для оснований: Э M ,
nOH
где пОН – число гидроксильных групп, входящих в молекулу основания.
Например, для Са(ОН)2 |
Э |
M |
; |
|
|
|
2 |
|
|
||||
|
|
|
|
|
||
• для солей: Э |
M |
, |
||||
n B |
||||||
|
|
|
|
|
||
45

п – количество атомов металла в молекуле соли; В – валентность металла в молекуле соли.
Например, эквивалентная масса Cr2(SO4)3 равна Э 2M3 .
Молярная концентрация эквивалента широко применяется в объемном количественном анализе, когда по количеству раствора с известной концентрацией, вступившего в реакцию с анализируемым раствором, определяют количество растворенного вещества. В этом случае используют закон эквивалентов: все вещества реагируют друг с другом в эквивалентных количествах.
n n ; |
C V C V ; |
m1 |
C V 10 3 |
, |
|||||
|
|||||||||
1 |
2 |
1 |
1 |
2 |
2 |
2 |
2 |
|
|
|
|
|
|
|
|
Э1 |
|
|
|
где п1 |
и п2 |
– число молей эквивалентов определяемого вещества и |
|
|
И |
реагента с известной концентрацией, моль эквивалента; |
||
С1 |
и С2 – молярные концентрации эквивалента определяемого веще- |
|
|
|
Д |
ства и реагента с известной концентрацией, моль эквивалента/дм3; |
||
V1 |
и V2 – объемы определяемого вещества и реагента с известной кон- |
|
центрацией, см3; |
А |
|
|
||
Э1 – эквивалентная масса определяемого вещества, г/моль эквивалента.
4.3. ЗаконыБидеальных растворов
Идеальным растворомИназывается такая гомогенная система, в
которой отсутствует химические взаимодействие между компонентами, а силы межмолекулярногоС взаимодействия между разнородными
молекулами равны силам взаимодействия между одинаковыми молекулами. Как следует из определения, для идеальных растворов тепловые и объемные эффекты растворения равны нулю. В природе не существует идеальных растворов, но есть растворы, которые по своим свойствам приближаются к идеальным. Это растворы веществ одного гомологического ряда (раствор н-октана в н-гексане), а также разбавленные растворы неэлектролитов. Для этих растворов справедливыми оказываются закон Рауля и закон Вант-Гоффа.
Закон Рауля утверждает, что понижение давления насыщенных паров растворителя над раствором нелетучего компонента прямо пропорционально молярной доле этого компонента:
p0A pA pA p0A xB ,
46
где p0A – давление насыщенных паров растворителя над чистым рас-
творителем; рА – давление насыщенных паров растворителя над раствором нелету-
чего компонента;
pA – понижение давления насыщенных паров растворителя над рас-
твором нелетучего компонента; хВ – молярная доля растворенного нелетучего компонента.
Давление насыщенных паров растворителя над раствором нелетучего компонента понижается по сравнению с давлением насыщенных паров растворителя над чистым раствором, так как молекулы растворенного нелетучего компонента взаимодействуют с молекулами растворителя, удерживают их в растворе, затрудняют процесс испарения.
Из закона Рауля есть два важных для практикиИследствия. Первое следствие из закона Рауля утверждает, что повышение температуры кипения раствора нелетучего компонента прямо пропорционально моляльной концентрации этогоДраствора. Температурой кипения называется температура, при которой давление насыщенных паров растворителя становится равно атмосферному давлению. Так как давление насыщенных паров растворителя над раствором меньше, чем над чистым растворителем, то для достижения этими парами величины атмосферного давления требуется затратить больше энергии,
И |
|
|
|
||
то есть температура кипения раствораАбудет выше, чем температура |
|||||
кипения чистого растворителя. |
|
|
|
||
С |
БE mB 1000 |
||||
|
E C |
|
|
|
|
|
|
, |
|||
Tкип |
M B |
||||
|
|
|
mP |
||
где Tкип Tкип. раствора Ткип. растворителя разность в температурах кипения раствора нелетучего компонента и чистого растворителя; Е – эбуллиоскопическая константа, которая является характеристикой
растворителя и показывает, на сколько градусов повысится температура кипения одномоляльного раствора;
C – моляльная концентрация раствора нелетучего компонента;
тВ – масса растворенного нелетучего компонента; МВ – молярная масса растворенного нелетучего компонента;
тР – масса растворителя, взятого для приготовления раствора.
Второе следствие из закона Рауля утверждает, что понижение температуры замерзания раствора нелетучего компонента прямо пропорционально моляльной концентрации этого раствора. Температу-
47
рой замерзания раствора называется такая температура, при которой давление насыщенных паров растворителя над жидкой фазой становится равно давлению паров растворителя над твердой фазой. Так как давление насыщенных паров растворителя над раствором нелетучего компонента меньше, чем над чистым растворителем, то и величина давления, равная давлению пара над твердой фазой, будет достигнута при более низкой температуре.
Tзам К C E mB 1000 ,
M B mP
где Tзам Тзам. растворителя Тзам. раствора – разность в температурах за-
мерзания чистого растворителя и раствора нелетучего компонента; К – криоскопическая константа, которая является характеристикой
|
|
И |
растворителя и показывает, на сколько градусов понизится темпера- |
||
тура замерзания одномоляльного раствора нелетучего компонента. |
||
Закон Вант-Гоффа касается такого физического явления, как |
||
|
|
Д |
|
осмос. Осмос – самопроизвольный процесс перехода |
|
|
молекул растворителя через полупроницаемую мем- |
|
|
брану из емкости с чистым растворителем в емкость |
|
|
с раствором. Мембрана является полупроницаемой, |
|
|
так как через нее могут проходить только молекулы |
|
|
растворителя, но не могут проходить молекулы рас- |
|
|
И |
|
|
творенного веществаА. Диффузия молекул раствори- |
|
|
теля является односторонней, так как движение мо- |
|
|
лекул растворителяБ |
направлено на выравнивание |
|
концентраций растворенного вещества |
|
Рис. 8. Схема |
в обеих ёмкостях. На рис. 8 изображен осмометр, в ко- |
|
осмометра |
тором 1 – ёмкость с чистым растворителем; 2 – ёмкость |
|
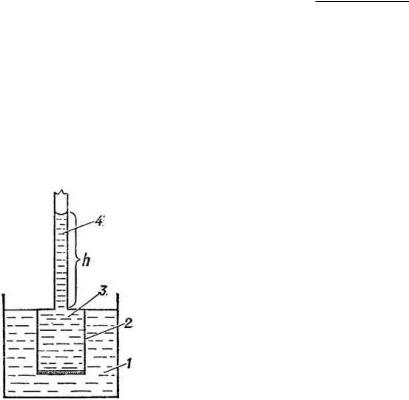
Сс раствором, нижняя часть которого выполнена из полупроницаемой мембраны; 3 – раствор; 4 – стеклянная трубка, позво-
ляющая определить, на какую высоту поднимается жидкость в сосуде с раствором в результате проникновения молекул растворителя в раствор. Процесс осмоса прекратится тогда, когда давление столба раствора в стеклянной трубке станет равно давлению, под действием которого молекулы растворителя переходят из ёмкости с чистым растворителем в раствор. Это давление называется осмотическим.
Вант-Гофф доказал, что для идеальных растворов осмотическое давление прямо пропорционально молярной концентрации раствора и температуре раствора:
48
C R T ,
где π – осмотическое давление, Па; С – молярная концентрация раствора, моль/м3;
R – универсальная газовая постоянная, равная 8,31 Дж/моль∙град; Т – температура по абсолютной шкале, К.
Если концентрацию раствора выражать в единицах моль/дм3, то вычисленное осмотическое давление будет измеряться в кПа.
Если к столбу жидкости в осмометре приложить внешнее давление, большее осмотического, то молекулы растворителя начнут обратный переход через полупроницаемую мембрану из ёмкости с раствором в ёмкость с чистым растворителем. Это явление называется обратным осмосом. Обратный осмос используется в опреснительных
установках, для очистки сточных и природных вод. |
|
|
И |
Лабораторная работа № 6 |
|
Д |
|
ОПРЕДЕЛЕНИЕ КОНЦЕНТРАЦ РАСТВОРОВ |
|
А |
|
Цели работы: научиться производить вычисления для приго- |
|
товления растворов нужной концентрации, приобрести навыки приготовления растворов и определения их концентрации.
вания объёмомС25 смИ3, пипетки мерные объёмом 10 см3, колбы мерные объёмом 100 см3, весы аналитические с погрешностью взвешивания 0,1 мг, часовые стекла для взвешивания, стеклянные воронки, мерные цилиндры объёмом 100 см3, штатив для закрепления бюретки.
Оборудование и материалы: гранулированный NaOH, раствор
0,1 Н хлороводородной кислоты HCl, индикатор фенолфталеин, кол-
Б |
3 |
бы конические для титрования объёмом 250 см , бюретка для титро- |
|
Ход работы
Опыт 1. Приготовление раствора щёлочи.
На основе задания, выданного преподавателем, рассчитать количество гранулированного гидроксида натрия NaOH, необходимого для приготовления 100 см3 раствора заданной концентрации.
Под руководством преподавателя аккуратно взвесить на аналитических весах (на часовом стекле) рассчитанную навеску гидроксида натрия NaOH (помните, что щёлочь – едкое вещество, недопустимо его
49
попадание в глаза и на слизистые оболочки). Навеску количественно перенести с часового стекла в мерную колбу, используя для этого небольшую стеклянную воронку. Остатки щелочи смыть дистиллированной водой со стекла и с воронки в колбу. Перемешать круговыми движениями содержимое колбы. Помните, что растворение щелочи сопровождается большим выделением тепла, поэтому воду надо приливать небольшими порциями, контролируя тепловыделение. После приливания каждой новой порции воды необходимо тщательно перемешивать раствор и дожидаться, пока он остынет. После полного растворения гранул щёлочи раствор в колбе довести водой до метки. Чтобы не налить воды выше метки, последние капли воды удобно добавлять пипет-
кой. Приготовленный раствор перелить в специальную полимерную |
||
склянку, так как щёлочь нельзя хранить в стеклянной посуде. |
||
|
|
И |
Опыт 2. Определение концентрации щёлочи методом ки- |
||
слотно-основного титрования. |
Д |
|
Из склянки с приготовленным раствором щёлочи отобрать мер- |
||
А |
|
|
ной пипеткой по 10 см3 раствора в три чистые конические колбы для
титрования. Для того чтобы уменьшить ошибку из-за разбавления раствора, в каждую колбу мерным цилиндром прилить по 100 см3 дистиллированной воды. ДобавитьБв каждую колбу по три капли раствора фенолфталеина. Раствор должен окраситься в малиновый цвет.
Бюретку, закрепленнуюИв штативе, промыть дистиллированной водой, затем заполнить раствором 0,1 Н хлороводородной кислоты HCl до метки С«0», контролируя при этом, чтобы в носике пипетки не оставался воздух. Начать титрование, прибавляя по каплям раствор из бюретки и перемешивая раствор в колбе до тех пор, пока окраска не исчезнет. После этого титрование прекратить. Записать в тетрадь объём кислоты, пошедший на титрование первой колбы, с точностью до десятых долей см3. По этой же методике провести титрование растворов во второй и третьей колбах. Расхождение между результатами определения не должно превышать 0,2 см3.
Вычислить средний объём кислоты, пошедший на титрование трёх колб. Вычислить нормальную концентрацию раствора щёлочи. Объясните, почему найденная концентрация немного меньше расчетной. По результатам проделанной работы записать вывод.
50

Контрольные вопросы и задания
1.Дайте определение истинного раствора. Какой из компонентов раствора называется растворителем, а какой – растворенным веществом?
2.Как количественно можно охарактеризовать способность веществ растворяться в том или ином растворителе?
3.Объясните причину тепловых и объёмных эффектов растворения.
4.Какие весовые концентрации вы знаете? Запишите выражения для их расчета.
5.Дайте определение молярной концентрации и молярной концентрации эквивалента. Как можно их рассчитать?
6.Какие растворы называются идеальными? Сформулируйте за-
коны идеальных растворов: закон Рауля, следствия из него и закон Вант-Гоффа. И
5.ОКИСЛИТЕЛЬНО-ВОССТАНОВДТЕЛЬНЫЕ РЕАКЦИИ
5.1.Понятие об окислительноА-восстановительных реакцияхпри приёме или отдаче электроновБ( e ).
тельный заряд, если принимают электроны, то заряд частицы станет отрицательным.
Например, атом натрия содержит 11 электронов, причем на внешнем уровне у него всего один электрон:
Если элементыИотдают электроны, то они приобретают положи- С
+11Na 1s2 2s2 2p6 3s1.
Для получения завершенного внешнего энергетического уровня атому натрия нужно отдать один электрон, в результате чего он пре-
вратится в положительно заряженный ион Na+: Na0 – 1 e → Na+1.
У атома хлора на внешнем уровне 7 электронов:
+17 Cl 1s2 2s2 2p6 3s2 3p5,
до завершения уровня не хватает одного электрона, который он при-
нимает и превращается в Cl-1 :
Cl0 + 1 e → Cl-1.
51
Степень окисления простых веществ равна нулю. Например: Na0, O20, P0, Al0 и т.д.
В соединениях некоторые элементы проявляют всегда постоянную
степень окисления, определить которую можно по номеру группы: Na+, Mg+2, Ca+2, Zn+2, H+ (исключение – гидриды металлов, в которых
водород имеет отрицательную степень окисления Na+H–). Атом кислорода всегда имеет степень окисления –2 кроме перекисных соединений (Н2+О2–) и фторида кислорода (F2–O+2). Металлы всегда имеют положительную степень окисления.
Большинство элементов имеют в сложных соединениях переменную степень окисления. Так, азот может иметь степень окисления от –3 до +5, марганец – от +2 до +7.
1.Практически все неорганическиеИсоединения начинаются с элементов с положительной степеньюДокисления и заканчиваются элементом с отрицательной степенью окисления.
2.В нейтральной молекулеАалгебраическая сумма степенейБПри определении степени окисления элементов в соединениях
которой он находитсяСИ(из этого правила есть несколько исключений, фтор находится в седьмой группе, но никогда не проявляет степень окисления +7, так как это самый электроотрицательный элемент, он ни одному элементу не отдает своих электронов). Cr находится в шестой группе, следовательно, высшая степень окисления хрома равна + 6.
х = +5 |
+2 + х – 8 = 0 |
|
х = +6 |
3. Высшая степень |
окисления элемента равна номеру группы, в |
4. Низшая степень окисления равна максимальному числу электронов, которые могут быть приняты данным элементом. Вычислить минимальную степень окисления можно, вычитая из номера группы 8 (максимально возможное количество электронов на внешнем уровне любого атома). Это правило соблюдается только для неметаллов. Для всех металлов минимальная степень окисления равна нулю, так как металлы не способны присоединять электроны. Например: азот N находится в 5-й группе, следовательно, 5 – 8 = –3, низшая степень окисления азота равна –3, например в молекуле аммиака N–3H3+.
Процесс отдачи электронов называется окислением, в процессе окисления степень окисления атома повышается. Процесс присоединения электронов называется восстановлением, при этом степень окисления атома уменьшается. Пример полуреакций окисления и восстановления приведен в табл. 8.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 8 |
|
Примеры полуреакций окисления и восстановления |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
Окисление – процесс отдачи электрона |
Восстановление – процесс принятия |
||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
электрона |
||||||
|
Н20 – 2 |
|
|
|
|
→ 2H+ – |
|
Cl20 + 2 |
|
|
|
|
→ 2Cl– – |
||||||
|
e |
|
e |
||||||||||||||||
|
окисление молекулы |
|
восстановление молекулы |
||||||||||||||||
|
Mg0 – 2 |
|
|
|
→ Mg+2 – |
|
S0 + 2 |
|
|
|
→ S–2 – |
||||||||
|
e |
|
e |
||||||||||||||||
|
окисление атома |
|
восстановление атома |
||||||||||||||||
|
S–2 – 2 |
|
→ S0 – |
|
Mg2+ + 2 |
|
→ Mg0 – |
||||||||||||
|
e |
|
e |
||||||||||||||||
|
окисление иона |
|
восстановление иона |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
Д |
||||||
Например, в реакции 2Zn + O2 → 2ZnO |
|||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
А |
|||||||
|
Zn0 – 2 |
e |
→Zn+2 |
– |
окислениеИ; |
||||||||||||||
|
О20 + 4 |
e |
→2O–2 |
– |
восстановление. |
||||||||||||||
Zn0 |
|
|
|
|
|
|
|
|
|
|
Б |
|
|
|
|
|
|
|
|
окисляется, при этом он является восстановителем. |
|||||||||||||||||||
O20 восстанавливается, при этом он является окислителем. Необходимо уравнять число отданных и принятых электронов – сде-
лать электронный баланс. Так как атом цинка отдает 2 электрона, а молекула
кислорода принимает 4 электрона, то наименьшим общим кратным для этих |
||||||
С |
|
|
||||
чисел будет 4. Теперь определим дополнительные коэффициенты: |
||||||
4 : 2 = 2 – это множитель для атома цинка. |
||||||
4 : 4 = 1 – этоИмножитель для молекулы кислорода. |
||||||
Наименьшее кратное и дополнительные коэффициенты обычно |
||||||
пишут справа от уравнений полуреакций: |
||||||
Zn0 – 2 |
|
|
→Zn+2 |
│ |
2 – процесс окисления |
|
e |
||||||
|
|
|
|
|
│4 |
|
О20 + 4 |
|
→2O–2 |
│ |
1 – процесс восстановления |
||
e |
||||||
В зависимости от количества валентных электронов элементы и соединения, их содержащие, могут быть только восстановителями, только окислителями или проявлять окислительно-восстановительную двойственность. Примеры таких соединений приведены в табл. 9.
53

|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Таблица 9 |
|
|
Примеры типичных окислителей и восстановителей |
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
Типичные |
|
|
|
Типичные |
|
Соединения, проявляющие |
||||||||||||
|
окислители |
|
|
|
восстановители |
|
окислительно- |
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
восстановительную |
||||||||
|
|
|
|
|
|
|
|
|
|
|
двойственность |
||||||||
Элементы с ярко выражен- |
Атомы металлов |
|
Если элемент проявляет |
||||||||||||||||
ной электроотрицатально- |
(I и II группы, Pb, Sn, |
промежуточную степень |
|||||||||||||||||
стью:F2, Cl2, I2, Br2, O2 (у |
все d и f-элементы) |
окисления, то в зависимо- |
|||||||||||||||||
галогенов окислительная |
Элементы с невысокой |
сти от свойств партнера он |
|||||||||||||||||
способность растет от I к F) |
электроотрицатальностью |
или его соединение может |
|||||||||||||||||
|
|
|
|
|
|
|
Н2, C, B |
|
быть и окислителем, и вос- |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
становителем: |
||||||||
|
|
|
|
|
|
|
|
|
|
|
S0+Zn0 |
Zn+2S–2 |
|||||||
|
|
|
|
|
|
|
|
|
|
И |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
S0 + 2 |
e |
→ S–2 |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
окислитель |
|||||||
|
|
|
|
|
|
|
|
|
|
|
S0+O 0 |
S+4O –2 |
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
2 |
|
|
|
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
S0 – 4 |
|
→ S+4 |
||||||
|
|
|
|
|
|
|
|
|
|
|
e |
||||||||
|
|
|
|
|
|
|
|
|
|
|
восстановитель |
||||||||
|
|
|
|
|
|
|
А |
|
|
|
|
|
|
|
|
|
|
||
Соединения, в которых эле- |
Соединения, в которых |
войственность проявляют |
|||||||||||||||||
менты проявляют высшую |
элементы проявляют |
и сложные соединения, |
|||||||||||||||||
|
|
|
|
|
|
|
Б |
|
|
|
|
|
|
|
|
|
|
|
|
степень окисления: HN+5O3, |
низшую степеньДокисле- |
|
например |
|
|||||||||||||||
H |
S+6O |
, K |
Cr+6 |
2 |
O |
7 |
ния (KI–, H |
S–2 и т.д.) |
|
Н |
О |
, MnO |
2 |
||||||
2 |
4 |
2 |
|
|
|
2 |
|
|
|
2 |
|
2 |
|
|
|
|
|||
|
|
|
|
|
|
|
|||||||||||||
Например: Н2О2 – перекись водорода, может проявлять окисли- |
|||||||||||||||||||
|
|
С |
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
тельно-восстановительную двойственность. В реакции с молекуляр- |
|||||||||||||||||||
ным йодом она является окислителем, а в реакции с хлорноватой ки- |
|||||||||||||||||
слотой проявляет восстановительныеИ |
свойства: |
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
I2 + 5H2O2 2HIO3 + 4H2O |
||
I20 |
– |
10 |
|
|
|
2I+5 |
|
1 |
восстановитель |
||||||||
e |
|
||||||||||||||||
|
|||||||||||||||||
2О– |
+ |
2 |
e |
|
2О–2 |
|
5 |
окислитель |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
HClO3 + 3H2O2 HCl + 3O2 + 3H2O |
||||
Cl+5 + 6 |
|
|
Cl– |
|
|
окислитель |
|
||||||||||
e |
|
|
1 |
|
|
||||||||||||
|
|
|
|
||||||||||||||
2О– – 2 |
e |
O20 |
|
|
3 |
|
восстановитель |
|
|||||||||
|
|
|
|||||||||||||||
54
