
- •ВВЕДЕНИЕ
- •1. ТЕРМОХИМИЯ И ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.1. Термохимия
- •1.2. Химическая термодинамика
- •1.3. Первый закон термодинамики
- •1.4. Энтропия
- •2. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •2.1. Основные понятия химической кинетики
- •2.2. Влияние различных факторов на скорость химической реакции
- •2.3. Механизм химической реакции. Каталитические реакции
- •2.4. Химическое равновесие
- •3. РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ
- •3.2. Особые свойства поверхностных молекул
- •3.3. Процесс адсорбции
- •4. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
- •4.1. Истинные растворы. Растворимость
- •5.2. Классификация окислительно-восстановительных реакций
- •6. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- •6.1. Электрохимические системы
- •6.2. Устройство гальванического элемента
- •6.3. Концентрационный гальванический элемент
- •7. КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ
- •7.1. Понятие о коррозии и её виды
- •7.3. Электрохимическая коррозия
- •7.4. Влияние различных факторов на скорость коррозии
- •7.5. Защита металлов от коррозии
- •8.1. Понятие об электролизе. Законы Фарадея
- •8.2. Электролиз расплавов электролитов
- •8.4. Растворимые и нерастворимые аноды
- •9.ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- •9.1. Положение металлов в периодической таблице
- •9.2. Физические свойства металлов
- •9.3. Химические свойства металлов
- •11.ОРГАНИЗМ И СРЕДА. ЭКОЛОГИЧЕСКИЕ ФАКТОРЫ
- •11.1. Понятие о среде обитания и экологических факторах
- •11.3. Биотические факторы
- •11.4. Лимитирующий фактор
- •11.5. Виды адаптации
- •12.1. «Парниковый» эффект
- •12.2. «Озоновые дыры»
- •12.3. Кислотные осадки
- •12.4. Энергетический кризис
- •12.5. «Демографический взрыв» и продовольственная проблема
- •12.6. Сокращение биоразнообразия
- •13.1. Нормирование качества окружающей природной среды
- •13.2.Нормативы качества окружающей среды
- •13.3. Нормативы допустимого воздействия на окружающую среду
- •13.4. Экологический мониторинг
- •14.3. Экозащитная техника и технологии
- •Библиографический список
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Приложение 4
2. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
2.1. Основные понятия химической кинетики
Наука, изучающая закономерности протекания химических реакций во времени, механизмы химических реакций, а также факторы, влияющие на скорость химической реакции, называется химической кинетикой.
Все реакции с точки зрения химической кинетики делятся на простые и сложные. Простые реакции проходят в одну стадию, то есть исходные вещества сразу превращаются в продукты реакции. В зависимости от того, сколько атомов или молекул участвуют в элементар-
элементарном акте участвуют три молекулы). Реакций с молекулярно-
ном акте простой химической реакции, различают мономолекулярные (одна молекула распадается на продукты реакцииИ), бимолекулярные
ного столкновения четырех и более молекул практически равна нулю.
(две молекулы исходных веществ сталкиваются, в результате чего происходит образование продуктов реакцииД) и тримолекулярные (в
Примером простой мономолекулярной реакции может быть реакция диссоциации молекулыБводорода на отдельные атомы: Н2 → 2Н.
стью более трех в природе не бываетА, так как вероятность одновремен-
Сложные реакции проходят в две или более стадий. К ним относятся обратимые (реакцияИодновременно идет в прямом и обратном
направлениях), параллельные (из одних и тех же исходных веществ в одних и тех жеСусловиях могут образовываться различные продукты реакции) и последовательные реакции (продукт первой стадии служит исходным веществом для второй стадии и так далее). Примером сложной реакции может служить взаимодействие молекул водорода и кислорода с образованием воды: H2 + О2 → 2H2О, первой стадией которой является диссоциация молекул водорода на отдельные атомы с последующим взаимодействием этих атомов с молекулами кислорода.
В зависимости от области протекания химической реакции различают гомогенные (все компоненты находятся в одной и той же фазе и реакция проходит во всем объеме газообразной или жидкой фазы) и гетерогенные (химическая реакция проходит на границе раздела фаз). Примером гомогенной реакции может быть взаимодействие молекул метана и кислорода:
СH4 (г) + 2О2 (г)→ СО2 (г) + 2Н2О (г).
Эта реакция проходит во всем объеме газовой фазы.
18

Реакция взаимодействия железа с кислородом во влажном воздухе (коррозия железа) относится к гетерогенным, так как проходит на поверхности металла:
2Fe (т) + О2 (г) + 2H2О (ж)→ 2Fe(ОН)2 (т).
Скоростью химической реакции υ называется изменение числа молей ∆ν исходного или образовавшегося вещества в единицу времени в единице реакционного пространства.
|
|
, |
|
||
t R |
||
|
п |
|
где Δν – изменение числа молей исходного вещества или продукта реакции (знак + используют, если изменение числа молей относится к продуктам реакции, а знак – если отслеживают изменение числа мо-
лей исходных веществ); |
И |
Δt – промежуток времени, в течение которого произошли данные изменения количества вещества;
Rп – реакционное пространство.
Для гомогенной реакции реакционным пространством является объем V жидкой или газообразной фазы, а при V = const отношение числа молей прореагировавшего или образовавшегося вещества к
|
|
|
Б |
|
|
|
|
объёму |
|
будет равно изменению концентрацииД |
С, поэтому |
||||
|
V |
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
|
|
гом |
А |
. |
|
|
|
|
И |
t V |
t |
|
|
|
|
|
|
|
|
|
||
Таким образом, скорость гомогенной реакции равна изменению |
|||||||
|
|
С |
|
|
|
|
|
концентрации одного из веществ в единицу времени.
Для гетерогенной реакции реакционным пространством является поверхность раздела фаз S, поэтому
,
где S – площадь поверхности раздела фаз, на которой проходит гетерогенная реакция.
2.2. Влияние различных факторов на скорость химической реакции
На скорость реакции влияет множество факторов. Прежде всего, природа реагирующих веществ, их концентрация, температура, наличие и природа катализатора (соединения, увеличивающего скорость реакции), а также площадь поверхности границы раздела фаз (в гетероген-
19
ных реакциях), природа растворителя, ионная сила раствора (в реакциях в растворах), внешние воздействия (такие как облучение светом).
Зависимость скорости реакции от концентрации реагирующих веществ изучали в конце XIX в. норвежские ученые К. Гульдберг и П. Вааге. В 1867 г. они сформулировали кинетический закон дейст-
вующих масс для простых реакций: при постоянной температуре ско-
рость простой реакции прямо пропорциональная произведению концентраций реагирующих веществ, причем каждая концентрация возведена в степень, равную её стехиометрическому коэффициенту (коэффициент в уравнении химической реакции).
Например, для реакции 2NO + O2 → 2NO2 выражение для скорости химической реакции в зависимости от концентрации оксида
азота (II) и кислорода будет иметь вид
кон называют кинетическим уравнением химическойИреакции. В нем вместо стехиометрических коэффициентов концентрации реагирую-
k NO 2 O2 ,
где k – константа скорости химической реакции.
щих веществ возводят в степени, называемыеДпорядками реакции по веществам. Сумма степеней в основном уравнении химической кине-
В общем виде для любых (сложных и простых) реакций этот за-
дет зависеть не от концентрацииИБвещества, а от площади его поверхности:
тики называется общим порядком химической реакции. Порядок хими- |
|
ческой реакции определяется экспериментальноА |
. |
Если одно из реагирующих веществ твердое, то скорость реакции бу- |
|
С С(Тв) + O2 (Г)→ СO2 (Г);
k O2 SC .
Так как площадь поверхности твердого тела часто трудно установить, вычисляют удельную (то есть на единицу площади поверхно-
сти раздела фаз) скорость реакции:
уд k O2 .
При этом в уравнение подставляют не общую концентрацию газообразного или жидкого реагента, а концентрацию реагента у поверхности твердого тела (определяется экспериментально). Из этого следует, что скорость гетерогенной реакции также зависит от скорости подвода реагента в зону химической реакции.
Влияние температуры на скорость химической реакции описывает правило Вант-Гоффа: при повышении температуры на каждые 10 0С ско-
20
рость реакции возрастает в 2 – 4 раза. Это правило не является строгим, оно справедливо только для небольшого интервала температур.
|
|
|
|
|
t2 t1 |
|
|
|
|
t |
|
10 |
, |
t |
2 |
|
|
|
||
|
|
1 |
|
|
|
где υt1 и υt2 – скорости реакции при температурах t1 и t2;
γ – температурный коэффициент, который показывает, во сколько раз изменяется скорость химической реакции при изменении температуры на 10 0С (определяется экспериментально).
Температурный коэффициент обычно изменяется в пределах от 2 до 4, причем для экзотермических реакций он принимает меньшие значения, чем для эндотермических.
Более строго зависимость скорости химической реакции от тем-
пературы описывает уравнение Аррениуса: |
И |
|||
|
||||
|
e |
E A |
|
|
k k0 |
RT |
, |
|
|
|
Д |
|||
где k – константа скорости химической реакции. Она зависит от природы реагирующих веществ, от температуры и присутствия катализатора; k0 – предэкспоненциальный множительА, который указывает число столкновений молекул в единицу времени в единице объема;
EA – энергия активации, кДжБ/моль;
R – универсальная газовая постоянная, R = 8,31 Дж/моль∙К; T – температура реакцииИпо абсолютной шкале.
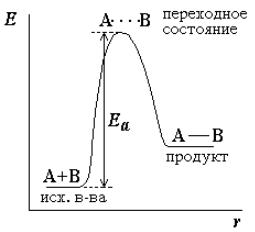
Не каждое столкновение молекул заканчивается образованием продуктов реакции. Для того чтобы ослабить старые химические связи до такого состоянияС, чтобы энергия, выделяемая при образовании новых связей, могла компенсировать затраты на разрыв старых связей, необходима избыточная энергия, её называют
энергий активации.
Энергия активации – это мини-
мальная избыточная энергия, которой должны обладать молекулы, чтобы произошла химическая реакция. Только при столкновении молекул, имеющих запас этой избыточной по сравнению с остальными молекулами энергии, могут
21
