
- •ВВЕДЕНИЕ
- •1. ТЕРМОХИМИЯ И ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.1. Термохимия
- •1.2. Химическая термодинамика
- •1.3. Первый закон термодинамики
- •1.4. Энтропия
- •2. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •2.1. Основные понятия химической кинетики
- •2.2. Влияние различных факторов на скорость химической реакции
- •2.3. Механизм химической реакции. Каталитические реакции
- •2.4. Химическое равновесие
- •3. РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ
- •3.2. Особые свойства поверхностных молекул
- •3.3. Процесс адсорбции
- •4. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
- •4.1. Истинные растворы. Растворимость
- •5.2. Классификация окислительно-восстановительных реакций
- •6. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- •6.1. Электрохимические системы
- •6.2. Устройство гальванического элемента
- •6.3. Концентрационный гальванический элемент
- •7. КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ
- •7.1. Понятие о коррозии и её виды
- •7.3. Электрохимическая коррозия
- •7.4. Влияние различных факторов на скорость коррозии
- •7.5. Защита металлов от коррозии
- •8.1. Понятие об электролизе. Законы Фарадея
- •8.2. Электролиз расплавов электролитов
- •8.4. Растворимые и нерастворимые аноды
- •9.ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- •9.1. Положение металлов в периодической таблице
- •9.2. Физические свойства металлов
- •9.3. Химические свойства металлов
- •11.ОРГАНИЗМ И СРЕДА. ЭКОЛОГИЧЕСКИЕ ФАКТОРЫ
- •11.1. Понятие о среде обитания и экологических факторах
- •11.3. Биотические факторы
- •11.4. Лимитирующий фактор
- •11.5. Виды адаптации
- •12.1. «Парниковый» эффект
- •12.2. «Озоновые дыры»
- •12.3. Кислотные осадки
- •12.4. Энергетический кризис
- •12.5. «Демографический взрыв» и продовольственная проблема
- •12.6. Сокращение биоразнообразия
- •13.1. Нормирование качества окружающей природной среды
- •13.2.Нормативы качества окружающей среды
- •13.3. Нормативы допустимого воздействия на окружающую среду
- •13.4. Экологический мониторинг
- •14.3. Экозащитная техника и технологии
- •Библиографический список
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Приложение 4
приобретающий положительный заряд, становится анодом, на нем начинается окисление металла. Примером электрокоррозии может быть разрушение трубопровода, расположенного под землей, сверху которого проложены рельсы электротранспорта. Установлено, что блуждающий ток силой 1 А способен разрушить 9 кг железа за год.
На практике коррозия происходит не по одному, а по нескольким механизмам, то есть имеет комплексный характер.
В зависимости от среды различают следующие виды электрохимической коррозии:
а) атмосферная коррозия происходит при конденсации на поверхности металла паров воды с растворенными в ней кислородом, углекислым газом, оксидами серы и азота и т.п.;
б) аэрационная коррозия – разрушение металла, вызванное не- |
||||
|
|
|
|
И |
одинаковым доступом воздуха к различным его участкам; |
||||
в) почвенная коррозия – разрушение металла во влажной почве, |
||||
|
|
|
Д |
|
особенно заметна в кислых почвах (болотистых, торфяниках); |
||||
г) биокоррозия – разрушение металла продуктами жизнедея- |
||||
|
|
А |
|
|
тельности микроорганизмов (углекислым газом, сернистым газом, се- |
||||
роводородом); |
|
|
|
|
д) морская коррозия – разрушение металла в морской воде, бо- |
||||
|
Б |
|
|
|
гатой различными солями, в том числе хлоридами, которые являются |
||||
активаторами коррозии. |
|
|
|
|
И |
|
|
|
|
7.4. Влияние различных факторов на скорость коррозии |
||||
С |
|
|
|
|
На скорость коррозии влияют многие факторы. В первую очередь это природа самого металла, природа примесей в металле, природа продуктов коррозии. Во-вторых, так как коррозия – это химическая реакция, то скорость её возрастает с увеличением температуры. На скорость коррозии влияет возможность образования коррозионного гальванического элемента. При его образовании скорость разрушения металла увеличивается. Влияет на скорость коррозии количество кислорода, растворенного в электролите, концентрация самого электролита. Большое влияние на скорость коррозии оказывает концентрация ионов водорода.
Большинство металлов устойчивы к коррозии в щелочной среде, скорость коррозии в нейтральной среде также незначительна. Скорость коррозии в кислой среде возрастает, так как оксидная пленка на поверхности металла легко растворяется в кислоте. На рис. 9 показана
71
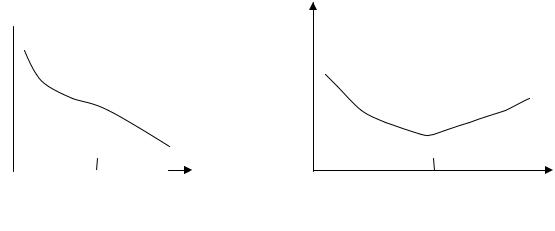
зависимость скорости коррозии от рН среды для таких металлов, как железо, магний, никель, кадмий (рН = – lg[H+]).
Если металл образует оксид с амфотерными свойствами (к таким металлам относятся алюминий, цинк, свинец, олово), то защитная оксидная пленка будет растворяться и в кислой, и в щелочной среде: Al2O3 + 2OH- +3H2O → 2[Al(OH)4]-. Для таких металлов скорость коррозии возрастает и в кислой, и в щелочной среде (рис. 10).
w
w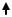
|
|
|
|
|
|
И |
|
|
|
|
7 Щелочная pH |
|
|
|
|||
Кислая |
|
Д |
7 |
Щелочная рН |
||||
|
Кислая |
|||||||
среда |
среда |
|
среда |
|
среда |
|||
|
|
|
|
А |
|
|
|
|
Рис. 9. Зависимость скорости коррозии |
Рис. 10. Зависимость скорости коррозии |
|||||||
|
Fe, Mg, Ni, Cd от рН среды |
|
|
Al, Zn, Pb, Sn от среды |
||||
Благородные металлыБ, имеющие положительный электродный потенциал, коррозии практически не подвергаются в любой среде. К таким металлам относятсяИзолото, платина и т.п.
7.5. Защита металлов от коррозии
ИзвестноСмного способов защиты металлов от коррозии.
1. Легирование металлов – это введение в сплав компонентов, препятствующих коррозионным процессам. Например, для предотвращения разрушения стали в нее добавляют алюминий, хром, никель, титан, вольфрам, кремний. В результате на поверхности металла образуются прочные плотные оксидные пленки, которые препятствуют коррозии. Кроме повышения коррозионной стойкости, такие стали обладают повышенной жаростойкостью (стойкость к газовой коррозии при высоких температурах) и жаропрочностью (способностью материала сохранять высокую механическую прочность при значительном повышении температуры). Так, сплав железа с добавлением 30% хрома, 5% алюминия и 0,5% кремния выдерживает нагревание
72
до 1300 оС, а сплав никеля с добавкой 20% хрома – до 1150 оС. Этот метод защиты металлов от коррозии эффективный, но дорогой.
2.Защитные покрытия – самый распространенный метод защиты металлов от коррозии. Покрытия бывают органическими и неорганическими. К органическим покрытиям относятся лаки, краски, полимерные покрытия, гуммирование (покрытие слоем резины), битумные покрытия.
Неорганические покрытия подразделяются на металлические и неметаллические. Металлические покрытия – это тонкий слой металла, нанесенный на поверхность защищаемого металлического изделия. Металлические покрытия наносят различными способами: термодиффузией (расплавленный металл покрытия проникает в поверхностный
слой защищаемого металла), металлизацией (металл покрытия распыляют на поверхность защищаемого изделия сИпомощью сжатого воздуха), гальванизацией (защищаемая деталь закрепляется в качестве катода и на ее поверхности происходит электроосаждениеД металла покрытия) и др. Если металл покрытия имеет меньший электродный потенциал, чем защищаемый металл, покрытиеАназывают анодным. Примером анодных покрытий на железе служат цинковое, алюминиевое,
хромовое покрытия. Если электродный потенциал покрытия больше потенциала защищаемого металлаБ, покрытие называется катодным. К катодным покрытиям железа относятся оловянное, никелевое, медное
ит.п. покрытия. В случаеИнарушения целостности покрытия анодное покрытие будет лучше защищать металл от разрушения, так как именно металл покрытияСначнет разрушаться в первую очередь.
К неметаллическим покрытиям относятся различные эмали. Это стеклообразные покрытия из оксидов, которые наносят при высокой температуре. При остывании такое покрытие образует красивый защитный слой, но его недостатком является высокая хрупкость. При ударах эмали дают трещины, раскалываются.
Еще один вид неметаллических покрытий – химические покрытия, которые образуются на поверхности металла в результате его обработки сильным окислителем, например концентрированной азотной кислотой. К методам нанесения химических покрытий относятся воронение, азотирование, фосфатирование.
3.Электрохимическая защита – это торможение анодных и ка-
тодных процессов. Катодная защита осуществляется подключением защищаемого металла к отрицательному полюсу внешнего источника постоянного тока. В результате деталь становится катодом, на ее по-
73
верхности происходит восстановление элементов среды, но металл не разрушается. В качестве анода используют вспомогательный кусок металла (рельс, металлический прут, лом), который подсоединяют к положительному полюсу источника тока. Пока этот искусственный анод не разрушится, металл будет защищен.
Анодная, или протекторная защита, – это присоединение к за-
щищаемому металлу куска более активного металла (с меньшим значением электродного потенциала). Этот металл называется протектором. Например, чтобы защитить железный корпус судна, к нему прикрепляют листы цинка. В среде электролита (например, в морской воде) протектор начинает разрушаться, а защищаемое изделие выполняет функцию катода, то есть не разрушается.
4.Изменение свойств коррозионной среды – способ уменьшить коррозию за счет снижения концентрации Иагрессивного компонента среды. Например, для удаления из воды растворенного кислорода воду кипятят или вытесняют кислород Динертным газом (азотом, аргоном). Для уменьшения концентрации ионов водорода проводят нейтрализацию кислоты щелочью. АЕще один способ снижения концентрации агрессивных компонентов – добавление восстановителей, ко-
торые будут реагировать с окислителями и превращать их в безвредные с точки зрения коррозииБвещества. Часто для уменьшения скорости коррозии добавляют специальные вещества – ингибиторы.
Эффективной Изащитой от блуждающих токов, от почвенной коррозии является дренаж, осушение почв, надежная изоляция рельсов электротранспортаС, трубопроводов.
5.Рациональное конструирование – это предупреждение корро-
зии на стадии проектирования. Например, исключение возможности контакта двух разных металлов в среде электролита, чтобы предотвратить образование коррозионного гальванического элемента, исключение возможности контакта металла с агрессивной средой и т.п.
Лабораторная работа № 9
КОРРОЗИЯ И ЗАЩИТА ОТ КОРРОЗИИ МЕТАЛЛОВ
Цели работы: изучить механизм возникновения коррозии, выявить причины, влияющие на скорость коррозии, ознакомиться с видами защитных покрытий.
74
Материалы и оборудование: железные пластинки, скрепленные с кусочками цинка и олова, медная проволока, 0,5 Н растворы FeSO4, K3[Fe(CN)6], CuSO4, CuCl2, 2 H раствор H2SO4, Zn, Al – кусочки ме-
таллов, пробирки.
Опыт 1. Электрохимическая коррозия оцинкованного и луженого железа.
В пробирку налить 4…6 капель раствора соли железа (II) FеSO4, добавить 1…2 капли раствора K3 [Fe(CN)6] – красной кровяной соли. Эта реакция является качественной на ионы Fе2+. Наблюдать появление синего окрашивания вследствие образования турнбулевой сини
Fe3[Fe(CN)6]2.
Налить в чистую пробирку на 3/4 ее объема дистиллированной |
|
И |
|
воды и добавить по 4…5 капель 2 Н серной кислоты и K3 |
[Fe(CN6)]. |
Раствор перемешать, отделить половину во вторую пробирку. В первую пробирку опустить железную пластинкуД, соединённую с кусоч-
ком олова, во вторую – железную пластинку, соединенную с кусоч-
блюдается выделение газа. Какой это газ? С поверхности какого ме-
ком цинка. В какой пробирке появиласьАсиняя окраска? Почему? На-
талла поднимается газ в луженом и оцинкованном железе? Составить схему электрохимической Бкоррозии. В каком случае будет проходить
коррозия железа при нарушении защитного слоя? В каком случае будет разрушаться защитноеИпокрытие?
Опыт 2.СВлияние образования микрогальванических элемен-
тов на коррозию металлов.
а) В две пробирки налить по 1 см3 2 Н серной кислоты и бросить по кусочку цинка. В одну из пробирок добавить одну каплю раствора сульфата меди. Наблюдать более интенсивное выделение водорода в пробирке с добавлением CuSO4. Что появилось на поверхности цинка в присутствии CuSO4? Объяснить различную интенсивность выделения водорода в двух пробирках, учитывая, что цинк с медью образуют микрогальванический элемент. Указать анод и катод в образовавшейся гальванической паре. Написать уравнения соответствующих реакций.
б) В пробирку налить 1 см3 2 Н серной кислоты, добавить кусочек цинка, опустить туда же медную проволоку так, чтобы она не касалась цинка. Наблюдать слабое выделение водорода на цинке и отсутствие его на медной проволоке. Привести медную проволоку в соприкосновение с цинком и наблюдать интенсивное выделение водо-
75
