
- •ВВЕДЕНИЕ
- •1. ТЕРМОХИМИЯ И ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.1. Термохимия
- •1.2. Химическая термодинамика
- •1.3. Первый закон термодинамики
- •1.4. Энтропия
- •2. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •2.1. Основные понятия химической кинетики
- •2.2. Влияние различных факторов на скорость химической реакции
- •2.3. Механизм химической реакции. Каталитические реакции
- •2.4. Химическое равновесие
- •3. РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ
- •3.2. Особые свойства поверхностных молекул
- •3.3. Процесс адсорбции
- •4. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
- •4.1. Истинные растворы. Растворимость
- •5.2. Классификация окислительно-восстановительных реакций
- •6. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- •6.1. Электрохимические системы
- •6.2. Устройство гальванического элемента
- •6.3. Концентрационный гальванический элемент
- •7. КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ
- •7.1. Понятие о коррозии и её виды
- •7.3. Электрохимическая коррозия
- •7.4. Влияние различных факторов на скорость коррозии
- •7.5. Защита металлов от коррозии
- •8.1. Понятие об электролизе. Законы Фарадея
- •8.2. Электролиз расплавов электролитов
- •8.4. Растворимые и нерастворимые аноды
- •9.ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- •9.1. Положение металлов в периодической таблице
- •9.2. Физические свойства металлов
- •9.3. Химические свойства металлов
- •11.ОРГАНИЗМ И СРЕДА. ЭКОЛОГИЧЕСКИЕ ФАКТОРЫ
- •11.1. Понятие о среде обитания и экологических факторах
- •11.3. Биотические факторы
- •11.4. Лимитирующий фактор
- •11.5. Виды адаптации
- •12.1. «Парниковый» эффект
- •12.2. «Озоновые дыры»
- •12.3. Кислотные осадки
- •12.4. Энергетический кризис
- •12.5. «Демографический взрыв» и продовольственная проблема
- •12.6. Сокращение биоразнообразия
- •13.1. Нормирование качества окружающей природной среды
- •13.2.Нормативы качества окружающей среды
- •13.3. Нормативы допустимого воздействия на окружающую среду
- •13.4. Экологический мониторинг
- •14.3. Экозащитная техника и технологии
- •Библиографический список
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Приложение 4
этой зависимости. Поясните, как изменяется величина константы равновесия для экзотермических и эндотермических реакций с изменением температуры.
5. Что означает динамический характер химического равновесия? Сформулируйте и поясните на примерах принцип Ле Шателье.
3. РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ
3.1. Химическое равновесие в гетерогенных системах
На с. 18 было дано определение гетерогенным реакциям как реакциям, проходящим на границе раздела фаз в многофазной системе.
Если гетерогенная реакция является обратимой, то в определенный |
|
|
И |
момент времени скорости прямой и обратной реакций станут равны- |
|
ми и установится химическое равновесие. |
|
Д |
|
Примерами обратимых гетерогенных реакций являются |
|
С(тв) + 2Н2О(г) ↔ СО2(г) + 2Н2(г); |
|
pА |
|
С(тв) + СО2(г) ↔ 2СО(г). |
|
Вычислить температуру, при которой установится равновесие в |
|
гетерогенных реакциях, можно из условия химического равновесия |
|||
|
Б |
|
|
G = 0. Так как G = H – T·ΔS , то равновесная температура |
|||
И |
T H . |
||
|
S |
||
|
|
|
|
Константа химического равновесия в гетерогенных реакциях вы- |
|||
С |
|
|
|
числяется на основе закона действующих масс, но для твердых веществ концентрации считаются равными единице и в выражение для константы равновесия не записываются. Например, для приведенных выше реакций
|
CO2 H2 2 |
СО 2 |
K1 |
|
и К2 СО2 . |
H O 2 |
||
|
2 |
|
Можно выражать константу равновесия гетерогенной реакции и через парциальные давления газообразных веществ. (Парциальное давление
– это та часть общего давления, которую оказывают молекулы данного газообразного соединения. Сумма парциальных давлений всех газообразных веществ данной системы равна общему давлению в системе.)
К |
рСО рH2 |
|
|
|
|
р2 |
||
|
|
2 |
и К |
2 |
СО |
. |
||
|
|
|
||||||
1 |
рН2 |
2О |
|
|
|
рСО2 |
||
32
В выражение константы равновесия гетерогенных реакций не входит величина площади поверхности твердого вещества, так как и прямая, и обратная реакции проходят на одной и той же поверхности.
Принцип Ле Шателье для равновесия в гетерогенных реакциях справедлив так же, как и для гомогенных реакций.
3.2. Особые свойства поверхностных молекул
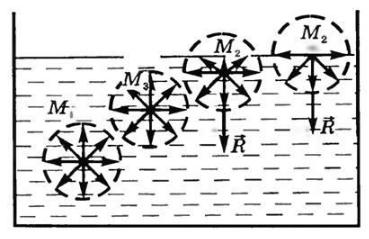
Рассмотрим систему, состоящую из жидкости и газа (рис. 4). Силы межмолекулярного взаимодействия в жидкости больше сил взаимодействия в газе. Внутри жидкости молекула (М3, Мi) окружена со всех сторон такими же молекулами. Силы взаимодействия при
этом взаимно уравновешены. |
|
И |
|
|
|
|
Д |
|
А |
|
|
Б |
|
|
Рис. 4. Межмолекулярные силы, действующие на |
||
С |
|
|
молекулы в объёме фазы и на её поверхности |
||
На молекулу, расположеннуюИ |
на поверхности (М1, М2), со сто- |
|
роны жидкости действуют силы притяжения к молекулам жидкости, а со стороны газа – намного более слабые силы притяжения к молекулам газа. Результирующая сила в этом случае будет направлена вглубь жидкости. Поверхностные молекулы стремятся быть втянутыми внутрь. Чтобы образовать межфазную поверхность, необходимо перевести часть молекул из объема жидкости на поверхность. Для этого надо совершить работу против этой результирующей силы. Чем больше результирующая сила, тем больше энергии требуется затратить. Эта энергия сосредоточивается в молекулах, находящихся на поверхности, и называется поверхностной энергией.
Поверхностным натяжением называется работа по образованию единицы площади поверхности раздела фаз. Полезную работу по
33
образованию единицы площади поверхности системы определяет изменение энергии Гиббса:
G = S, |
(1) |
где G – изменение свободной энергии Гиббса при образовании единицы площади поверхности раздела фаз, кДж/моль;– поверхностное натяжение, кДж/м2;
S – изменение площади границы раздела фаз, м2.
С ростом температуры поверхностное натяжение уменьшается:
т = о – (Т – То), |
(2) |
где = 0,1 мДж/м2 К. |
|
Так как самопроизвольно идут процессы с уменьшением энергии Гиббса, следовательно, система будет стремиться к самопроизвольному уменьшению площади поверхности раздела фаз. Поэтому, например, капля жидкости стремиться принятьИшарообразную форму.
Твердые вещества из-за прочных связей не могут самопроизвольно уменьшать площадь поверхности раздела фаз. з уравнения (1) видно,
лекул или ионов и удерживания их на поверхностиД . При этом равнодействующая, направленная внутрьБобъема, будет уравновешиваться силами взаимодействия с удерживаемыми молекулами или ионами.
что второй путь уменьшения энергии Гиббса – снижение поверхностного натяжения. Это возможно за счет Апритяжения из окружающей среды мо-
И3.3. Процесс адсорбции
Самопроизвольный процесс концентрирования веществ на границе раздела фаз называется адсорбцией. То есть при адсорбции молекул или ионов на поверхности твердого тела поверхностное натя-
жение снижается. |
|
КонденсированнаяС |
фаза, на поверхности которой происходит кон- |
центрирование веществ, называется адсорбентом. Вещества, которые адсорбент притягивает и удерживает на своей поверхности, называются адсорбатом. Процесс, обратный адсорбции, называют десорбцией.
Количественной мерой адсорбции является избыток адсорбированного вещества, равный разности концентрации вещества в поверх-
ностном слое и в объеме раствора. |
V |
|
|
|
Г |
cs c |
|
|
|
i i |
|
, |
(3) |
|
S |
|
|||
|
|
|
|
|
где Г – величина адсорбции, моль/м2;
34
cis – молярная концентрация адсорбата в поверхностном слое, моль/дм3; ci – молярная концентрация адсорбата в объеме жидкой или газооб-
разной фазы, моль/дм3;
V – объём жидкой или газообразной фазы, из которой происходит адсорбция, дм3;
S– площадь адсорбента, м2.
Взависимости от природы адсорбционных сил адсорбция может быть физической и химической.
Физическая адсорбция обусловлена силами межмолекулярного взаимодействия. В зависимости от полярности молекул адсорбента и адсорбата возникают ориентационное, индукционное и дисперсион-
ное взаимодействия.
Особенности физической адсорбции: И 1. Обратимость. Процессу адсорбции соответствует процесс де-
сорбции. Десорбция обусловлена тепловым движением молекул. По своей природе молекулы веществ, выделяемыеДс поверхности адсорбента, идентичны молекулам адсорбата, участвующим в процессе адсорбции.
2. Малая специфичность. ФизическаяА адсорбция практически не зависит от химической природы веществ. Имеет значение полярность адсорбента и адсорбата. НаБполярных адсорбентах легче адсорбируются полярные вещества, на неполярных – неполярные.
3. НезначительнаяИтеплота адсорбции. При адсорбции выделя-
ется всего 8 – 40 кДж/моль, то есть теплота физической адсорбции
соизмерима с теплотой конденсации.
4. ФизическаяСадсорбция – экзотермический процесс, поэтому с увеличением температуры адсорбция уменьшается, усиливается скорость десорбции.
Химическая адсорбция (хемосорбция) возникает в результате химической реакции между адсорбентом и адсорбатом. При этом происходит образование нового поверхностного соединения. Реакция идет только на поверхности адсорбента.
Особенности химической адсорбции:
1. Необратимость. При десорбции с поверхности адсорбента выделяется новое поверхностное соединение, по своей химической природе отличное от молекул адсорбата.
2. Специфичность. Адсорбция происходит только тогда, когда возможно протекание химической реакции, то есть хемосорбция зависит от природы адсорбата и адсорбента.
35

3.Высокая теплота адсорбции, которая может достигать 800 – 1000 кДж/моль, то есть сопоставима с тепловыми эффектами химических реакций.
4.Повышение температуры приводит к увеличению хемосорб-
ции, так как по правилу Вант-Гоффа увеличение температуры приводит к увеличению скорости химической реакции.
Зависимость адсорбции от равновесной концентрации вещества или равновесного парциального давления газа при постоянной темпе-
ратуре называется изотермой адсорбции.
Уравнение зависимости величины адсорбции от поверхностного
натяжения предложил американский ученый Дж. Гиббс:
Г |
|
|
ci |
|
d |
|
|
|
i |
RT |
dci , |
И |
|
||||
|
|
|
|
|||||
|
|
|
|
(4) |
||||
|
|
|
|
|
|
|
|
|
где Гi – величина адсорбции i-го компонента; |
|
|||||||
сi – молярная концентрация этого компонента в растворе; |
|
|||||||
|
|
|
|
|
Д |
|
||
Т – температура, при которой происходит адсорбция; |
|
|||||||
R – универсальная газовая постоянная; |
|
|
||||||
d – изменение поверхностного натяжения раствора при единичном |
|
dc |
|
i |
|
изменении концентрации. |
|
Очевидно, что снижение поверхностного натяжения сопровож- |
|
дается ростом адсорбции. |
А |
Существует несколько теоретических подходов к количественно- |
|
му описанию зависимостиБвеличины адсорбции от концентрации или |
|
парциального СдавленияИадсорбата. Для разбавленных растворов (или для газовых смесей с незначительным парциальным давлением адсор-
бата) применима теория мономолекулярной адсорбции Ленгмюра.
Основные положения этой теории для адсорбции на границе «жидкость – газ» следующие:
1)адсорбция мономолекулярная, то есть на поверхности адсорбента (границе раздела двух фаз) образуется только один слой молекул адсорбата;
2)скорости адсорбции и десорбции равны. Константа адсорбционного равновесия равна
K kадс , kдес
где kадс – константа скорости адсорбции; kдес – константа скорости десорбции.
36

Если адсорбция происходит на поверхности твердого тела, то должны выполняться следующие условия:
1)адсорбция происходит на адсорбционных центрах. Все адсорбционные центры равноценны;
2)одна молекула адсорбата взаимодействует с одним адсорбционным центром;
3)молекулы адсорбата не взаимодействуют между собой. Уравнение изотермы Ленгмюра имеет вид
Г Г |
|
К с |
, |
(5) |
|
1 К с |
|||||
|
|
|
|||
где Г∞ – предельная адсорбция; |
|
|
|
|
|
Г – адсорбция при концентрации с; |
|
|
|||
К – константа равновесия процесса адсорбции. |
|
||||
|
|
|
И |
|
|
Предельной адсорбцией называют такую величину адсорбции, которая соответствует полному заполнению поверхности адсорбента
|
|
|
|
Д |
|
молекулами адсорбата. Вид изотермы адсорбции приведен на рис. 5. |
|||||
На изотерме можно вы- |
|
|
|||
делить три участка: |
|
А |
|||
1) прямая линия, выходя- |
|||||
|
|
||||
щая из начала координат. При |
|
|
|||
|
|
Б |
|
||
малых концентрациях К·с < 1; |
|
|
|||
1+К·с ≈ 1 и Г = Г∞·К·с; |
|
|
|
||
|
И |
|
|
||
2) соответствует |
криво- |
|
|
||
линейной части |
графика и |
|
|
||
С |
|
|
|
||
описывается полным |
уравне- |
|
|
||
нием Ленгмюра; |
|
|
|
|
|
3) соответствует |
прямой, |
|
|
||
параллельной оси абсцисс, что |
Рис. 5. Изотерма мономолекулярной адсорбции |
||||
означает, что адсорбция достигла |
|
|
|||
своего предела. |
При |
высоких |
значениях концентрации К·с >> 1; |
||
1+К·с ≈ К·с. Следовательно, Г = Г∞.
Для того чтобы найти постоянные в уравнении Ленгмюра, его следует привести к линейной форме. Для этого найдем выражение для
величины, обратной избыточной адсорбции: |
|
||||||
1 |
|
1 |
|
1 |
. |
(6) |
|
|
|
Г К с |
|
||||
|
Г |
|
|
Г |
|
||
37
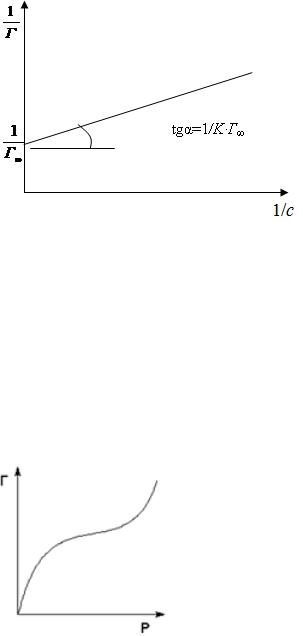
Построим график зависимости 1/Г от 1/с (рис. 6). Тангенс угла наклона прямой к оси абсцисс будет равен величине, обратной предельной адсорбции, умноженной на константу равновесия:
tg |
1 |
. |
(7) |
|
|
||||
Г К |
||||
|
|
|||
|
|
|
Рис. 6. Приведение изотермы адсорбции к линейному виду
Отрезок, отсекаемый прямой на оси ординат, будет равен вели-
чине, обратной предельной адсорбции: |
|
||
Z |
1 |
. |
(8) |
|
|||
|
Г |
|
|
А |
|
||
Уравнение мономолекулярной адсорбцииИЛэнгмюра позволяет на ос- |
|||
нове экспериментальных данных определить величину удельной поверхно- |
|||||
сти адсорбента – одну из важнейших характеристикДпористых материалов. |
|||||
|
|
S |
уд |
S Г Na, |
(9) |
|
И |
0 |
|
||
|
|
|
|
||
|
где Г |
– предельная адсорбция; Nа – число Аво- |
|||
|
гадро; S0 – площадь, занимаемая одной молеку- |
||||
|
лой (примерноБравна 0,3 нм2). |
|
|||
С |
В реальной жизни адсорбция не ограни- |
||||
|
|
||||
|
чивается образованием одного слоя адсорбата, |
||||
|
одновременно происходит формирование второ- |
||||
|
го, третьего слоя и т.д. Такой вид адсорбции на |
||||
Рис. 7. Изотерма |
зывавают полимолекулярной. Изотерма полимоле- |
||||
полимолекулярной |
кулярной адсорбции имеет вид, изображенный на |
||||
адсорбции |
рис. 7. |
|
|
|
|
38
Лабораторная работа № 5
ИЗУЧЕНИЕ АДСОРБЦИИ НА ГРАНИЦЕ «РАСТВОР – ТВЁРДЫЙ АДСОРБЕНТ»
Цель работы: определить удельную площадь твердого адсорбента.
Оборудование и материалы: колбы конические объёмом 250 см3 с пробками, цилиндр объёмом 100 см3, мерные пипетки объёмом 10 см3, растворы уксусной кислоты разной концентрации, 0,1 Н раствор гидроксида натрия NaOH, навески угля активированного по 1 г, индикатор фенолфталеин.
|
Ход работы |
И |
|
|
|
|
Д |
|
Опыт 1. Определение концентрации исходных растворов ук- |
||
сусной кислоты. |
А |
|
Взять три раствора уксусной кислоты неизвестной концентрации. Из
каждой ёмкости с кислотой отобрать в три конические колбы по 10 см3 кислоты, добавить по 50 см3 дистиллированной воды, по две капли фенолфталеина и оттитровать каждую колбу 0,1 Н раствором NaOH до появления устойчивой розовой окраски. Результаты титрования занести в табл. 7. Рассчитать концентрации исходных растворов кислот по формуле
где СНАс – концентрацияИраствора уксусной кислоты, моль/дм3; СNaOH – концентрация раствора NaOH, моль/дм3;
С |
C |
CNaOH |
VNaOH |
, |
(10) |
|
|
|
|
||||
БHAc |
VHAc |
|
|
|||
|
|
|
||||
|
|
|
|
|
||
VNaOH – объём раствора NaOH, пошедший на титрование кислоты, см3; VHАс – объём аликвоты кислоты, взятый для анализа, см3.
|
|
|
|
|
|
|
|
|
Таблица 7 |
|
Результаты титрования уксусной кислоты до и после адсорбции |
||||||||
|
|
|
|
|
|
|
|
|
|
Номер |
Объём |
Объём NaOH, по- |
Исходная |
Объём NaOH, |
Равновесная |
||||
колбы |
уксусной |
шедший на титро- |
концентра- |
пошедший на |
концентрация |
||||
|
кислоты |
вание кислоты до |
ция кислоты |
титрование после |
кислоты после |
||||
|
V, мл |
адсорбции V, мл |
С0,моль/л |
адсорбции V, мл |
адсорбции С, |
||||
|
|
1 |
2 |
3 |
|
1 |
2 |
3 |
моль/л |
1 |
10 |
|
|
|
|
|
|
|
|
2 |
10 |
|
|
|
|
|
|
|
|
3 |
10 |
|
|
|
|
|
|
|
|
39
Опыт 2 .Адсорбция уксусной кислоты на активированном угле.
В три конические колбы объёмом 250 см3 налить по 50 см3 исходных растворов уксусной кислоты. В каждую колбу внести по 1 г активированного угля. Закрыть колбы пробками и энергично встряхивать в течение 30 мин. Затем отфильтровать растворы через бумажный фильтр в чистые сухие колбы. После окончания фильтрования колбы с фильтратом закрыть пробками для предотвращения потерь уксусной кислоты. Из каждой колбы с фильтратом отобрать в три чистые конические колбы по 10 см3 фильтрата, добавить по 50 см3 дистиллированной воды и по две капли фенолфталеина. Оттитровать кислоту 0,1 Н раствором гидроксида натрия. Результаты записать в табл. 7. Рассчитать концентрацию кислоты в каждой колбе после ад-
сорбции по формуле (10). |
|
|
И0 |
|
0 |
|
|
|
|
Рассчитать величину удельной адсорбции по формуле |
||||
|
Г |
C C0 |
V |
|
|
|
0 |
, |
|
|
|
m |
Д |
|
|
|
|
|
|
где С0 |
и С – концентрации уксусной кислоты до и после адсорбции; |
|||
|
|
А |
|
|
V – объём кислоты, взятый для адсорбции, V = 50 см3; |
||||
m – масса навески активированного угля, равная 1 г. |
||||
|
Б |
|
|
|
Рассчитать логарифмы lgГ и lgC. Построить график зависимости
lgГ от lgC. Найти из графика величину предельной адсорбции Г∞ и вычислить удельную площадь поверхности адсорбента по формуле (9). Сделать вывод по результатам работы.
КонтрольныеИ вопросы и задания
1. Какой процесс называется адсорбцией?
2. Дайте определение таким понятиям, как «адсорбент» и «адсорбат».
С
3. Напишите уравнение Гиббса для изотермы адсорбции, поясните смысл величин, входящих в него.
4. Назовите отличительные признаки физической и химической адсорбции.
5. Сформулируйте основные положения теории мономолекулярной адсорбции Ленгмюра. Напишите уравнение мономелекулярной адсорбции Ленгмюра.
6. Как экспериментально можно определить удельную площадь поверхности адсорбента?
40
