
- •ВВЕДЕНИЕ
- •1. ТЕРМОХИМИЯ И ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
- •1.1. Термохимия
- •1.2. Химическая термодинамика
- •1.3. Первый закон термодинамики
- •1.4. Энтропия
- •2. ХИМИЧЕСКАЯ КИНЕТИКА И РАВНОВЕСИЕ
- •2.1. Основные понятия химической кинетики
- •2.2. Влияние различных факторов на скорость химической реакции
- •2.3. Механизм химической реакции. Каталитические реакции
- •2.4. Химическое равновесие
- •3. РАВНОВЕСИЕ В ГЕТЕРОГЕННЫХ СИСТЕМАХ
- •3.2. Особые свойства поверхностных молекул
- •3.3. Процесс адсорбции
- •4. ОБЩИЕ СВОЙСТВА РАСТВОРОВ
- •4.1. Истинные растворы. Растворимость
- •5.2. Классификация окислительно-восстановительных реакций
- •6. ГАЛЬВАНИЧЕСКИЙ ЭЛЕМЕНТ
- •6.1. Электрохимические системы
- •6.2. Устройство гальванического элемента
- •6.3. Концентрационный гальванический элемент
- •7. КОРРОЗИЯ МЕТАЛЛОВ И СПЛАВОВ
- •7.1. Понятие о коррозии и её виды
- •7.3. Электрохимическая коррозия
- •7.4. Влияние различных факторов на скорость коррозии
- •7.5. Защита металлов от коррозии
- •8.1. Понятие об электролизе. Законы Фарадея
- •8.2. Электролиз расплавов электролитов
- •8.4. Растворимые и нерастворимые аноды
- •9.ХИМИЧЕСКИЕ СВОЙСТВА МЕТАЛЛОВ
- •9.1. Положение металлов в периодической таблице
- •9.2. Физические свойства металлов
- •9.3. Химические свойства металлов
- •11.ОРГАНИЗМ И СРЕДА. ЭКОЛОГИЧЕСКИЕ ФАКТОРЫ
- •11.1. Понятие о среде обитания и экологических факторах
- •11.3. Биотические факторы
- •11.4. Лимитирующий фактор
- •11.5. Виды адаптации
- •12.1. «Парниковый» эффект
- •12.2. «Озоновые дыры»
- •12.3. Кислотные осадки
- •12.4. Энергетический кризис
- •12.5. «Демографический взрыв» и продовольственная проблема
- •12.6. Сокращение биоразнообразия
- •13.1. Нормирование качества окружающей природной среды
- •13.2.Нормативы качества окружающей среды
- •13.3. Нормативы допустимого воздействия на окружающую среду
- •13.4. Экологический мониторинг
- •14.3. Экозащитная техника и технологии
- •Библиографический список
- •Приложение 1
- •Приложение 2
- •Приложение 3
- •Приложение 4
менение энтальпии системы Q = H. Единицы измерения энтальпии такие же, как внутренней энергии и теплового эффекта – кДж/моль.
Тепловой эффект химической реакции при постоянном объеме (V = const,
изохорные условия) равен изменению внутренней энергии системы:
Q U P V U .
Тепловой эффект химической реакции при постоянном давлении (Р = const, изобарные условия) равен изменению энтальпии системы, но имеет противоположный знак.
Так как энтальпия является функцией состояния термодинамической системы, то ее изменение может быть вычислено по формуле
H хим. р H 0f ,конечн .прод Н 0f ,исходн.в в . |
|
Очевидно, что это уравнение совпадает с математическим вы- |
|
|
И |
ражением для первого следствия из закона Гесса. |
|
Д |
|
1.4. Энтропия |
|
Большинство экзотермических реакций идут самопроизвольно, но |
|
А |
|
некоторые эндотермические реакции также могут идти самопроизволь- |
|
но. Из этого следует, что знание теплового эффекта химической реакции, изменения энтальпииБв ходе химического процесса не является достаточным для решения вопроса о возможности самопроизвольного протекания реакции. И
В термодинамике в 1865 г. физиком Р. Клаузисом была введена еще одна функция состояния термодинамической системы, характеризующая меруСнеобратимого рассеивания энергии, – энтропия.
Энтропию определяют еще как степень неупорядоченности термодинамической системы, как меру вероятности осуществления какоголибо макроскопического состояния.
Связь энтропии с вероятностью какого-либо состояния установил в 1877 г. Л. Больцман, а М. Планк предложил вычислять энтропию через величину термодинамической вероятности:
S k lnW ,
где k = 1,38·10-23 Дж/К – постоянная Больцмана;
W – термодинамическая вероятность, или статистический вес состояния, который показывает, каким числом микросостояний может быть выражено одно макросостояние.
Энтропия из расчета на 1 моль вещества вычисляется как
S k NA ln W R ln W ,
8
где NA – число Авогадро, NA = 6,02·1023 молекул/моль;
R – универсальная газовая постоянная, R = 8,31 Дж/моль·К. Единицы измерения энтропии – Дж/моль К.
Второй закон термодинамики утверждает, что в изолированных системах самопроизвольно могут идти только те процессы, в которых
энтропия увеличивается.
М. Планк сформулировал и третий закон термодинамики, ко-
торый утверждает, что для идеального кристалла при температуре абсолютного нулю энтропия будет равна нулю.
Так как энтропия является функцией состояния, она может быть вычислена как разность энтропий конечных продуктов и исходных веществ:
Sхим. р Sконечн.прод Sисх.в в.
Энтропия системы зависит от температуры, от строения молекул,
пия уменьшается, так как под действием давленияИмолекулы имеют меньше шансов на независимое движениеА. Чем больше атомов входит
от внешнего давления, от агрегатного состояния вещества. С ростом
температуры энтропия увеличивается, так как возрастает число степе-
Д ше энтропия вещества. С переходомБот кристаллического твердого ве-
ней свободы для молекул. С повышением давления, наоборот, энтро-
в состав молекулы, чем более подвижны связи между ними, тем боль-
щества к аморфному, от аморфного – к жидкому, от жидкого – к газообразному энтропия возрастает, так как уменьшается число связей между молекулами, ониИмогут перемещаться независимо друг от друга.
1.С5. зобарно-изотермический потенциал
Использовать величину энтропии для определения возможности самопроизвольного протекания процессов можно только для изолированных систем. В жизни большинство систем не являются изолированными. Самопроизвольное протекание процессов в изобарно-изотермических условиях (Р = const и Т = const) определяется двумя факторами: энтальпийным, связанным с выделением тепла, и энтропийным, обусловленным увеличением беспорядка в системе. Разность этих факторов и называется
изобарно-изотермическим потенциалом, или энергией Гиббса:
G H T S .
Второй закон термодинамики утверждает, что в закрытой сис-
теме самопроизвольно проходят только те реакции, в которых энер-
гия Гиббса уменьшается.
9
Если реакция экзотермическая H < 0, в ходе реакции энтропия системы увеличивается S > 0, то при любых значениях температуры G < 0, то есть всегда идет прямая реакция. Обратная реакция само-
произвольно протекать не может.
Если реакция экзотермическая H < 0, в ходе реакции энтропия системы уменьшается S < 0, то G < 0 только при низких температурах, когда Т < Травн. При невысоких температурах возможен самопроизвольный прямой процесс, а при высоких температурах (выше равновесной) пойдет самопроизвольно обратная реакция.
Если реакция эндотермическая H > 0, но сопровождается ростом энтропии S > 0, то G < 0 и самопроизвольный прямой процесс возможен только при высоких температурах (выше равновесной). При низ-
ких температурах будет проходить самопроизвольно обратная реакция. |
||
|
|
И |
Если реакция эндотермическая H > 0 и сопровождается умень- |
||
шением энтропии S < 0, при любых температурах G > 0, то есть |
||
|
Д |
|
самопроизвольное протекание прямого процесса невозможно. В лю- |
||
бых условиях самопроизвольно будет идти обратная реакция. |
||
А |
|
|
Если преобразовать выражение для энергии Гиббса, то получим, что |
||
H G T S , |
|
|
Б |
|
|
то есть тепло, выделяющееся в ходе реакции, частично может быть |
||
превращено в полезную работу (ΔG), а часть тепла теряется в результате необратимого рассеивания в окружающую среду (энтропийный фактор Т· S). ИменноИпоэтому энергию Гиббса еще называют свободной энергией. Единицы измерения энергии Гиббса – кДж/моль.
Так как Сэнергия Гиббса – функция состояния термодинамической системы, то и вычислена она может быть как разность значений для конечного и начального состояний:
Gхим. р Gконечн.прод Gисх.в в.
Чем меньше значение изменения энергии Гиббса, тем выше вероятность протекания химической реакции или процесса. Если для какого-либо вещества при взаимодействии его с компонентами окружающей среды G > 0, то такое вещество будет неустойчиво в данных условиях, например, будет подвергаться коррозии, окисляться, разлагаться и т.п. Если для какого-либо процесса G ≈ 0, то равновероятны и прямая, и обратная реакции. Система находится в состоянии химического равновесия.
10
Лабораторная работа № 1
ОПРЕДЕЛЕНИЕ ТЕПЛОВЫХ ЭФФЕКТОВ ХИМИЧЕСКИХ РЕАКЦИЙ
Цель работы: научиться определять тепловые эффекты химических реакций.
Оборудование и материалы: калориметрическая установка (термос объёмом 200 см3), термометр с ценой деления 0,1 оС, стеклянная воронка, лабораторная мешалка, мерный цилиндр объёмом 200 см3, хлорид аммония (твердый), 0,2 Н раствор щелочи (NaOH),
5 Н раствор хлороводородной кислоты (HCl), дистиллированная вода. |
|||||
|
Ход работы |
И |
|||
|
|
|
|
Д |
|
Опыт 1. Определение постоянной калориметра. |
|||||
|
|
А |
|
||
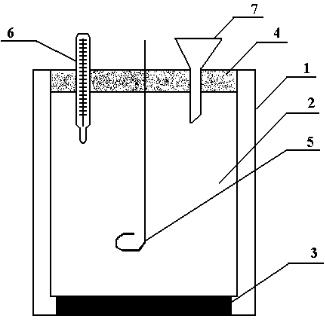
Калориметрическая установка изображена на рис. 1. |
|||||
Во внутренний стакан на- |
|
|
|
||
лить мерным цилиндром 200 см3 |
|
|
|
||
|
Б |
|
|
||
дистиллированной воды, закрыть |
|
|
|
||
стакан крышкой и погрузить в во- |
|
|
|
||
И |
|
|
|
|
|
ду термометр так, чтобы ртутный |
|
|
|
||
шарик находился в средней части |
|
|
|
||
С |
|
|
|
|
|
жидкости. Провести предвари- |
|
|
|
||
тельный период опыта. Для этого |
|
|
|
||
включить мешалку и записывать |
|
|
|
||
показания термометра через каж- |
|
|
|
||
дые 30 с. Запись вести в течение |
|
|
|
||
5 мин. Для отсчета времени |
|
|
|
||
удобнее пользоваться |
секундо- |
|
|
|
|
мером. Результаты опыта запи- |
|
|
|
||
сать в табл. 1. |
|
|
|
|
|
Затем провести главный пе- Рис.1. Схема калориметрической установ- |
|||||
риод. Для этого, не останавливая |
новки: 1 – наружный стакан; 2 – реакцион- |
||||
секундомера, открыть |
отверстие |
оный стакан; 3 – подставка; 4 – крышка, 5 – |
|||
для внесения навески, быстро вы- |
|
мешалка; 6 – термометр; 7 – воронка |
|||
сыпать точно взвешенную заранее |
|
|
|
||
11
навеску соли (хлорид аммония) в количестве 5…6 г, отверстие закрыть. При этом продолжать постоянное перемешивание раствора. Показания термометра записывать через каждые 30 с. Главным периодом считают промежуток времени, в течение которого наблюдается резкое изменение температуры.
Таблица 1
Изменение температуры в ходе определения константы калориметра
Время от начала опыта, мин
Температура, °С
Заключительный период продолжается 5 мин после главного периода, причем температуру записывать также через каждые 30 с.
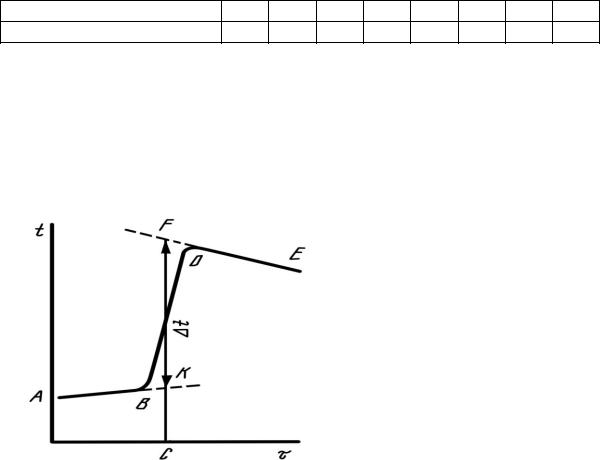
Результаты наблюдений записать в табл. 1, затем на основании полученных данных на миллиметровой бумаге построить график t = f ( ) для определения действительного изменения температуры при рас-
творении соли (рис. 2). Затем определить t1. |
|
||||
|
|
|
|
И |
|
|
|
|
|
|
При графическом опре- |
|
|
|
делении t1 на миллиметровой |
||
|
|
|
Д |
||
|
|
|
бумаге на оси абсцисс отло- |
||
|
|
|
жить время в масштабе: 1 мин |
||
|
|
А |
|
|
|
|
Б |
соответствует 1 см; на оси ор- |
|||
|
динат – температуру, выбор |
||||
|
масштаба которой зависит от |
||||
И |
|
величины t1. Если t1 1 °С, |
|||
|
то 1 °С соответствует 10 см; |
||||
|
|
|
|
||
С |
|
|
если t1 1 °С, то 1 °С соот- |
||
|
|
ветствует 5 см. После того, как |
|||
|
|
на график нанесены все экспери- |
|||
Рис. 2. График для определения |
|
||||
действительного изменения температуры |
ментальные точки, получается |
||||
в ходе опыта |
|
|
кривая АВDЕ. Участок АВ со- |
||
|
|
|
ответствует начальному пе- |
||
риоду, ВD – главному периоду, DЕ – заключительному.
Чтобы определить изменение температуры, не искаженное тепловым обменом, происходящим в течение главного периода, линии АВ и DЕ экстраполировать. Время главного периода разделить пополам (точка С). Из точки С восстанавить перпендикуляр до пересечения с обеими продолженными прямыми. Отрезок между точками К и
12
F, выраженный в градусах, покажет истинное изменение температурыt1, вызываемое процессом, с учетом поправки на теплообмен.
Растворение соли (хлорида аммония) протекает с поглощением теплоты. В соответствии с тепловым балансом количество теплоты, расходуемой на растворение хлорида аммония, равно количеству теплоты, отнимаемой от калориметра:
qКАЛ = К · t1 = qРАСТВ,
где qКАЛ – количество тепла, необходимое для нагревания калориметра; К – постоянная калориметра;
t1 – изменение температуры, определенное по рис. 2; qРАСТВ – теплота растворения соли, кДж.
К = qРАСТВ/ t1;
qРАСТВ = QРАСТВ.СОЛИ ·νСОЛИ или
К = (QРАСТВ.СОЛИ · mСОЛИ ) / ( t1 · МСОЛИ),
– тепловой эффект растворения 1 моля соли, при котором
QРАСТВ.СОЛИ (∆НРАСТВ.СОЛИ) определить поДсправочным данным (прил. 1 «Интегральная теплота растворения солей в воде при 25 °С»). QРАСТВ.СОЛИ
образуется раствор с моляльной концентрацией Ст, кДж/моль;
νСОЛИ – количество моль соли; |
А |
И |
|
mСОЛИ – навеска соли, г; |
|||
|
|||
МСОЛИ – молярная масса соли, г/моль. |
|
||
Б |
|
||
зависит от моляльной концентрации Cm раствора соли. Чтобы найти в
таблице нужное значение ∆НРАСТВ.СОЛИ, необходимо рассчитать моляль-
ную концентрацию получаемого раствора. Моляльная концентрация Cm показывает, сколько молей растворенного вещества νр.в приходится на 1 кг растворителя mр-ля:
И |
р.в |
|
mр.в |
1000 |
||
Cm |
|
|
|
|
|
, |
|
|
|
|
|||
С |
mр ля |
|
М р.в тр ля |
|||
где Cm – моляльная концентрация раствора, моль/кг растворителя; νр.. – количество молей растворенного вещества, моль;
mр-ля – масса растворителя, г;
mр.в – масса растворенного вещества, г;
Мр.в – молярная масса растворенного вещества, г/моль.
Опыт 2. Определение теплового эффекта реакции нейтрализации сильной кислоты сильным основанием.
В чистый внутренний стакан калориметра налить 200 см3 0,2 Н раствора щелочи. Закрыть калориметр крышкой и провести предвари-
13

тельный период, как описано в опыте 1. По окончании предварительного периода на шестой мин в калориметр осторожно вылить кислоту (10 мл 5 Н НСl), провести главный период, а затем заключительный, как описано в опыте 1. Результаты опыта занести в табл. 2, а затем построить график для нахождения t2.
Таблица 2
Изменение температуры в ходе определения теплоты нейтрализации
Время от начала опыта, мин
Температура, °С
Исходя из полученных значений t2 и постоянной калориметра,
лизации в расчете на 1 моль-эквивалент вещества. Расчет проводить по количеству щелочи, т.к. кислота берется в избытке.
определённой в опыте 1, вычислить тепловойИэффект реакции нейтра-
ствие процесса, протекающего в калориметре, рассчитывается по уравнению
Тепловой эффект, связанный с изменениемД температуры вслед-
qНЕЙТР = К · t2,
где qНЕЙТР – теплота нейтрализации, кДж;
К – постоянная калориметра, найденная в опыте 1;
|
И0 |
|
t2 – изменение температуры в ходеАопыта, определенное по графику. |
||
Далее количество теплоты, выделяющейся в процессе нейтрали- |
||
зации, пересчитать на 1 мольБщелочи: |
||
|
|
QНЕЙТР = qНЕЙТР/ νЩЕЛ; |
|
|
νЩЕЛ = СЩЕЛ·VЩЕЛ; |
|
|
– ∆H НЕЙТР, 298 =QНЕЙТР, |
где QНЕЙТР – тепловой эффект реакции нейтрализации 1 моля щёлочи, |
||
кДж/моль; |
С |
|
νЩЕЛ – количество щелочи, взятое в опыте, моль; СЩЕЛ – молярная концентрация раствора щёлочи, моль/дм3; VЩЕЛ – объём раствора щёлочи, дм3;
∆H0НЕЙТР, 298 – энтальпия нейтрализации, кДж/моль. Сделать вывод о проделанной работе.
14
Контрольные вопросы и задания
1.Что такое тепловой эффект реакции? При каких условиях тепловой эффект химической реакции численно равен изменению энтальпии?
2.При каких условиях тепловой эффект химической реакции численно равен изменению внутренней энергии системы?
3.Тепловой эффект какой реакции называется энтальпией нейтрализации?
4.Что называется стандартной энтальпией (теплотой) образования соединения? Для какого вещества стандартная энтальпия образо-
вания равна нулю: а) Н2О2; б) Н2SO4; в) О2; г) СаСО3; д) О3?
5. Составьте уравнение химической реакции, тепловой эффект которой равен энтальпии образования силиката магния.
6. При взаимодействии 2,1 г железа с ромбической серой выделилось 3,77 кДж теплоты. Вычислите энтальпию образования сульфида железа (II).
7. Какое количество теплоты выделится (поглотится) при рас-
творении 8,0 г NH4NO3 |
в 250 см3 воды? ля решения задачи исполь- |
|
|
|
И |
зуйте данные прил. 1 «Интегральная теплота растворения солей в во- |
||
де при 25°С». |
Д |
|
|
||
Лабораторная работа № 2 |
||
|
А |
|
Цель работы: научиться определять с использованием термодинамических характеристик реагирующих веществ вероятность самопроизвольного протекания химических реакций.
ОПРЕДЕЛЕН Е ВОЗМОЖНОСТИ САМОПРОИЗВОЛЬНОГО |
|
|
Б |
ПРОТЕКАН Я ХИМИЧЕСКОЙ РЕАКЦИИ |
|
И |
|
С |
|
Оборудование и материалы: калькулятор, химические пробирки, 0,5 Н растворы Fe2(SO4)3, KI, 2 Н раствор H2SO4, тв. MnO2, раствор крахмала. Для расчетов необходимо использовать прил. 2.
Ход работы
Расчетная часть. Студентам по вариантам выдается задание (табл. 3). Выписав из прил. 2 значения стандартных энтальпий образования и энтропий для веществ, участвующих в реакции, студенты
15
должны вычислить изменение энергии Гиббса в стандартных условиях и сделать вывод о возможном протекании химической реакции.
Таблица 3
Задания для определения возможности самопроизвольного протекания химической реакции
№ варианта |
|
Термохимическое уравнение |
||
1 |
ZnO(к) + CO(г) = Zn(к) + CO2(г) |
|
||
2 |
2NO(г) + O2(г) = 2NO2(г) |
|
||
3 |
2CO2(г) = 2CO(г) + O2(г) |
|
|
|
4 |
2CO(г) + 2NO(г) = 2CO2(г) + N2(г) |
|
||
5 |
FeO(к) + CO(г) = CO2(г) + Fe(к) |
|
||
6 |
CO(г) + 2H2(г) = CH3OH(ж) |
|
||
7 |
NH3(г) + HCl(г) = NH4Cl(г) |
|
||
8 |
H2(г) + CO2(г) = CO(г) + H2O(ж) |
И |
||
9 |
CO2(г) + 4H2(г) = CH4(г) + 2H2O(ж) |
|
||
10 |
2H2S(г) + 3O2(г) = 2H2O(ж) + 2SO2(г) |
|
||
11 |
2Al(к) + 3FeO(к) = 3Fe(к) + Al2O3(к) |
|
||
12 |
4HCl(г) + O2(г) = 2H2O(ж) + 2Cl2(г) |
|
||
|
|
|
А |
|
13 |
Fe2O3(к) + 3H2(г) = 2Fe(г) + 3H2O(г) |
|
||
14 |
CO(г) + 3H2(г) = CH4(г) + H2O(г) |
|
||
|
|
Б |
|
|
15 |
Fe2O3(к) + 3C(графит) = 2Fe(г)Д+ 3CO(г) |
|||
16 |
4NH3(г) + 5O2(г) = 6H2O(г) + 4NO(г) |
|
||
17 |
8Al(к) + 3Fe3O4(к) = 9Fe(к) + 4Al2O3(к) |
|||
|
И |
|
|
|
18 |
Fe2O3(к) + 3CO(г) = 2Fe(к) + 3CO2(г) |
|
||
19 |
PbO2(к) + Pb(к) = 2PbO(к) |
|
||
|
С |
|
|
|
20 |
2Ca(к) + CO2(г) = 2CaO(к) + C(графит) |
|||
21 |
C2H5OH(ж) + 3,5O2(г) = 2CO2(г) + 3H2O(ж) |
|||
22 |
4NH3 (г) + 3O2(г) = 2N2(г) + 6H2O(ж) |
|
||
23 |
2Ca3(PO4)2(к) + 6SiO2(к) + 5C(гр) = 6CaSiO3(к) + 4P(кр) + 5CO2(г) |
|||
24 |
4CO(г) + 2SO2(г) = 2S(к) + 4CO2(г) |
|
||
25 |
WO3(к) + 3C(гр) = W(к) + 3CO(г) |
|
||
Экспериментальная часть: определить, в каком направлении возможно самопроизвольное протекание химической реакции, подтвердить это экспериментально.
Для приведенных ниже реакций выписать из прил. 2 значения стандартных энтальпий образования и энтропий:
а) Fe2(SO4)3(р-р) + KI(р-р) → FeSO4(р-р) + I2(т) + K2SO4(р-р);
б) MnO2(т) + KI(р-р) + H2SO4(р-р) → MnSO4(р-р) + I2(т) + K2SO4(р-р) + H2O(ж).
16
Рассчитать изобарно-изотермический потенциал этих реакций в стандартных условиях. Сделать вывод о возможности протекания реакций в стандартных условия.
Провести указанные выше реакции экспериментально. Для этого в первую пробирку налить 2 см3 раствора Fe2(SO4)3, к нему добавить такое же количество раствора KI. В другую пробирку налить 2 см3 раствора KI и такое же количество раствора серной кислоты. Добавить к полученной смеси немного твердого диоксида марганца MnO2. Наблюдается ли выделение йода? Совпадают ли результаты опыта с расчетами? Чтобы доказать образование или отсутствие йода, добавить к растворам 1…2 капли раствора крахмала. Если в пробирке произошло образование йода, раствор окрасится в темно-синий цвет.
Сделать вывод по проведенной работе.
1.Что изучает химическая термодинамикаДИ?
2.Какая система называетсяАтермодинамической?
3.Какими термодинамическими параметрами можно охарактеризовать термодинамическую систему?
4.Какие характеристикиБтермодинамической системы называют функциями состояния? Назовите известные вам функции состояния термодинамической Исистемы.
5.Сформулируйте первый закон термодинамики для химических систем. Что называетсяСизменением энтальпии химической реакции?
6.Что такое энтропия? Как зависит величина энтропии от внешних условий (температуры, давления) и от агрегатного состояния веществ? Приведите формулу Больцмана.
7.Как, не проводя расчетов, можно предсказать знак изменения энтропии в ходе химической реакции? Как можно вычислить изменение энтропии в ходе химической реакции?
8.Сформулируйте второй закон термодинамики для изолированных систем.
9.Что такое изобарно-изотермический потенциал? Почему энергию Гиббса называют свободной? Как можно вычислить изменение энергии Гиббса в ходе химической реакции?
10.Сформулируйте второй закон термодинамики для закрытых систем. Как влияет температура на вероятность самопроизвольного протекания различных реакций?
17
