
Александров Ю.И., Анохин К.В. - Нейрон. Обработка сигналов. Пластичность. Моделирование_ Фундаментальное руководство (2008)
.pdf13.11. Пейсмекеры коры (на примере черепахи)
Зрительные стимулы вызывают осцилляции мембранного потенциала нейронов коры. Это явление описано для нескольких видов животных (Prechtl et al., 2000). У черепахи эти осцилляции имеют форму синусоид. Такие волны могут быть следствием работы пейсмекера, который генерирует периодические импульсы возбуждения, распространяющиеся по системе возбудимой нервной ткани, или же они могут быть результатом продолжительного и, возможно, перестраиваемого фазового сдвига по нейронной системе с множеством слабо связанных нейронных осцилляторов. В работе Prechtl et al. (2000) было выполнено одновременное измерение локального полевого потенциала на разных глубинах коры. Измерения при однократном радиальном погружении показали присутствие широкополосных источников тока с центром частот около 20 Гц, который активируется при предъявлении зрительных стимулов. Спектральная когерентность между источниками на двух достаточно хорошо разделенных локусах вдоль рострально-каудальной оси показывает присутствие систематического временного различия между локализованными кортикальными осцилляторами. Эти множественные осциллирующие источники тока и их временное различие в тангенциальном плане интерпретируются как нейронная активность, которая лежит в основе волнового движения, показанного в работе.
Вызываемые стимулом осцилляции являются примечательным свойством нейронной динамики многих сенсорных систем. Например, описаны осцилляторы обонятельной системы черепахи и других животных (Lam et al., 2000). У млекопитающих осцилляции возникают не только в зрительной, но и в зрительно-моторной системе. В дальнейшем магнитуда и пространственное распространение этих осцилляций модулируются зрительными стимулами. Теоретические исследования нейронных цепей с краткими взаимодействиями показывают, что такие волны являются эмерджентным свойством системы с пространственно ограниченными связями.
13.12. Пейсмекер и дыхание
Дыхательные движения у млекопитающих регулируются паттернами ритмической активности нейронов, находящихся в пре-Больцинге- ровом комплексе ствола мозга. Центральный вопрос заключается в следующем: действительно ли ритм генерируется нейронной системой берстовых (залповых) пейсмекерных нейронов, соединенных возбудительными синапсами, которые и синхронизируют пейсмекерную ак-
410
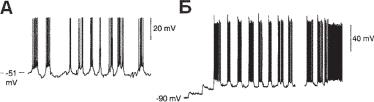
тивность. В экспериментах Koshiya and Smith (1999) при помощи каль- ций-чувствительного красящего вещества были помечены дыхательные нейроны срезов ствола мозга новорожденных грызунов. Одновременно использовались регистрация электрической активности и инфракрасное сканирование нейронов. Для идентификации и управления эффективностью синаптических связей использовали разные фармакологические вещества. Результаты показали, что частота залповой пейсмекерной активности, характерной для этих нейронов, зависит от уровня мембранного потенциала (рис. 13.32). Исследователи предполагают, что основной нейронный механизм регуляции дыхания связан с пейсмекерными нейронами, объединенными синаптическими входами.
Ðèñ. 13.32. Дыхание. Паттерны активности берстового пейсмекера в преБольцингеровом комплексе. А и Б — дыхательные пейсмекерные нейроны при деполяризации мембраны проявляют эктопические осцилляторные берсты между фазами дыхательного разряда и проявляют врожденные вольт-зависимые осциллирующие берсты при деполяризационном сдвиге мембранного потенциала (Б), когда блокируется сетевая и синаптическая передача. Пейсмекерные нейроны проявляют мультифункциональные паттерны активности (покой, залпы и разряды ПД на фоне тонических сдвигов МП). (по Christopher A. Del Negro, 1, Naohiro Koshiya, 1, 2, Robert J. Butera, JR., 3 AND Jeffrey C. Smith1 Persistent Sodium Current, Membrane Properties and Bursting Behavior of Pre-Boеtzinger Complex Inspiratory Neurons In Vitro J Neurophysiol 88: 2242–2250, 2002; 10.1152/ jn.00081.2002).
Дыхательные системы ствола мозга могут действовать во множестве функциональных состояний, обеспечивая работу различных нейронных механизмов. Эти механизмы исследовались in situ на препарате «ствол мозга — спинной мозг» крысы (Rybak et al., 2007). Использовались различные пересечения ствола мозга и введение рилузола, блокатора постоянного натриевого тока. Драматическая трансформация механизмов ритмогенеза и паттернов ритмов дыхания наблюдалась после удалении моста и последующей перерезки продолговатого мозга вниз к ростральной оконечности пре-Больцингерового комплекса. Результаты опы-
411
тов показали, что дыхательная система ствола мозга имеет пространственную организацию, распространяясь от ростральной части моста до вентральной дыхательной группы (VRG), в которой каждое функциональное отделение контролируется при помощи более ростральных отделов. Разработанная модель предсказывает континуум состояний дыхательных систем, подразумевая разный вклад врожденных свойств нейронов и синаптического взаимодействия для генерации и контроля дыхательных ритмов и паттернов.
Нейронные ритмы дыхания у млекопитающих генерируются нейронными сетями, которые расположены в стволе мозга. Тонкие мембранные и синаптические свойства составляющих их нейронов определяют механизм ритмической генерации. Пре-Ботцингеров комплекс содержит ряд дыхательных нейронов, которые проявляют осцилляторное берстовое поведение — это пейсмекерные нейроны ( Johnson et al. 1994). Ритмическая генерация не требует опосредованного хлоридами синаптического торможения, и дыхательная активность синхронизируется че- рез возбудительные синаптические контакты между этими нейронами (Koshiya N, Smith JC, 1999). В этом процессе участвуют и непейсмекерные нейроны. Поэтому многие исследователи считают, что возбудительные нейронные сети пре-Больцингерова комплекса содержат генерирующую ритм сердцевину и ритм возникает на популяционном уровне из динамического взаимодействия врожденных свойств клеток и взаимодействия посредством возбудительных синапсов в системе.
Была выдвинута гипотеза о том, что пейсмекерные нейроны преБольцингерова комплекса формируют сердцевину генератора дыхательного ритма (Johnson et al., 1994). По предсказаниям гипотезы, осцилляторное поведение многих дыхательных нейронов может сохраняться при отсутствии синаптической передачи. В работе Johnson et al. (1994) на срезах продолговатого мозга крысы решались такие вопросы: действительно ли нейронам пре-Больцингерова комплекса присущи свойства пейсмекерных нейронов, являются ли эти свойства общими для нейронов, участвующих в регуляции дыхания, какова специфика про- странственно-временных паттернов активности этих нейронов. Опыты показали, что все нейроны, которые омывались физраствором с низким содержанием ионов кальция или с высоким содержанием магния, выклю- чали эндогенные дыхательные синаптические входы. Некоторые нейроны в растворе с низким содержанием кальция продолжали генерировать ритмические залпы потенциалов действия. Специальные контроли позволили выделить среди этих клеток несколько специализаций:
412
дыхательные, тонические экспираторные и тонические нейроны. Полу- ченные результаты согласуются с предположением о том, что инспираторные осцилляторы включают специализированные клетки с врожденными осцилляторными свойствами.
Роль пейсмекерных свойств нейронов в генерации дыхательного ритма позвоночных не ясна. Чтобы исследовать этот вопрос в сравнительном аспекте, ствол мозга взрослой черепахи изолировался in vitro, и регистрировалась активность корешков подъязычного нерва. В опытах Johnson et al. (2007) выяснялось, всегда ли частота берстов могла быть изменена при условиях, о которых известно, что они изменяют активность дыхательных пейсмекерных нейронов у млекопитающих (повышение концентрации KCl или блокада специфических входящих токов). Полученные данные наиболее соответствуют предположению о том, что генерация дыхательного ритма черепахи требует активируемых Ca2+ каналов, а не пейсмекерных нейронов, которые в данном случае формируют системы. Тем не менее при блокаде синаптического торможения, по-видимому, генератор ритма трансформировался в управляемую пейсмекером нейронную систему, которая требует Са2+ активируемых ионных каналов.
На препарате среза продолговатого мозга in vitro были идентифицированы две группы нейронов, связанных с дыханием. Одна группа зависима от кальций-активируемого неспецифического катионного тока, который блокируется flufanemic-кислотой. По предположению, эта группа нейронов существенна для апнии, но не для удушья. Вторая группа нейронов зависит от проводимости через постоянные калиевые каналы, которые блокируется рилузолом. Эта группа, по предположению, уча- ствует и в явлении апнии, и удушья (St-John, 2008).
Peсa and Ramirez (2004) исследовали влияние нейромедиаторов на активность нейронов дыхательного центра ствола мозга. Они использовали для этой цели вещество Р, о котором известно, что оно обладает возбуждающим эффектом на респираторные системы. Опыты выполняли на срезах мозга мыши. Эти опыты показали, что степень пейсмекерной активности дыхательных систем не фиксирована, а динамично регулируется при помощи нейромедиаторов, например, субстанции Р. Эта находка может иметь клиническое применение для синдрома Ретта, при котором уровень субстанции Р вместе с другими нейромодуляторами снижен в стволе мозга. Многие виды ритмического поведения постоянно модулируются эндогенными пептидами и аминами, но всегда ли нейромодуляторы критичны для выражения ритмичного поведения, часто ос-
413
тается неясным, в особенности у млекопитающих. В работе Tryba et al. (2007) исследуются дыхательные нейронные системы, которые были изолированы в препарате спонтанно ритмического среза продолговатого мозга мыши. В контрольных условиях дыхательная система генерировала фиктивную апническую активность. У предварительно дегипофизированных животных эта активность зависит от двух типов нейронов. Берстовая активность одного вида нейронов зависит от постоянного натриевого тока и нечувствительна к блокаде кальциевых каналов кадмием, а берстовый механизм второго типа чувствителен к кадмию и каль- ций-зависимому неспецифическому блокатору тока катионов flufenamicкислоте. Эти результаты поддерживают гипотезу о том, что два типа берстового пейсмекерного механизма лежат в основе фиктивной апнии, а за удушье отвечает только один механизм.
13.13. Пейсмекер-регулятор работы внутренних органов
Кардиопейсмекер. Долгое время считалось, что сердечный ритм развивается на поверхностной мембране пейсмекерных клеток сердца
èуправляется при помощи потенциал-зависимых ионных каналов (мембранными часами). Современное представление об инициации и регуляции ритмических биений сердца развилось из переплетений теории
èэкспериментальных данных за 200 лет. Вскоре после развития коли- чественной мембранной теории Ходжкина и Хаксли в 1952 году механизмом инициации кардиопейсмекеров считалось взаимодействие по- тенциал-зависимых ионных мембранных каналов. С тех пор изучение пейсмекерной клетки сфокусировалось на этом ограниченном мембраной пейсмекерном механизме. Хотя ансамбль потенциал-зависимых и зависимых от времени ритмов ионных каналов поверхностной мембраны (рис. 13.33) представляют немедленную причину, достаточную для выполнения потенциала действия в синоатриальном узле (SANC), не обязательно, что ансамбль ионных каналов является формальной, то есть инициирующей причиной спонтанных, ритмичных ПД.
Результаты последних исследований позволили прийти к выводу о том, что ритм инициируется, сохраняется и регулируется осцилляторами высвобождения Са2+ (Са2+часы) из саркоплазматического ретикулума, основного хранилища ионов кальция внутри клеток синоатриального узла, первичных пейсмекеров сердца. Активация локального осциллирующего высвобождения кальция не зависит от деполяризации мембраны и управляется высоким уровнем основного состояния фосфорилирования Са2+циклических протеинов. Высвобождение вы-
414
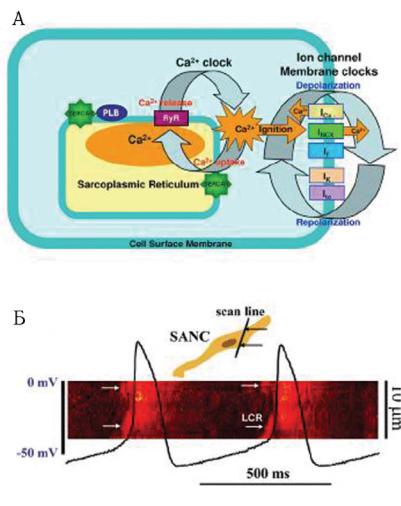
Ðèñ. 13.33. Кардиопейсмекер. А: Схематическое изображение идеи о том, что Са2+ часы активируют ионные каналы мембранных часов, чтобы вызвать нормальную автоматию сердечных пейсмекерных клеток. Следы на планке Б — это потенциалы действия, одновременно зарегистрированные в перфорированной конфигурации фикасации напряжения. (по Victor A. Maltsev, PhD and Edward G. Lakatta, MD Normal heart rhythm is initiated and regulated by an intracellular Calcium clock within pacemaker cells Heart Lung Circ. 2007 October; 16(5): 335–348).
415
зывает кальциевые волны под клеточной поверхностной мембраной в течение более поздней фазы диастолической деполяризации и активизирует входящий Na/Ca обмен, результирующийся во входящем мембранном токе, активирующем генерацию ПД. Градация скорости, с которой Са2+ часы завершают циклы, зависит от фосфорилирования. Это и есть главный регуляторный механизм нормальной пейсмекерной скорости и ритма. Четкая регуляция пейсмекерной функции гарантируется тесной интеграцией Са2+ и мембранных часов. Форма потенциалов действия и поток ионов настраиваются мембранными часами, чтобы сохранить работоспособность Са2+ часов, которые действуют так, что вовремя и точно включают мембранные часы на генерацию потенциа-
ла действия (Maltsev et al., 2007).
Пейсмекеры кишечного тракта. Внутритканевые клетки Кахала (ICC) — это пейсмекерные клетки кишок. Они имеют особые свойства, которые делают их уникальными по способности генерировать и распространять медленные волны по гастроинтестинальным мышцам. Медленные волны определяют частоту фазовых сокращений желудка, кишечника и толстой кишки. Медленные волны также определяют направление и скорость распространения перистальтической активности в соответствии с нервной системой брюшины. Медленноволновая активность желудочнокишечного тракта, продуцируемая пейсмекерными клетками, может быть
отражена на электрогастрограмме (Camborová et al., 2003). Пейсмекеры мочевого пузыря. Топографическое изучение двух
крайних областей мочеточника кошки, крысы и морской свинки (пиелоуретеральное соустье и околопузырная область) выявило наличие автономных пейсмекерных зон. Верхний ритмоводитель органа характеризуется возникновением медленноволновых колебаний мембранного потенциала, на основе которых впоследствии синхронно генерируются потенциалы действия, соответственно создающие перистальтику моче- точника. В отличие от описанного пейсмекера в околопузырной зоне наблюдается лишь спайковая активность, которая находится под влиянием околопочечного ритмогенеза. Возникает вопрос о наличии сопутствующей спайковой активности медленноволнового автоматизма, подобной вышеописанной в картине ритмоводителей пиелоуретерального соустья, который и рассматривается в работе Казаряна и др. (2007).
В опытах на взрослых кошках в области соединения мочеточника с мочевым пузырем выявлены медленноволновые пейсмекерные электрические колебания. Показано, что их ритмика (11.5 ± 1.3 колеб./мин., ï = 9) вдвое меньше частоты основного околопочечного пейсмекера. В
416
граничащих с исследуемым ритмоводителем зонах мочевого пузыря обнаружена спайковая активность, аналогичная близлежащему участку мочеточника. Во всех экспериментах отмечается согласованная деятельность медленноволновой пейсмекерной активности нижней области мочеточника со спайками из приграничной зоны мочевого пузыря. Корреляция же быстрой активности участка мочеточника, находящегося в непосредственной близости к исследуемой зоне, с медленным автоматизмом наблюдается при перерезке органа в средней его части. В этих условиях показано увеличение частоты ритмогенеза медленноволновой активности (до 14 ± 1.7 колеб./мин, и = 9).
13.14. Пейсмекерная пластичность
Приведенные в обзоре материалы дают возможность утверждать, что роль пейсмекера в осуществлении самых разных функций нервной системы исключительна. В общем виде нейрон представляется состоящим из электровозбудимой мембраны, химически возбудимой мембраны и локуса генерации пейсмекерной активности. Пейсмекерный механизм, взаимодействующий с хемовозбудимой и электровозбудимой мембраной, превращает нейрон в устройство со «встроенным управляемым генератором» (Соколов и Незлина, 2007). Принципиально новое, что вносит эндогенный пейсмекер в функционирование нейрона, заключа- ется в том, что пейсмекерный потенциал превращает нейрон в генератор (Пейсмекерный потенциал нейрона, 1975, Соколов и Ярмизина, 1972). Представление о нейроне как управляющем и управляемом генераторе заставляет иначе взглянуть на организацию многих функций мозга.
Пейсмекер обладает высокой степенью пластичности. Опыты на изолированных нейронах показывают это его качество наиболее эффектно: у клеток, «освобожденных» от синаптических влияний, способности к обучению сохраняются на высоком уровне. Представлены ассоциативные и неассоциативные формы обучения, а также формирование многих следовых эффектов. Если обратиться к современным представлениям о нейронных механизмах памяти, то обнаружим, что локусом пластичности во многих исследованиях является синапс (Antonov et al., 2001, Martin et al., 2000). Именно с различными изменениями в области синаптических контактов связывают все наиболее изученные формы обучения — LTP, ассоциативное обучение, привыкание. Не подвергая сомнениям роли пластичности синапсов, можно представить такое развитие событий: при обучении синапсы претерпевают ряд тонких функциональных изменений, эти изменения подстраивают моди-
417
фицируемую синаптическую эффективность к имеющемуся в нейроне «пейсмекерному ядру», которое представлено активирующимся осциллятором (генетически закрепленным ответом). «Считывание» содержимого «пейсмекерного ядра» запускается синаптическим входом с определенными свойствами. Модификации, претерпеваемые синапсом, создают его сигналам условия для их доступа к пейсмекерному исполнению: при обучении синаптический вход переходит в категорию имеющих влияние на эндонейрональную активность. В результате обу- чения происходит создание таких условий, в которых возможно эффективное взаимодействие между эндогенными пейсмекерами и определенными (занятыми в обучении) синаптическими входами. Нарушение синапто-пейсмекерного взаимодействия приводит к нарушению памяти на уровне поведения. Пластичность нейронной системы основана на установлении взаимодействия между модифицируемыми синаптическими входами и пластичными эндогенными пейсмекерами. Поэтому можно различать два механизма пластичности: один обеспе- чивает локальные изменения определенного синаптического контакта, а механизм второго уровня устанавливает взаимодействие между модифицируемым синапсом и «пейсмекерным ядром».
Выводы
•Пейсмекер — самая древняя форма эндонейрональной активности. Она существует уже у прокариотов.
•Пейсмекер генетически задан.
•Механизмы реализации пейсмекерных осцилляций сформированы
âэволюции: каналы специфической ионной проводимости, необходимые для его актуализации, появляются у прокариотов, сохраняются (и обогащаются новыми формами) при переходе к многоклеточности.
•Пейсмекерный механизм реализует многие функции, в том числе запуск процесса клеточной дифференциации.
•В эволюции при переходе к многоклеточной развитой нервной системе пейсмекер становится свойством многих клеток, принадлежащих разным мозговым структурам. Функции пейсмекера определяются задачами этих структур.
•Пейсмекер — транслятор генетической памяти. Активация пейсмекера происходит через эндогенно возникающие сигналы и через определенные синаптические связи. Обучение — один из способов экзогенного (через синапсы и экстраклеточное пространство) влияния на пейсмекерный механизм.
418
Цитированная литература
Рекомендуемая
1.Пейсмекерный потенциал нейрона / Под ред. Е. Н. Соколова, Н. Н. Тавхелидзе. Тбилиси, Мецниереба, 1975.
2.Соколов Е. Н. Восприятие и условный рефлекс: Новый взгляд // М.: УМК «Психология». 2003.
3.Тушмалова Н. А. Основные закономерности эволюции поведения беспозвоночных // Физиология поведения. Л., 1987.
Дополнительная
1.Бурлакова Е. Б., Конрадов А. А., Мальцева Е. Л. Сверхслабые воздействия химических соединений и физических факторов на биологические системы // Биофизика. 2004. Т. 49., 24.
2.Бурлакова Е. Б., Греченко Т. Н., Соколов Е. Н., Терехова С. Ф. Влияние ингибиторов радикального окисления липидов на электрическую активность изолированных нейронов Helix pomatia // Биофизика, 1986, т. 31, ¹5, 921.
3.Греченко Т. Н. Изолированные нейроны в исследованиях памяти // Вестн. Моск. Универ., сер.14, психология, 2001, ¹1, 64-80.
4.Греченко Т. Н. «Условный ответ» электровозбудимой мембраны изолированных нейронов виноградной улитки // ВНД, 1984, т. 36, ¹5, 982-985.
5.Греченко Т. Н., Кондратьева С. И. О механизме кратковременной памяти. Психол.ж., 1981, т. 2, ¹3, 95-99.
6.Греченко Т. Н., Соколов Е. Н. Эндонейрональная пластичность изолированных нейронов виноградной улитки. // ВНД, 1979, т. 29, ¹5, 1093-1095,
7.Данилова Н. Н. Роль высокочастотных ритмов электрической активности мозга в обеспечении психических процессов психология // Журнал Высшей школы экономики. 2006. Т. 3, ¹ 2. С. 62-72, 24, 31.
8.Данилова Н. Н. Гамма-осцилляции мозга в когнитивном контроле восприятия // Тртетья международная конференция по когнитивной науке. Москва, 2008. Тезися докладов, 1 том, С.248-249.
9.Доронин В. К., Зозулин С. В. Гетерогенность внутриклеточных потенциалов инфузории Spirostomum ambiguum // Эволюц. биохим. физиол., 1976, 12 (6), 539-543.
10.Иваницкий А. М., Подклетова И. М., Таратынова Г. М. Исследование динамики внутрикоркового взаимодействия в процессе мыслительной деятельности // Журн. высш. нервн. деят. 1990. Т. 40. ¹ 2. С. 230-237.
11.Казарян К. В., Ванцян В. Ц., Тираян А. С., Акопян Р. Р. Исследование электрической активности области соединения мочеточника с мочевым пузырем и приграничных зон у крыс // Российский физиологический журнал им.
È.М. Сеченова. 2007. Т. 93. ¹ 7. С. 799-805.
12.Котов Н. В., Волченко А. М., Давыдов Д. А., Костылева Е. К., Садыков
È.X., Платов К. В. Двигательная активность парамеций // Биофизика. 2000. Т. 45(3). С. 514-519.
419
