
- •Ответы по химии!
- •2 Химическая система (открытая, закрытая, изолированная). Внутренняя энергия.
- •5.Изобарный потенциал реакции (свободная энергия Гиббса). Критерий самопроизвольности реакций.
- •Принцип ле-шателье.Смещение химического равновесия.
- •1. Влияние температуры.
- •2. Влияние давления.
- •3. Влияние концентрации
- •10 Способы выражения концентраций растворов
- •13 Процесс электролитической диссоциации как взаимодействие веществ. Самоионизация.
- •14. Закон действующих масс в растворах электролитов. Сильные и слабые электролиты. Степень диссоциации.
- •15. Теория сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Связь ионной силы раствора с коэффициентом активности.
- •16. Протолитическое равновесие. Кислоты, основания, амфолиты по Бренстеду.
- •17. Вода как растворитель. Дифференцирующие и нивелирующие растворители.
- •18. Автопротолиз. Ионное произведение воды. Рн
- •19. Гидролиз по катиону и аниону. Необратимый гидролиз. Константа и степень гидролиза. Расчёт pH.
- •Константа гидролиза.
- •Расчёт pH.
- •20. Буферные растворы, природные буферные системы. Расчёт pH буферных систем, буферная ёмкость.
- •21. Кислоты и основания по Льюису.
- •22. Гетерогенные равновесия. Произведение растворимости.
- •23. Химическая связь: типы связи, механизмы образования, характеристики.
- •24. Комплексные соединения (кс). Строение кс. Номенклатура кс. Классификация кс. Характер связи в кс.
- •Классификация
- •По заряду комплекса
- •По числу мест, занимаемых лигандами в координационной сфере
- •По природе лиганда
- •Химическая связь в комплексных соединениях.
- •25.Диссоциация комплексных ионов. Константа нестойкости. Комплексообразование в организме.
- •26.Изомерия кс. Комплексообразование в организме.
- •27.Строение гемма
- •28. Овр и их биологическая роль.
- •30. Коллоидные системы. Строение коллоидной частицы. Двойной электрический слой. Электрокинетические явления.
- •31. Методы очистки коллоидных растворов. Диализ, электролиз, ультрафикация.
- •32.. Получение и свойства дисперсных систем. Получение суспензий, эмульсий, коллоидных растворов.
- •33. Устойчивость дисперсных систем. Седиментационная , агрегативная и конденсационная устойчивость лиозолей. Факторы, влияющие на устойчивость лиозолей.
- •34. Коагуляция.Порог коагуляци и нго определение,правило Шульце-Гарди.Взаимная коагуляция.
- •35. Поверхностные явления и адсорбция. Адсорбционные равновесия и процессы на подвижных границах раздела фаз.Уравнение Гиббса
- •36. Поверхностно-активные и поверхностно-неактивные вещества. Изменение поверхностной активности в гомологических рядах (правило Траубе).
- •37. Поверхностное натяжение и методы его определения
- •38. Адсорбция из раствора на твёрдом адсорбенте
- •39. Адсорбционные равновесия на неподвижных границах раздела твёрдых фаз. Физическая адсорбция и хемосорбция
- •Типы адсорбционных взаимодействий
- •40.Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов.
- •Зависимость величины адсорбции от:
- •41. Применения десорбциооных процессов в медицине Применение адсорбционных процессов в медицине
- •42. Хроматография
- •43. Специфические свойства вмс.
- •44. Понятие биогенности химических элементов.
- •45. Химия биогенных элементов s-блока.
- •46. Химия биогенных элементов d-блока.
- •47. Химия биогенных элементов p-блока.
- •49.Полифункциональные органические соединения
- •50 Полиамины: этилендиалин.Путресцин.Кадоверин.
- •51 Гетерофункциональные соединения
- •52 Б) Оксокислоты-адельгидо- и кетонокислоты
- •53 Гетерофункциональные производные бензольного ряда как лекарственные средства
- •54 Гетероциклическими называют циклические органические соединения, в состав цикла которых, помимо атомов углерода, входят один или несколько атомов других элементов (гетероатомов).
- •13.1.2. Номенклатура
- •13.2.1. Ароматические свойства
- •13.2.2. Кислотно-основные и нуклеофильные свойства
- •13.5.1. Гидроксипурины
- •55.Фолиевая кислота, биотин, тиамин. Понятие о строении и биологической роли. Представление об алкалоидах и антибиотиках
- •Эффекты биотина
- •Физиологические функции
- •Значение тиамина в спорте
- •Пищевые источники
- •Алкалоиды
- •Антибио́тики
- •56.Пептиды и белки
- •Свойства пептидов
- •R h2n—сн—соон
- •Биологическое значение углеводов
- •Виды углеводов
- •Гомополисахариды
- •Влияние мукополисахаридов на стабилизацию структуры коллагена дентины и эмали
- •58.Нуклеиновые кислоты
- •60.Полимеры. Понятие о полимерах медицинского назначения.
- •Полимеры медицинского назначения
40.Адсорбция из растворов. Уравнение Ленгмюра. Зависимость величины адсорбции от различных факторов.
Уравнение Ленгмюра описывает количественно адсорбцию на подвижной и неподвижной ганицах раздела сред.
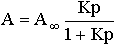
Зависимость величины адсорбции от:
1. присутствие третьего компонента- растворителя, молекулы которого могут конкурировать с молекулами адсорбата за места на поверхности адсорбента
2. взаимодействие между молекулами адсорбата и растворителя
3. электростатическое взаимодействие между поверхностью адсорбента и ионами адсорбата, если он является электролитом.
Значение адсорбции
Адсорбция — всеобщее и повсеместное явление, имеющее место всегда и везде, где есть поверхность раздела между фазами. Наибольшее практическое значение имеет адсорбция поверхностно-активных веществ и адсорбция примесей из газа либо жидкости специальными высокоэффективными адсорбентами. В качестве адсорбентов могут выступать разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее распространённая форма — активированный уголь), силикагели, цеолиты а также некоторые другие группы природных минералов и синтетических веществ.
Адсорбция (особенно хемосорбция) имеет также важное значение в гетерогенном катализе.
41. Применения десорбциооных процессов в медицине Применение адсорбционных процессов в медицине
Адсорбция лежит в основе клинического анализа крови на СОЭ (скорость осаждения эритроцитов). Так, при инфекционных заболеваниях в крови происходит обменная адсорбция: вместо ионов электролитов поверхность эритроцитов занимают молекулы белков. При этом заряд эритроцитов понижается и они быстрее объединяются и оседают.
Адсорбционная терапия применяется для удаления токсинов и вредных веществ из пищеварительного тракта. Такие адсорбенты, как гидроксид алюминия, оксид магния, фосфат алюминия, входят в состав препаратов альмагель, фосфалюгель. Активированный уголь давно применяется как адсорбент газов (при метеоризме), токсинов (при пищевых токсикоинфекциях), алкалоидов и тяжелых металлов (при травлениях).
Хорошей адсорбирующей способностью обладает клетчатка. Содержание клетчатки у больных сахарным диабетом должно быть не меньше 25 г/1000 ккал: клетчатка замедляет всасывание сахаров, компенсируя повышение концентрации глюкозы в плазме после приема пищи.
На основе оксида кремния создан препарат полисорб – неселективный полифункциональный энтеросорбент. Его применяют для выведения из организма патогенных бактерий и их токсинов, пищевых аллергенов, солей тяжелых металлов, радионуклидов, этанола, а также ядов различного происхождения.
42. Хроматография
Хроматография – метод разделения веществ при прохождении раствора или газа через колонку с адсорбентом. Метод хроматографии широко используется для веществ, в том числе и неокрашенных. Для этого длинные тонкие капилляры с пористыми стенками или заполняют более широкие трубки зернами пористого адсорбента (оксида алюминия, оксида магния, древесного угля и др.). Это приводит к возникновению большой поверхности раздела фаз, следовательно, при медленном прохождении газа осуществляются многократно повторяющиеся процессы адсорбции и десорбции молекул компонентов газовой смеси. Это позволяет получить разные времена выходов компонентов из колонки или т.н. разные времена удерживания. Такой вид хроматографии называют газоадсорбционной хроматографией.
Если же крупные поры адсорбента заполнить неподвижной жидкостью, то вместо различий в адсорбируемости можно использовать различия в растворимости отдельных компонентов газовой смеси – газожидкостная хроматография.
Хроматографическое разделение смесей веществ может осуществляться разными способами:
1 способ:в колонку с адсорбентом вводят газовую смесь с постоянной концентрацией компонентов. У выхода из колонки появляются наименее адсорбирующийся или наименее растворимый компонент, затем смесь этого компонента с несколько более легко адсорбирующимся компонентом, затем смесь двух компонентов с еще более легко адсорбирующимся и т.д. вплоть до исходной газовой смеси. Такой анализ называют фронтальным. Недостатком его является то, что в чистом виде можно получить только первый компонент.
2 способ: через колонку с адсорбентом пропускают непрерывный поток практически неадсорбирующегося газа (газ-носитель), в который у входа в колонку вносят небольшую порцию анализируемой смеси. В этом случае у выхода из колонки в токе газа-носителя сначала появляется наименее адсорбирующийся компонент газовой смеси, затем газ-носитель, затем смесь первого компонента с более легко адсорбирующимся газом, затем газ-носитель и т.д. Таким образом, зоны выхода компонентов на хроматограмме оказываются разделенными газом-носителем. Такой анализ называется проявительнойхроматографией.
