
- •1. Кровь, её функции. Основные физико-химические константы крови в норме и при патологии.
- •2. Белки плазмы крови, классификация, методы разделения.
- •3.Основные небелковые компоненты крови. Остаточный азот, его состав.
- •4.Принципы организации и механизмы регуляции кос.
- •5. Виды, причины и механизм развития алкалоза и ацидоза.
- •6. Эритроциты. Общая характеристика, строение, особенности метаболизма.
- •8. Биосинтез гема. Реакции, ферменты, локализация, регуляция и биологическая роль. Порфирии
- •9. Распад Hb в клетках рэс.
- •10. Метаболизм Fe
- •11. Особенности метаболизма лейкоцитов.
- •12. Особ метаболизма тромбоцитов, роль в гемостазе.
- •13. Механизм и стадии образования мочи.
- •Петля Генле обеспечивает реабсорбцию воды и солей
- •Реабсорбция кальция происходит в дистальном отделе
- •Конечный отдел нефрона определяет объем мочи
- •14. Органические и неорганические компоненты мочи норме/пат.
- •Калий Нормальные величины
- •Нормальные величины
- •Клинико диагностическое значение
- •Хлориды
- •Нормальные величины
- •Клинико диагностическое значение
- •Бикарбонаты
- •Нормальные величины
- •Клинико диагностическое значение
- •Фосфаты
- •Нормальные величины
- •Клинико диагностическое значение
- •Органические компоненты мочи Мочевина
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Креатинин
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Креатин
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Мочевая кислота
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Гиппуровая кислота
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Органические кислоты
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Пигменты
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Нормальные величины
- •Клинико‑диагностическое значение
- •Глюкоза
- •Нормальные величины
- •Клинико‑диагностическое значение
- •15. Нарушение процессов фильтрации, реабсорбции, секреции.
- •Лабораторная оценка реабсорбции Проксимальный каналец
- •Дистальный каналец
- •16. Гомеостатическая функция почек.
- •17. Особенность обмена белков и аминокислот в почках:
- •19. Функции печени. Особенности метаболизма гепатоцитов
- •20. Роль печени в углеводном обмене
- •21. Роль печени в липидном обмене
- •22.Роль печени в азотистом обмене.
- •24. Роль печени в регуляции кос, гормон гомеостаза и уровня бав.
- •I фаза метаболизма ксенобиотиков
- •Восстановление нитросоединений
- •II фаза метаболизма ксенобиотиков
- •25. Струк-функц и метабол характеристика мышечных волокон
- •26. Характеристика белков мышечной ткани
- •27. Роль мышечной ткани в межорганном обмене субстратами
- •28. Особенности метаболизма миокарда
- •30. Общая характеристика метаболизма нервной системы.
- •31. Нейромедиаторы, их характеристика и метаболизм
- •33. Биохим механизмы действ на мозг алк, нарк и токс соед.
- •34. Характеристика волокнистых структур ст.
- •35.Схема биосинтеза гликозамингликанов, их функциональная роль.
- •36.Костная и хрящевая ткань, хим сост и особ метаболизма.
- •37. Изменение ст при старении, коллагенозах, заживлении ран.
- •38.Механизмы канцерогенеза.
- •39. Биохимия легочной ткани. Причины и биохимические механизмы развития эмфиземы легких.
24. Роль печени в регуляции кос, гормон гомеостаза и уровня бав.
Печень регулирует КОС:
1. превращением аминокислот, кетокислот и лактата в нейтральную глюкозу;
2. превращением сильного основания аммиака в слабо основную мочевину;
3. синтезируя белки крови, которые образуют белковый буфер;
4. синтезирует глутамин, который используется почками для аммониогенеза.
Печеночная недостаточность приводит к развитию метаболического ацидоза.
В тоже время печень синтезирует кетоновые тела, которые в условиях гипоксии, голодания или сахарного диабета способствуют ацидозу.
Из всех органов печень играет ведущую роль в обмене белков, жиров, углеводов, витаминов, гормонов и других веществ. Ее основные функции:
-
Антитоксическая. В ней обезвреживаются токсические продукты, образующиеся в толстом кишечнике в результате бактериального гниения белков - индол, скатол и фенол. Они, а также экзогенные токсические вещества (алкоголь), подвергаются биотрансформации. (Экк-Павловское соустье).
-
Печень участвует в углеводном обмене. В ней синтезируется и накапливается гликоген, а также активно протекают процессы гликогенолиза и неоглюкогенеза. Часть глюкозы используется для образования жирных кислот и гликопротеинов.
-
В печени происходит дезаминирование аминокислот, нуклеотидов и других азотсодержащих соединений. Образующийся при этом аммиак нейтрализуется путем синтеза мочевины.
-
Печень участвует в жировом обмене. Она преобразует короткоцепочечные жирные кислоты в высшие. Образующийся в ней холестерин используется для синтеза ряда гормонов.
-
Она синтезирует ежесуточно около 15 г альбуминов, 1- и 2-глобулины, 2-глобулины плазмы.
-
Печень обеспечивает нормальное свертывание крови. 2-глобулинами являются протормбин, Ас-глобулин, конвертин, антитромбины. Кроме того ею синтезируется фибриноген и гепарин.
-
В ней инактивируются такие гормоны, как адреналин, норадреналин, серотонин, андрогены и эстрогены.
-
Она является депо витаминов А, В, D, E, K.
-
В ней депонируется кровь, а также происходит разрушение эритроцитов с образованием из гемоглобина билирубина.
-
Экскреторная. Ею выделяются в желудочно-кишечный тракт холестерин, билирубин, мочевина, соединения тяжелых металлов.
-
В печени образуется важнейший пищеварительный сок - желчь.
I фаза метаболизма ксенобиотиков
Метаболическая трансформация — I фаза метаболизма ксенобиотиков, включает несинтетические реакции, такие как окисление, восстановление, гидролиз. Метаболическая трансформация происходит за счёт присоединения или освобождения функциональных групп; гидроксильных (-ОН), сульфгидрильных (-SH) или аминогрупп (-NH2) в результате чего ксенобиотик становится более гидрофильным.
В метаболизме ксенобиотиков принимают участие ферменты почек, лёгких, кожи и ЖКТ, но наиболее активны ферменты печени.Основной вклад в обмен ксенобиотиков вносит эндоплазматическая сеть. Поскольку «микросомами» называютфракцию, полученную при дифференциальном центрифугировании клеточных гомогенатов и богатую эндоплазматической сетью, часто говорят о микросомальном и немикросомальных путях метаболизма. Вне микросом обмен может проходить в лизосомах, пероксисомах, митохондриях, цитозоле.
Микросомное окисление — совокупность реакций I фазы биотрансформации ксенобиотиков и эндогенных соединений, катализирующихся ферментными системами мембран эндоплазматического ретикулума гепатоцитов при участии цитохрома Р450 (рис. 29.1).
Микросомные ферменты катализируют реакции С-гидроксилирования, N-гидроксилирования, О-, N-, S-дезалкилирования, окислительного дезаминирования, сульфоокисления и эпоксидирования.
Цитохром Р450 (CYP) представляет группу ферментов (цитохром Р450-зависимые монооксигеназы), осуществляющих не только метаболизм ЛС и других ксенобиотиков, но и участвующих в синтезе глюкокортикостероидных гормонов, холестерола, желчных кислот, тромбоксанов и простациклинов. Субстратная специфичность этих ферментов очень низка, поэтому они окисляют различные вещества.
Цитохром Р450 — гемопротеин. Имеет множество изоферментов (более 1000 изоформ). Изоферменты цитохрома Р450 по идентичности аминокислотного состава разделяют на семейства (существует 17 семейств) и 39 подсемейств. Название цитохром Р450 указывает на то, что максимум поглощения комплекса цитохрома Р450 лежит в области 450 нм.

Рис. 30.1. Электронтранспортная цепь: НAДФH∙H+ ‒ P450 редуктаза ‒ цитохром Р450
В большинстве случаев донором электронов (е) для этой цепи служит НAДФH∙H+, окисляемый НAДФH.H+-P450 редуктазой. Фермент в качестве простетической группы содержит 2 кофермента ‒ флавинадениндинуклеотид (ФАД) и флавинмононуклеотид (ФМН). Протоны и электроны с НAДФH∙H+ переходят последовательно на коферменты. Восстановленный ФМН (ФМНH2) окисляется цитохромом Р450. Связывание в активном центре цитохрома Р450 вещества R-H активирует восстановление железа в геме ‒ присоединяется первый электрон. Изменение валентности железа увеличивает сродство комплекса P450-Fe2+·RH к молекуле кислорода. Появление в центре связывания цитохрома Р450 молекулы О2 ускоряет присоединение второго электрона и образование комплекса P450-Fe2+O2--RH. На следующем этапе Fe2+ окисляется, второй электрон присоединяется к молекуле кислорода P450-Fe3+O22-. Восстановленный атом кислорода О2- взаимодействует с протонами: О2- + 2Н+ → Н2О, и образуется вода. Второй атом молекулы кислорода включается в субстрат R-H, образуя гидроксильную группу вещества R-OH. Модифицированное вещество R-OH отделяется от фермента.
Таким образом, реакции с участием цитохромов Р450 заключаются в гидроксилировании веществ типа R-H с использованием одного атома молекулы кислорода О2, второй атом соединяется с протонами водорода H+ с образованием воды (поэтому ферменты называют также монооксигеназами или гидроксилазами).
Суммарное уравнение реакции гидроксилирования вещества R-H ферментами микросомального окисления:
R-H + О2 + НАДФН∙Н+ → R-OH + Н2О + НАДФ+
Гидроксилирование гетероциклических соединений

Гидроксилирование алифатических соединений
![]()
N-окисление с образованием N - оксидов и N – гидроксиламинов (аминазин, морфин, ацетиламинофлюорен).
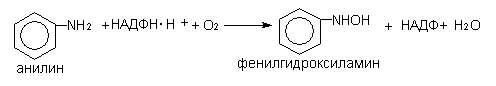
S-окисление и десульфирование (аминазин, тиобарбитал).

Окислительное дезаминирование (амфетамин).

Удаление групп. Деалкилирование по N (морфин, лидокаин, атропин, диазепам).
RNHCH3 → RNH2 + H2C=O
Удаление групп. Деалкилирование по О (кодеин, фенацетин, кофеин, папаверин).
ROCH3 → ROH + H2CO
Дегалогенизация (хлороформ, метоксифлуран, галотан).
Эпоксидирование. R-CH=CH-R'
→ R-CH=CH-R'![]()
![]()
O
Метаболизм этанола.Цитохром Р450-зависимая микросомная этанолокисляющая система (МЭОС) локализована в мембране гладкого ЭПР гепатоцитов и играет незначительную роль в метаболизме небольших количеств алкоголя, но индуцируется этанолом, другими спиртами, барбитуратами и приобретает существенное значение при злоупотреблении этими веществами. При хроническом алкоголизме за счёт гипертрофии ЭПР и индукцииCYP2E1 (изофермент цитохрома Р450) окисление этанола ускоряется на 50‒70 %. Кроме того, этанол конкурирует с ксенобиотиками за связывание сCYP2E1, вызывая гиперчувствительность к некоторым принятым одновременно с ним лекарственным препаратам.
Кроме основной реакции, цитохром Р450катализирует образование активных форм кислорода (О2-, Н2О2), которые стимулируют перекисное окисление липидов.
Окисление немикросомными ферментами – дегидрогеназами и оксидазами.
Основную роль в метаболизме этанола и алифатических спиртов играет цинксодержащий НАД+- зависимый фермент — алкогольдегидрогеназа (АДГ), локализующаяся в основном в цитозоле и митохондриях печени (95%). АДГ катализирует обратимую реакцию, направление которой зависит от концентрации ацетальдегида и соотношения НАДФН∙Н+/НАД+в клетке.
С2Н5ОН + НАД+↔ СН3СНО + НАДФН∙Н+
Второстепенную роль в окислении этанола играет каталаза, находящаяся в пероксисомах цитоплазмы и митохондрий клеток печени. Этот фермент расщепляет примерно 2% этанола, но при этом утилизирует пероксид водорода.
СН3СН2ОН + Н2О2→ Н3СНО + 2 Н2О
Ацетальдегид, образовавшийся из этанола, окисляется до уксусной кислоты двумя ферментами: ФАД-зависимой альдегидоксидазой и НАД-зависимой ацетальдегиддегидрогеназой (АлДГ). Ацетальдегид - очень реакционно-способное соединение; он неферментативно может ацетилировать SH-, NH2- группа белков и других соединений в клетке и нарушать их функции.
Восстановлению подвергаются отдельные ЛС (нитробензол, левомицетин, нитразепам, хлоралгидрат). Происходит это под действием нитроредуктаз и азоредуктаз.
