
- •Характеристика химических свойств
- •Типы химических реакций: присоединения, разложения, обмена и замещения; кислотно-основные равновесия, окислительно-восстановительные, комплексообразования.
- •Развитие представлений о строении атома. Планетарная модель атома Резерфорда, противоречия модели. Модель строения атома водорода Бора. Условие стационарности орбит.
- •Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
- •Кривая зависимости энергии от межъядерного расстояния:
- •Обменный и донорно-акцепторный механизм образования ковалентной связи
- •Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
- •Межмолекулярные взаимодействия: ориентационные, индукционные, дисперсионные. Межмолекулярная водородная связь.
- •Периодический закон Менделеева. Физическое обоснование закона. Структура Периодической системы: периоды, ряды, группы и подгруппы. Электронные семейства.
- •Орбитальный радиус
- •I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
- •Основные понятия химической термодинамики: система, классификация термодинамических систем, термодинамические параметры, гомогенные и гетерогенные системы.
- •Внутренняя энергия. Классификация термодинамических процессов. Первое начало термодинамики. Закон Гесса. Следствие из закона Гесса.
- •Второе начало термодинамики. Энтропия.
- •Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
- •Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
- •Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- •Способы выражения концентрации растворов: массовая, объемная, молярная, молярная эквивалентов, мольная, моляльность.
- •Коллигативные свойства растворов. Закон Рауля. Эбулиоскопия и криоскопия.
- •Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
- •Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
- •Константа диссоциации, закон разбавления Оствальда.
- •Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
- •1) Произведение растворимости
- •Гидролиз. Различные случаи частичного гидролиза солей.
- •Случаи необратимого гидролиза солей. Взаимоусиливающий гидролиз.
- •Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
- •Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
- •Типичные окислители и восстановители. Метод ионно-электронных схем.
- •Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
- •Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
- •Химическая стойкость металлов в растворах солей.
- •Электрохимические процессы и системы. Двойной электрический слой.
- •Химические источники тока. Батарейки и аккумуляторы. Процессы при разрядке и зарядке свинцового аккумулятора, Даниэля-Якоби, щелочные аккумуляторы. Топливные элементы.
- •Электролиз. Законы электролиза Фарадея. Электродные процессы при электролизе расплавов и растворов.
- •40. Способы защиты от коррозии металлов: обработка внешней среды, защитные покрытия, электрохимическая защита, легирование, рациональное конструирование.
-
Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
В атомах электроны находятся на разрешенных энергетических состояниях – атомных орбиталях (АО). Аналогичным образом, электроны в молекулах существуют в разрешенных энергетических состояниях – молекулярных орбиталях (МО).
Молекулярная орбиталь устроена намного сложнее атомной орбитали. Приведем несколько правил, которыми мы будем руководствоваться при построении МО из АО:
-
При составлении МО из набора атомных орбиталей, получается такое же число МО, сколько АО в данном наборе.
-
Средняя энергия МО, полученных из нескольких АО, примерно равна (но может быть больше или меньшее)средней энергии взятых АО.
-
МО подчиняются принципу запрета Паули: на каждой МО не может находиться более двух электронов, которые должны иметь противоположные спины.
-
МО подчиняются принципу правилу Хунда: в каждой из орбиталей подслоя заполняется сначала один электрон, а только после исчерпания незаполненных орбиталей на эту орбиталь добавляется второй электрон.
Введем понятие порядок связи. В двухатомных молекулах порядок связи показывает, насколько число связывающих электронных пар превышает число разрыхляющих электронных пар:
![]()
n>0 - система существует и устойчива.
n=0 - система не существует.
0<n<1 – система существует, но нестабильна
При использовании метода молекулярных орбиталей считается, что каждый электрон находится в поле всех ядер. При этом связь не обязательно образована парой электронов. Например, ион H2+ состоит из двух протонов и одного электрона. Между двумя протонами действуют силы отталкивания, между каждым из протонов и электроном – силы притяжения. Химическая частица образуется лишь в том случае, если взаимное отталкивание протонов компенсируется их притяжением к электрону. Это возможно, если электрон расположен между ядрами в области связывания. В противном случае силы отталкивания не компенсируются силами притяжения – горят, что электрон находится в области антисвязывания, или разрыхления.
Энергии связывающих орбиталей ниже, чем энергии атомных орбиталей, использованных для их орбиталей. Электроны, заселяющие связывающие молекулярные орбитали, находятся преимущественно в пространстве между связываемыми атомами, т. е. в так называемой области связывания. Энергии разрыхляющих орбиталей выше, чем энергии исходных атомных орбиталей. Заселение разрыхляющих молекулярных орбиталей электронами способствует ослаблению связи: уменьшению ее энергии и увеличению расстояния между атомами в молекуле. Электроны молекулы водорода, ставшие общими для обоих связываемых атомов, занимают связывающую орбиталь.
Молекулярно-орбитальные диаграммы элементов первого периода
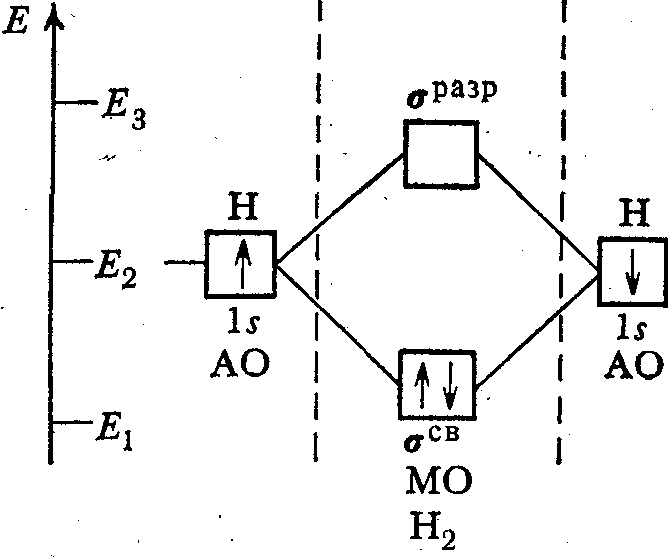
В результате взаимодействия 1s-орбиталей каждого из атомов водорода, образуются две молекулярные орбитали. При взаимодействии, когда электронная плотность концентрируется в пространстве между ядрами, образуется связывающая сигма – орбиталь (σ). Эта комбинация имеет более низкую энергию, чем исходные атомы. При взаимодействии, когда электронная плотность концентрируется за пределами межъядерной области, образуется разрыхляющая сигма – орбиталь (σ*). Эта комбинация имеет более высокую энергию, чем исходные атомы.
Рассмотрим образования молекулы Li2, принимая во внимание, что 1s- и 2s-орбитали слишком сильно отличаются по энергии и поэтому между ними не возникает сильного взаимодействия. Диаграмма энергетических уровней молекулы Li2 показана ниже, где электроны, находящиеся на 1s-связывающих и 1s-разрыхляющих орбиталях, не вносят значительного вклада в связывание. Поэтому за образование химической связи в молекуле Li2 отвечают 2s-электроны. Это действие распространяется и на образование других молекул, в которых заполненные атомные подоболочки (s, p, d) не дают вклада в химическую связь. Таким образом, рассматриваются только валентные электроны.

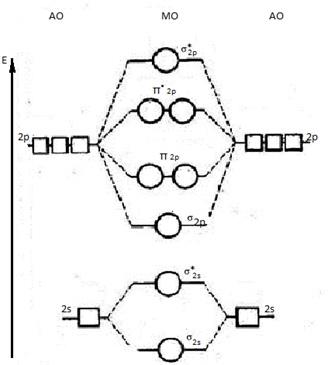
Молекулярно-орбитальные диаграммы элементов второго периода
Рассмотрим, как взаимодействуют два одинаковых атома второго периода между собой, имеющие набор из s- и p-орбиталей. Следует ожидать, что 2s-орбитали будут соединяться только друг с другом, а 2p-орбитали – только с а 2p-орбиталями. Т. к. 2p-орбитали могут взаимодействовать друг с другом двумя различными способами, то образуют σ- и π-молекулярные орбитали. Пользуясь обобщённой диаграммой, показанной ниже, можно установить электронные конфигурации двухатомных молекул второго периода, которые приведены в таблице.

Молекулярные орбитали полярных двухатомных молекул
При значительных различиях между атомами, входящих в состав молекулы, диаграмма видоизменяется. Рассмотрим молекулу HF, в которой атомы сильно отличаются по электроотрицательности.
Энергия 1s-орбитали атома водорода выше энергии самой высокой из валентных орбиталей фтора – 2p- орбитали. Взаимодействие 1s-орбитали атома водорода и 2p- орбитали фтора приводит к образованию связывающей и разрыхляющей орбиталей, как показано на рисунке. Пара электронов, находящиеся на связывающей орбитали молекулы HF, образуют полярную ковалентную связь.

Магнитные свойства молекул
Характер распределения электронов по молекулярным орбиталям позволяет объяснить также магнитные свойства молекул. По магнитным свойствам различают парамагнитные и диамагнитные вещества. Парамагнитными являются вещества, у которых имеются непарные электроны, у диамагнитных веществ все электроны парные.
