
- •Характеристика химических свойств
- •Типы химических реакций: присоединения, разложения, обмена и замещения; кислотно-основные равновесия, окислительно-восстановительные, комплексообразования.
- •Развитие представлений о строении атома. Планетарная модель атома Резерфорда, противоречия модели. Модель строения атома водорода Бора. Условие стационарности орбит.
- •Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
- •Кривая зависимости энергии от межъядерного расстояния:
- •Обменный и донорно-акцепторный механизм образования ковалентной связи
- •Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
- •Межмолекулярные взаимодействия: ориентационные, индукционные, дисперсионные. Межмолекулярная водородная связь.
- •Периодический закон Менделеева. Физическое обоснование закона. Структура Периодической системы: периоды, ряды, группы и подгруппы. Электронные семейства.
- •Орбитальный радиус
- •I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
- •Основные понятия химической термодинамики: система, классификация термодинамических систем, термодинамические параметры, гомогенные и гетерогенные системы.
- •Внутренняя энергия. Классификация термодинамических процессов. Первое начало термодинамики. Закон Гесса. Следствие из закона Гесса.
- •Второе начало термодинамики. Энтропия.
- •Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
- •Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
- •Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- •Способы выражения концентрации растворов: массовая, объемная, молярная, молярная эквивалентов, мольная, моляльность.
- •Коллигативные свойства растворов. Закон Рауля. Эбулиоскопия и криоскопия.
- •Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
- •Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
- •Константа диссоциации, закон разбавления Оствальда.
- •Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
- •1) Произведение растворимости
- •Гидролиз. Различные случаи частичного гидролиза солей.
- •Случаи необратимого гидролиза солей. Взаимоусиливающий гидролиз.
- •Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
- •Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
- •Типичные окислители и восстановители. Метод ионно-электронных схем.
- •Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
- •Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
- •Химическая стойкость металлов в растворах солей.
- •Электрохимические процессы и системы. Двойной электрический слой.
- •Химические источники тока. Батарейки и аккумуляторы. Процессы при разрядке и зарядке свинцового аккумулятора, Даниэля-Якоби, щелочные аккумуляторы. Топливные элементы.
- •Электролиз. Законы электролиза Фарадея. Электродные процессы при электролизе расплавов и растворов.
- •40. Способы защиты от коррозии металлов: обработка внешней среды, защитные покрытия, электрохимическая защита, легирование, рациональное конструирование.
-
Второе начало термодинамики. Энтропия.
2 начало термодинамики: В изолированных системах самопроизвольно протекают процессы, сопровождающиеся увеличением энтропии: ∆𝑆≥𝑄𝑇 Энтропия S - термодинамическая функция состояния, которая служит мерой неупорядоченности системы.
Уравнение Больцмана:
S=k*lnW (Дж/моль*K) (число способов, которыми система может себя реализовать, вероятность)
S-энтропия, K - постоянная Больцмана, W- термодинамическая вероятность системы
Применение второго начала термодинамики к химическим процессам приводит к следующему утверждению: в закрытой системе в условиях постоянства давления и температуры возможен такой самопроизвольный процесс, который ведёт к уменьшению энергии Гиббса. Однако будет ли протекать данная реакция в действительности, зависит от значения её скорости. Огромное количество реакций термодинамический выгодно, однако практически незаметно из-за минимальной скорости реакции.
Самопроизвольный процесс всегда сопровождается S↑

S определяет меру необратимого рассеивания E. S=const при обратимых процессах.
Физический смысл имеет только ∆S, так как S-условная величина
-
Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
Самопроизвольное протекание процесса (p,T=const) определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным (TΔS), обусловленным увеличением беспорядка в системе вследствие роста ее энтропии. Разность этих термодинамических факторов является функцией состояния системы, называемой изобарно-изотермическим потенциалом или свободной энергией Гиббса (G, кДж): ΔG = ΔH – TΔS.
При ΔG<0 реакция термодинамически разрешена, и система стремится к достижению условия ΔG=0, при котором наступает равновесное состояние обратимого процесса; ΔG>0 указывает на то, что процесс термодинамически запрещен.
Проиллюстрируем эти четыре случая соответствующими реакциями:
|
ΔH < 0 ΔS > 0 ΔG < 0 |
C2H5–O–C2H5 +6O2 = 4CO2 +5H2O (реакция возможна при любой температуре) |
|
ΔH > 0 ΔS < 0 ΔG > 0 |
реакция невозможна |
|
ΔH < 0 ΔS < 0 ΔG > 0 или ΔG < 0 |
N2 +3H2 =2NH3 (возможна при низкой температуре) |
|
ΔH > 0 ΔS > 0 ΔG > 0, ΔG < 0 |
N2O4(г =2NO2(г) (возможна при высокой температуре). |
Итог: самопроизвольно могут протекать только те процессы, которые приводят к понижению свободной энергии системы; система приходит в состояние равновесия, когда свободная энергия достигает минимального значения.
-
Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
Понятие скорости химической реакции.
Скорость химической реакции – величина численно равная количеству элементарных актов химической реакции в единицу времени.
 [моль/л*с]
[моль/л*с]
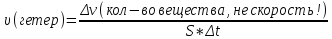 s
– площадь поверхности раздела фаз
s
– площадь поверхности раздела фаз
Скорость
химической реакции прямо пропорциональна
произведению концентраций реагирующих
веществ, взятых в некоторых степенях.
![]() ,
где k – константа скорости
(численно равна скорости реакции при
концентрациях всех реагирующих веществ,
равных 1 моль/л). По мере
протекания реакции концентрации
постоянно изменяются, поэтому в химии
часто используют понятие мгновенной
скорости, т. е. изменение концентрации
за бесконечно малый промежуток времени.
,
где k – константа скорости
(численно равна скорости реакции при
концентрациях всех реагирующих веществ,
равных 1 моль/л). По мере
протекания реакции концентрации
постоянно изменяются, поэтому в химии
часто используют понятие мгновенной
скорости, т. е. изменение концентрации
за бесконечно малый промежуток времени.
Правило
Вант-Гоффа
 –
с изменением (ростом) температуры на 2
градуса скорость химической реакции
увеличивается в 2 раза.
–
с изменением (ростом) температуры на 2
градуса скорость химической реакции
увеличивается в 2 раза.
Факторы, влияющие на химическую реакцию
-
природа реагирующих веществ,
-
наличие катализатора,
-
температура (правило Вант-Гоффа, Уравнение Аррениуса),
-
давление(P)
Принцип Ле-Шателье – если на систему, находящуюся в состоянии устойчивого равновесия оказывают воздействие один несколько факторов, стремящихся вывести ее из этого состояния, в системе усиливаются процесс по возвращению ее в исходное равновесие.
Закон действующих масс – скорость химической реакции пропорциональна концентрации вступающих в нее веществ в степенях, равных стехиометрическим коэффициентам.


Молекулярность, порядок реакции.
Молекулярность реакции – это минимальное число молекул, участвующих в элементарном химическом процессе. По молекулярности элементарные химические реакции делятся на молекулярные (А →) и бимолекулярные (А + В →); тримолекулярные (A + B + C →).
Порядок реакции – порядок реакции равен числу одновременно изменяющихся концентраций. В случае элементарных реакций порядок реакции может быть равен сумме коэффициентов в стехиометрическом уравнении реакции; однако в общем случае порядок реакции определяется только из экспериментальных данных и зависит от условий проведения реакции.
Реакции нулевого порядка
Для реакций нулевого порядка кинетическое уравнение имеет следующий вид:
![]()
Скорость реакции нулевого порядка постоянна во времени и не зависит от концентраций реагирующих веществ; это характерно для многих гетерогенных (идущих на поверхности раздела фаз) реакций в том случае, когда скорость диффузии реагентов к поверхности меньше скорости их химического превращения.
Реакции первого порядка характеризуются кинетическим уравнением вида
![]()
Ещё одной кинетической характеристикой является период полупревращения t1/2 – время, за которое концентрация исходного вещества уменьшается вдвое по сравнению с исходной.
Реакции второго порядка
Для реакций второго порядка кинетическое уравнение имеет следующий вид:
![]() либо
либо![]()
Сложными называют химические реакции, протекающие более чем в одну стадию.
Классификация химических реакций: параллельные, последовательные и сопряженные.
Параллельной реакцией называется связанная система простых реакций, имеющих одни и те же реагенты, но различные продукты. Общая скорость параллельной реакции определяется суммой скоростей её отдельных стадий
Пример параллельной реакции:

Последовательной реакцией связанная система простых реакций, в которых продукты предыдущей стадии являются реагентами последующей стадии. Общая скорость последовательной реакции определяется скоростью наиболее медленной её стадии
Пример последовательной реакции:


Сопряженные реакции, такая химические реакции, которые протекают только совместно и при наличии хотя бы одного общего реагента. Индуцирующая (вызывающая) прохождение другой реакции, называется первичной, а индуцируемая ею, или сопряжённая ей – вторичной.

-
Факторы, определяющие скорость химической реакции (закон действующих масс, правило Вант Гоффа, уравнение Аррениуса, катализаторы). Состояние активированного комплекса. Энергетический профиль реакции. Энергия активации.
На скорость химической реакции влияют факторы: состав вещества, температура, давление, количество вещества. Для гетерогенных систем также влияет дисперсность вещества (величина, показывающая какое количество частиц можно гипотетически уложить вплотную друг к другу в 1м3, т. е. чем меньше частиц, тем выше дисперсность.
Закон действующих масс в кинетической форме (основное уравнение кинетики) гласит, что скорость элементарной химической реакции пропорциональна произведению концентраций реагентов в степенях, равных стехиометрическим коэффициентам в уравнении реакции
аА + bВ = сАВ
v
= k
Эмпирическое правило Вант-Гоффа: при увеличении температуры на 10 градусов скорость химической реакции меняется в 2-4 раза
V2
= V1*

Уравнение Аррениуса:
K
= A
* exp(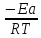 );
A
– предэкспонента, Ea
- энергия активации
);
A
– предэкспонента, Ea
- энергия активации
Катализ – использование веществ, ускоряющих химических реакций, но не участвующих в них
Суть теории переходного состояния (активированного комплекса):
-
Частицы реагентов при взаимодействии теряют свою кинетическую энергию, которая превращается в потенциальную, и для того, чтобы реакция свершилась, необходимо преодолеть некий барьер потенциальной энергии;
2) Разница между потенциальной энергией частиц и упомянутым энергетическим барьером и есть энергия активации;
3) Переходное состояние находится в равновесии с реагентами;
4) в тех реакциях, где энергия активации существенно ниже энергии разрыва химических связей, процессы образования новых связей и разрушения старых связей могут полностью или частично совпадать по времени.
Время существования активированного комплекса равно периоду колебания одной молекулы (10-13 с), поэтому он не может быть обнаружен экспериментально и, соответственно, его нельзя выделить и изучить. Следовательно, доказать истинность теории переходного состояния можно только с помощью расчетов. И для этой цели ученые задействовали самую передовую на тот момент методику, которая тогда переживала бурный расцвет - квантовую химию. Выделилось даже целое направление в квантовой химии по расчетам энергии переходного состояния.
Энергия активации в химии — эмпирически определяемый параметр, характеризующий показательную зависимость константы скорости реакции от температуры. Выражается в джоулях на моль. Энергия активации Еа — это та дополнительная энергия (к средней энергии Е сталкивающихся частиц), которая необходима, чтобы столкновение привело к химической реакции.
Ea
= -RT*ln(
R-универсальная газовая постоянная, T-температура, k-константа скорости реакции, А-предэкспонента (фактор частоты)
Переходное состояние — состояние системы, при котором уравновешены разрушение и создание связи. В переходном состоянии система находится в течение небольшого (10−15 с) времени. Энергия, которую необходимо затратить, чтобы привести систему в переходное состояние, называется энергией активации. В многоступенчатых реакциях, которые включают в себя несколько переходных состояний, энергия активации соответствует наибольшему значению энергии. После преодоления переходного состояния молекулы вновь разлетаются с разрушением старых связей и образованием новых или с преобразованием исходных связей. Оба варианта возможны, так как происходят с высвобождением энергии (это хорошо видно на рисунке, поскольку оба положения лежат энергетически ниже энергии активации). Существуют вещества, способные уменьшить энергию активации для данной реакции. Такие вещества называют катализаторами. В биологических реакциях в качестве катализаторов выступают ферменты.
Энергетический профиль реакции

-
Химическое равновесие. Обратимые и необратимые химические реакции. Закон действующих масс для равновесных процессов. Константа равновесия. Принцип Ле Шателье. Взаимосвязь термодинамических и кинетических критериев химического равновесия.
Обратимые процессы – это процессы, которые могут проходить как в прямом, так и в обратимом направлении, проходя через одинаковые промежуточные состояния, без затрат энергии.
Необратимый процесс – это процесс, который нельзя провести в противоположном направлении через все те же самые промежуточные состояния.
Необратимые: Fe+HCl→FeCl2+H2↑
Обратимые:3H2+N2↔2NH3
Особенность обратимых реакций состоит в том, что по мере накопления продуктов реакции возрастает скорость обратной реакции. Если сравняются скорости прямой и обратной реакций, то наступает равновесное состояние.
Все химические реакции можно разбить на необратимые и необратимые. Необратимые реакции протекают до конца – до полного израсходования одного из реагирующих веществ. Обратимые реакции протекают не до конца: ни одно из реагирующих веществ не расходуется полностью. Это различие связано с тем, что необратимая реакция может протекать только в одном направлении. Обратимые процессы: вначале, при смешении исходных веществ, скорость прямой реакции велика, а скорость обратной равна нулю. По мере протекания реакции исходные вещества расходуются и их концентрации падают, в результате чего уменьшается скорость реакции. Одновременно появляются продукты реакции, чья концентрация растет, и, соответственно, растет скорость обратной реакции. Когда скорости прямой и обратной реакции становятся одинаковыми, наступает химическое равновесие. Его называют динамическим равновесием, так как прямая и обратная реакции протекают, но из-за одинаковых скоростей, изменений в системе не заметно.
То есть химическим равновесием называется такое состояние химической системы, при котором количества исходных веществ и продуктов не меняются со временем(те скорости прямой и обратной реакции равны)
Закон действующих масс: для обратимой химической реакции в состоянии равновесия отношение произведений равновесных концентраций продуктов реакции в степенях их стехиометрических коэффициентов к такому же произведению для исходных веществ, есть величина постоянная при данной температуре и давлении.
Но для гетерогенных реакций с участием твердых веществ, концентрация твердых веществ в ЗДМ не учитывается.
Состояние равновесия характеризуется Kр. Константа химического равновесия есть величина постоянная при данной температуре и давлении; она не зависит от концентраций реагирующих веществ, а определяется лишь природой вещества и растворителя.
aA+вB→сС+𝑑𝐷
Kр= =
=
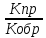 (выводится из равенства скоростей пр.
и обр. реакций vпр=kпр
(выводится из равенства скоростей пр.
и обр. реакций vпр=kпр =vобр=kобр
=vобр=kобр )
)
Численное значение константы равновесия в первом приближении характеризует выход данной реакции. Выходом реакции называется отношение количества получаемого вещества к тому его количеству, которое получилось бы при протекании реакции до конца. k>>1 выход реакции велик, k<<1 выход реакции мал. В выражение для константы равновесия входят только концентрации веществ, находящихся в жидком или газообразном состоянии. Катализатор не влияет на константу равновесия. Он может только ускорить наступление равновесия.
Принцип Ле Шателье: если на систему, находящуюся в равновесии, оказывается внешнее воздействие, то равновесие смещается в таком направлении, которое ослабляет внешнее воздействие.
1)𝑝↑ - сдвиг равновесия в сторону меньшего объёма
2)𝑇↑ - сдвиг равновесия в сторону эндотермического процесса Q<0 , ΔH>0
3)Концентрация исходных↑ - сдвиг равновесия в сторону прямой реакции
и НАОБОРОТ
Термодинамическое равновесие – состояние системы, при котором остаются неизменными от времени величины (T, P, V, S) в условиях окружающей среды.
Кинетический критерий - равенство скоростей реакции и константа равновесия, которая остается постоянной при неизменных условиях(p,T=const)
