
- •Характеристика химических свойств
- •Типы химических реакций: присоединения, разложения, обмена и замещения; кислотно-основные равновесия, окислительно-восстановительные, комплексообразования.
- •Развитие представлений о строении атома. Планетарная модель атома Резерфорда, противоречия модели. Модель строения атома водорода Бора. Условие стационарности орбит.
- •Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
- •Кривая зависимости энергии от межъядерного расстояния:
- •Обменный и донорно-акцепторный механизм образования ковалентной связи
- •Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
- •Межмолекулярные взаимодействия: ориентационные, индукционные, дисперсионные. Межмолекулярная водородная связь.
- •Периодический закон Менделеева. Физическое обоснование закона. Структура Периодической системы: периоды, ряды, группы и подгруппы. Электронные семейства.
- •Орбитальный радиус
- •I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
- •Основные понятия химической термодинамики: система, классификация термодинамических систем, термодинамические параметры, гомогенные и гетерогенные системы.
- •Внутренняя энергия. Классификация термодинамических процессов. Первое начало термодинамики. Закон Гесса. Следствие из закона Гесса.
- •Второе начало термодинамики. Энтропия.
- •Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
- •Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
- •Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- •Способы выражения концентрации растворов: массовая, объемная, молярная, молярная эквивалентов, мольная, моляльность.
- •Коллигативные свойства растворов. Закон Рауля. Эбулиоскопия и криоскопия.
- •Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
- •Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
- •Константа диссоциации, закон разбавления Оствальда.
- •Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
- •1) Произведение растворимости
- •Гидролиз. Различные случаи частичного гидролиза солей.
- •Случаи необратимого гидролиза солей. Взаимоусиливающий гидролиз.
- •Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
- •Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
- •Типичные окислители и восстановители. Метод ионно-электронных схем.
- •Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
- •Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
- •Химическая стойкость металлов в растворах солей.
- •Электрохимические процессы и системы. Двойной электрический слой.
- •Химические источники тока. Батарейки и аккумуляторы. Процессы при разрядке и зарядке свинцового аккумулятора, Даниэля-Якоби, щелочные аккумуляторы. Топливные элементы.
- •Электролиз. Законы электролиза Фарадея. Электродные процессы при электролизе расплавов и растворов.
- •40. Способы защиты от коррозии металлов: обработка внешней среды, защитные покрытия, электрохимическая защита, легирование, рациональное конструирование.
-
Типичные окислители и восстановители. Метод ионно-электронных схем.
Химические вещества можно разделить на типичные окислители, типичные восстановители, и вещества, которые могут проявлять и окислительные, и восстановительные свойства.
Окислителями могут быть прежде всего соединение высших, а восстановителями – низших степеней окисления, присущих данному элементу.
К типичным окислителям относят:
1. простые вещества-неметаллы с наиболее сильными окислительными свойствами (F2, O2, Cl2)
2. сложные вещества, в составе которых есть ионы металлов и неметаллов с высокими положительными (как правило, высшими) степенями окисления: кислоты (HN+5O3, HCl+7O4), соли (KN+5O3, KMn+7O4), оксиды (S+6O3, Cr+6O3)
3. соединения, содержащие некоторые катионы металлов, имеющих высокие степени окисления: Pb4+, Fe3+, Au3+
К типичным восстановителям относят:
1. простые вещества-металлы (Al, Mg, K)
2. сложные вещества, в составе которых есть атомы или ионы неметаллов с отрицательный (как правило, низшей) степенью окисления: бинарные водородные соединения (H2S, HBr), соли бескислородных кислот (K2S, NaI)
3. некоторые соединения, содержащие катионы с минимальной положительной степенью окисления (Sn2+, Fe2+, Cr2+), которые, отдавая электроны, могут повышать свою степень окисления
4. Соединения, содержащие сложные ионы, состоящие из неметаллов с промежуточной положительной степенью окисления (S+4O3)2- , (HP+3O3)2- , в которых элементы могут, отдавая электроны, повышать свою положительную степень окисления.
Большинство остальных веществ может проявлять как окислительные, так и восстановительные свойства
Метод ионно-электронных схем. Метод полуреакций, рассмотренный в предыдущем вопросе. Метод применяется при уравнивании реакций, протекающих в растворах. (не обязательно знать продукты реакции)
Запишем исходные вещества, реакции окисления сульфита калия дихроматом калия в ионно-молекулярной форме

Известно, что в кислой среде дихромат-ион, восстанавливаясь, переходит в ион хрома Cr+2, а сульфит-ион, окисляясь, превращается в сульфат-ион.


Цель дальнейших действий заключается в том, чтобы в данных полуреакциях вместо стрелок можно было поставить знаки равенства. Это можно будет сделать, когда в левой и правой частях каждой полуреакции будут совпадать виды элементов, число их атомов и суммарные заряды всех частиц




Теперь уравнены все элементы. Осталось уравнять заряды.
 (Восстановление)
(Восстановление)
 (Окисление)
(Окисление)
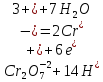 | 1
| 1
 | 3
| 3
Умножая на полученные коэффициенты все члены уравнений полуреакции и суммируя между собой только правые и только левые части получаем уравнение реакции в ионно-молекулярной форме:


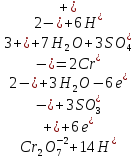
Сокращая подобные члены получаем:

-
Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
Устройства, которые применяют для непосредственного преобразования энергии химической реакции в электрическую энергию, называются гальваническими элементами, химическими источниками электрической энергии или химическими источниками тока (ХИТ).
Работа ХИТ основывается на переходе электронов от восстановителя к окислителю.
 - максимальное
значение напряжения гальванического
элемента (ЭДС)
- максимальное
значение напряжения гальванического
элемента (ЭДС)
В соответствии с разделением окислительно-восстановительной реакции на две полуреакции, напряжение (ЭДС) также принято представлять в виде разности двух величин, каждая из которых отвечает данной полуреакции. Эти величины называются электродными потенциалами или электродными напряжениями.
Для медно-цинкового элемента реакция, протекающая при его работе

Разбивается на полуреакции

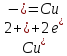
Напряжение
этого элемента
 можно представить как разность электродных
потенциалов (φ)
можно представить как разность электродных
потенциалов (φ)


Уравнение Нернста. Выражает зависимость потенциалов различных электродных процессов от 1. природы веществ 2. от соотношения между концентрациями этих веществ 3. от температуры системы .

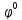 – стандартный
электродный потенциал данного процесса
– константа.
– стандартный
электродный потенциал данного процесса
– константа.
R – газовая постоянная. T – абсолютная температура. n – число электронов, принимающих участие в процессе. F – постоянная Фарадея. [Ox] и [Red] – произведения концентраций веществ, участвующих в процессе в окисленной (Ox) и восстановленной (Red) формах.
Для обычной при электрохимических измерениях стандартной температуры и при подстановке всех постоянных величин уравнение принимает вид:

Критерий направленности ОВР
Если в реакционной смеси присутствуют два окислителя и два восстановителя, то направление реакции определяется тем, какой из окислителей в данных условиях в соответствии с уравнением Нернста окажется более сильным.
Стандартный
потенциал окислительно-восстановительной
пары, в которой окисленной формой
является выбранный нами окислитель
назовём потенциалом окислителя
 ,
а стандартный потенциал другой пары, в
которой востановленной формой является
выбранный нами восстановитель –
потенциалом восстановителя
,
а стандартный потенциал другой пары, в
которой востановленной формой является
выбранный нами восстановитель –
потенциалом восстановителя

 назовём эту величину
стандартной разностью
окислительно-восстановительных
потенциалов
назовём эту величину
стандартной разностью
окислительно-восстановительных
потенциалов
Если
 ,
реакция протекает в прямом направлении.
,
реакция протекает в прямом направлении.
Если
 ,
то в обратном.
,
то в обратном.
