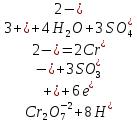- •Характеристика химических свойств
- •Типы химических реакций: присоединения, разложения, обмена и замещения; кислотно-основные равновесия, окислительно-восстановительные, комплексообразования.
- •Развитие представлений о строении атома. Планетарная модель атома Резерфорда, противоречия модели. Модель строения атома водорода Бора. Условие стационарности орбит.
- •Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
- •Кривая зависимости энергии от межъядерного расстояния:
- •Обменный и донорно-акцепторный механизм образования ковалентной связи
- •Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
- •Межмолекулярные взаимодействия: ориентационные, индукционные, дисперсионные. Межмолекулярная водородная связь.
- •Периодический закон Менделеева. Физическое обоснование закона. Структура Периодической системы: периоды, ряды, группы и подгруппы. Электронные семейства.
- •Орбитальный радиус
- •I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
- •Основные понятия химической термодинамики: система, классификация термодинамических систем, термодинамические параметры, гомогенные и гетерогенные системы.
- •Внутренняя энергия. Классификация термодинамических процессов. Первое начало термодинамики. Закон Гесса. Следствие из закона Гесса.
- •Второе начало термодинамики. Энтропия.
- •Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
- •Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
- •Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- •Способы выражения концентрации растворов: массовая, объемная, молярная, молярная эквивалентов, мольная, моляльность.
- •Коллигативные свойства растворов. Закон Рауля. Эбулиоскопия и криоскопия.
- •Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
- •Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
- •Константа диссоциации, закон разбавления Оствальда.
- •Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
- •1) Произведение растворимости
- •Гидролиз. Различные случаи частичного гидролиза солей.
- •Случаи необратимого гидролиза солей. Взаимоусиливающий гидролиз.
- •Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
- •Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
- •Типичные окислители и восстановители. Метод ионно-электронных схем.
- •Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
- •Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
- •Химическая стойкость металлов в растворах солей.
- •Электрохимические процессы и системы. Двойной электрический слой.
- •Химические источники тока. Батарейки и аккумуляторы. Процессы при разрядке и зарядке свинцового аккумулятора, Даниэля-Якоби, щелочные аккумуляторы. Топливные элементы.
- •Электролиз. Законы электролиза Фарадея. Электродные процессы при электролизе расплавов и растворов.
- •40. Способы защиты от коррозии металлов: обработка внешней среды, защитные покрытия, электрохимическая защита, легирование, рациональное конструирование.
-
Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
Количественно гидролиз соли характеризуется степенью гидролиза h и константой гидролиза К.
Степень гидролиза. Показателем глубины протекания гидролиза является степень гидролиза. Доля вещества, подвергшегося гидролизу, называется степенью гидролиза:

где h - степень гидролиза;
n- количество прогидролизованных частиц;
N - общее число молекул вещества.
Степень гидролиза зависит от температуры, концентрации соли, константы гидролиза.
Константа гидролиза.
Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
 , где МА - соль; НА
- кислота; МОН – основание.
, где МА - соль; НА
- кислота; МОН – основание.
Её значение характеризует способность данной соли подвергаться гидролизу. Чем больше Кг, тем в большей степени протекает гидролиз.
В общем случае для соли, образованной слабой кислотой и сильным основанием:
![]() ,
где
,
где ![]() —
константа диссоциации слабой кислоты,
образующейся при гидролизе
—
константа диссоциации слабой кислоты,
образующейся при гидролизе
Для соли, образованной сильной кислотой и слабым основанием:
![]() ,
где
,
где ![]() —
константа диссоциации слабого основания,
образующегося при гидролизе
—
константа диссоциации слабого основания,
образующегося при гидролизе
Для соли, образованной слабой кислотой и слабым основанием:
![]()
Кг зависит от природы соли и температуры.
Так как гидролиз, процесс обратимый, его можно усиливать или замедлять, т. е. смещать равновесие. Нагревание раствора соли гидролиз усиливает, идут вторая и последующие стадии гидролиза, смещение равновесия происходит вправо. Разбавление раствора приводит к усилению гидролиза, концентрирование – к подавлению гидролиза.
Усилить или подавить гидролиз можно добавляя к раствору соли кислоту или щелочь. Например, если гидролиз идет по аниону:
CO32– + H2O⇆HCO3– + OH−
а) при добавлении к раствору соли кислоты, ионы Н+ связывают гидроксогруппы воды. Концентрация гидроксо групп уменьшается, равновесие смещается вправо, т. е. происходит усиление гидролиза;
б) при добавлении к раствору соли щелочи (OH−) концентрация гидроксогрупп возрастает, равновесие смещается влево, т. е. подавление гидролиза.
Чем меньше значение Кгидр, тем интенсивнее гидролиз, тем сильнее соль подвергается гидролизу.
-
Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
Ковалентность – число ковалентных связей, посредством которых данный атом связан с другими атомами. Или же количество электронов, которое атом может разделить с другим атомом.
Электровалентность атома – величина заряда, образованного при смещении электронной плотности химической связи. Или же число электронов, которое атом либо получает, либо теряет при образовании иона.
При повышении полярности связи ковалентность атома убывает, а электровалентность – возрастает, в предельном случае полярной связи – ионной – связывающая электронная плотность полностью смещена к более электроотрицательному атому. Ковалентная составляющая связи отсутствует, электровалентность максимальна.
Валентность
– сумма ковалентности и модуля
электровалентности. (из рисунка видно,
что остаётся постоянной.
Степень окисления – валентность атома со знаком его электровалентности.
Окислительно-восстановительные реакции
Реакции, в результате которых изменяются степени окисления элементов называются окислительно-восстановительными.
 протекает в несколько
стадий
протекает в несколько
стадий
 степень окисления
натрия изменяется от 0 до +1
степень окисления
натрия изменяется от 0 до +1
Окисление – процесс отдачи электронов, сопровождающийся повышением степени окисления.
 степень окисления
хлора изменяется от 0 до -1
степень окисления
хлора изменяется от 0 до -1
Восстановление – присоединение электронов, сопровождающееся понижением степени окисления элемента.
Окислители – атомы, молекулы или ионы, присоединяющие электроны
Восстановители – атомы, молекулы или ионы, отдающие электроны
Основные типы ОВР
1. Межмолекулярные. Окислитель и восстановитель водят в состав разных веществ.
2. Внутримолекулярные. Окислитель и восстановитель входят в состав одного вещества.

3. Реакции диспропорционирования. Реакции, в которых один и тот же элемент выступает и как окислитель, и как восстановитель. (внутримолекулярное окисление-восстановление)

4. Реакции контрдиспропорционирования. Реакции, в которых из двух различных степеней окисления одного и того же элемента получается одна степень окисления

Составление уравнений ОВР (не уверен, что это нужно)
Метод электронного баланса. Заключается в выполнении следующего правила: число электронов, отданных всеми частицами восстановителей, всегда равно числу электронов, присоединённых всеми частицами окислителей в данной реакции.
1. Определяются изменяющиеся степени окисления элементов

и условно записывают процессы окисления и восстановления элементов
окислитель Cr+6 ⟶ Cr+3 – восстановленная форма; процесс восстановления
восстановитель S+4 ⟶ S+6 – окисленная форма; процесс окисления
2. Составляется электронный баланс. Подсчитывается число электронов, которое нужно присоединить всеми атомами окислителя и прибавляют их в левой части схемы процесса восстановления (следить за кол-вом атомов). Аналогично поступаем с восстановителем, только теперь в левой части схемы отнимаем электроны:


Электронный баланс достигается, когда числа электронов в каждой из этих схем, взятых целое число раз, равны друг другу. Молекула восстановителя присоединяет в 3 раза меньше электронов, поэтому этот процесс должен осуществляться в 3 раза чаще
 | 1
| 1
 | 3
| 3
3. Полученные коэффициенты ставим перед окислителем и восстановителем в левой части уравнения и перед продуктами их восстановления и окисления в правой части

4. (Можно сказать, что дальше уравнивается всё остальное) уравнивают ионы металла, не изменяющие своей степени окисления

5. Определяют коэффициент перед средой.
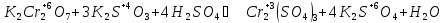
6. Уравнивают число атомов водорода

7. Проверяется правильность подбора коэффициентов
Метод полуреакций. Метод применяется при уравнивании реакций, протекающих в растворах. (не обязательно знать продукты реакции)
Запишем исходные вещества, реакции окисления сульфита калия дихроматом калия в ионно-молекулярной форме

Известно, что в кислой среде дихромат-ион, восстанавливаясь, переходит в ион хрома Cr+2, а сульфит-ион, окисляясь, превращается в сульфат-ион.
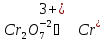

Цель дальнейших действий заключается в том, чтобы в данных полуреакциях вместо стрелок можно было поставить знаки равенства. Это можно будет сделать, когда в левой и правой частях каждой полуреакции будут совпадать виды элементов, число их атомов и суммарные заряды всех частиц
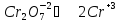

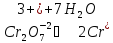

Теперь уравнены все элементы. Осталось уравнять заряды.
 (Восстановление)
(Восстановление)
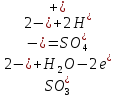 (Окисление)
(Окисление)
 | 1
| 1
 | 3
| 3
Умножая на полученные коэффициенты все члены уравнений полуреакции и суммируя между собой только правые и только левые части получаем уравнение реакции в ионно-молекулярной форме:


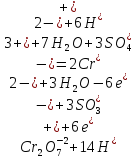
Сокращая
подобные члены получаем: