
- •Характеристика химических свойств
- •Типы химических реакций: присоединения, разложения, обмена и замещения; кислотно-основные равновесия, окислительно-восстановительные, комплексообразования.
- •Развитие представлений о строении атома. Планетарная модель атома Резерфорда, противоречия модели. Модель строения атома водорода Бора. Условие стационарности орбит.
- •Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
- •Кривая зависимости энергии от межъядерного расстояния:
- •Обменный и донорно-акцепторный механизм образования ковалентной связи
- •Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
- •Межмолекулярные взаимодействия: ориентационные, индукционные, дисперсионные. Межмолекулярная водородная связь.
- •Периодический закон Менделеева. Физическое обоснование закона. Структура Периодической системы: периоды, ряды, группы и подгруппы. Электронные семейства.
- •Орбитальный радиус
- •I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
- •Основные понятия химической термодинамики: система, классификация термодинамических систем, термодинамические параметры, гомогенные и гетерогенные системы.
- •Внутренняя энергия. Классификация термодинамических процессов. Первое начало термодинамики. Закон Гесса. Следствие из закона Гесса.
- •Второе начало термодинамики. Энтропия.
- •Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
- •Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
- •Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- •Способы выражения концентрации растворов: массовая, объемная, молярная, молярная эквивалентов, мольная, моляльность.
- •Коллигативные свойства растворов. Закон Рауля. Эбулиоскопия и криоскопия.
- •Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
- •Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
- •Константа диссоциации, закон разбавления Оствальда.
- •Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
- •1) Произведение растворимости
- •Гидролиз. Различные случаи частичного гидролиза солей.
- •Случаи необратимого гидролиза солей. Взаимоусиливающий гидролиз.
- •Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
- •Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
- •Типичные окислители и восстановители. Метод ионно-электронных схем.
- •Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
- •Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
- •Химическая стойкость металлов в растворах солей.
- •Электрохимические процессы и системы. Двойной электрический слой.
- •Химические источники тока. Батарейки и аккумуляторы. Процессы при разрядке и зарядке свинцового аккумулятора, Даниэля-Якоби, щелочные аккумуляторы. Топливные элементы.
- •Электролиз. Законы электролиза Фарадея. Электродные процессы при электролизе расплавов и растворов.
- •40. Способы защиты от коррозии металлов: обработка внешней среды, защитные покрытия, электрохимическая защита, легирование, рациональное конструирование.
-
Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
Коллигативные свойства растворов см в билете 22.
Закон Генри – растворимость газа в жидкостях и в твёрдых веществах при постоянной температуре прямо пропорционально давлению. Закон пригоден лишь для идеальных растворов и невысоких давлений.
ωi = kpi
wi – концентрация газа в насыщенном растворе
pi – парциальное давление
k – постоянная Генри, зависит от природы, растворителя и температуры, моль\л
Закон Вант-Гоффа – осмотическое давление прямо пропорционально моляльной концентрации растворимого вещества
Pосм = cRT
Осмос – это перенос молекул растворителя через полупроницаемую мембрану в сторону более концентрированного раствора, а молекул растворённого вещества – в сторону менее концентрированного раствора.

Давление столба раствора называется осмотическим давлением. Его значение может быть найдено по уравнению Вант–Гоффа:
 ,
,
где
 – концентрация растворенного вещества
(моль/л);
– концентрация растворенного вещества
(моль/л);
 – газовая постоянная;
– газовая постоянная;
 – температура.
– температура.
-
Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
Электролиты — вещества, расплавы или растворы которых проводят электрический ток вследствие диссоциации на ионы.
Для объяснения особенностей свойств растворов электролитов С. Аррениус предложил теорию электролитической диссоциации, основывающуюся на том, что электролиты в растворах распадаются па ионы — диссоциируют.
Диссоциация
электролитов в растворе происходит под
действием полярных молекул растворителя;
наличие ионов в растворе предопределяет
его электропроводность. Для оценки
полноты диссоциации в теории
электролитической диссоциации вводится
понятие степени
диссоциации
 ,
которая равна отношению числа молекул
n,
распавшихся на ионы, к общему числу
молекул N:
,
которая равна отношению числа молекул
n,
распавшихся на ионы, к общему числу
молекул N:

Величина
степени диссоциации
зависит от природы растворителя и
растворенного вещества, концентрации
раствора и температуры. По величине
степени диссоциации электролиты
подразделяются на три группы: сильные
( > 0,7), средней силы (0,3 <
> 0,7), средней силы (0,3 <
 < 0,7) и слабые (
< 0,7) и слабые ( < 0,3). К
сильным
электролитам относятся почти все соли
(кроме РЬ(СН3СОО)2,
HgCl2,
CdCl2),
большинство неорганических кислот и
щелочей; к
слабым
— все органические кислоты, вода, NH4OH,
H2S
и т.д. Электролитами средней
силы являются некоторые неорганические
кислоты: HF, HCN, Н3Р04.
< 0,3). К
сильным
электролитам относятся почти все соли
(кроме РЬ(СН3СОО)2,
HgCl2,
CdCl2),
большинство неорганических кислот и
щелочей; к
слабым
— все органические кислоты, вода, NH4OH,
H2S
и т.д. Электролитами средней
силы являются некоторые неорганические
кислоты: HF, HCN, Н3Р04.
Изотонический коэффициент(i) — это отношение числа всех частиц в растворе к числу растворенных частиц. Он связан со степенью диссоциации электролита:
i
= 1 +
 (v
– 1),
(v
– 1),
где – v количество ионов, образующихся при диссоциации одной молекулы. Изотонический коэффициент для растворов электролитов всегда больше единицы, причем с разбавлением раствора i возрастает до некоторого целочисленного значения.
-
Константа диссоциации, закон разбавления Оствальда.
Константа диссоциации (1)— вид константы равновесия, которая характеризует склонность объекта диссоциировать (разделяться) обратимым образом на частицы, как, например, когда комплекс распадается на составляющие молекулы, или когда соль диссоциирует в водном растворе на ионы (Вики).
Константа диссоциации (2) – константа равновесия, отвечающая диссоциации слабого электролита (Глинка).
Это отношение произведения концентраций ионов продиссоциировавших молекул к концентрации непродиссоциировавших молекул.
Для характеристики слабых электролитов применяют константу диссоциации (Kд). Вследствие того, что слабые электролиты диссоциируют на ионы не полностью, в их растворах устанавливается динамическое равновесие между недиссоциированными молекулами и ионами. Для слабого электролита общей формулы АnВm уравнение диссоциации имеет вид:

Применяя закон действующих масс, запишем выражение константы равновесия:
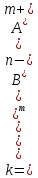
где [Аm+], [Bn— ] — равновесные концентрации ионов Аm+ и Bn— (продукты диссоциации).
[АnВm] — равновесная концентрация недиссоциированных молекул АnВm
Рассмотрим на примере уксусной кислоты:

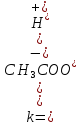
Величина К зависит от природы электролита и растворителя, а также от температуры, но не зависит от концентрации раствора. Она характеризует способность данной кислоты или данного основания распадаться на ионы: чем выше К, тем легче электролит диссоциирует.



Это уравнение выражает закон разбавления Оствальда. Оно дает возможность вычислять степень диссоциации при различных концентрациях электролита, если известна его константа диссоциации. Пользуясь этим уравнением, можно также вычислить константу диссоциации электролита, зная его степень диссоциации при той или иной концентрации.
Для
растворов, в которых диссоциация
электролита очень мала, уравнение закона
Оствальда упрощается. Поскольку в таких
случаях a 1,
то величиной а в знаменателе правой
части уравнения можно пренебречь. При
этом уравнение принимает вид:
1,
то величиной а в знаменателе правой
части уравнения можно пренебречь. При
этом уравнение принимает вид:
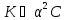 или
или

Это уравнение наглядно показывает связь, существующую между концентрацией слабого электролита и степенью его диссоциации: степень диссоциации, возрастает при разбавлении раствора.
Полученный вывод вытекает из природы явления диссоциации. Как всякое химическое равновесие, равновесие в растворе слабого электролита является динамическим, т. е. при его установлении протекают с равными скоростями два процесса: процесс диссоциации и обратный ему процесс образования молекул из ионов. При этом разбавление раствора не препятствует первому из этих процессов — диссоциации. Однако процесс образования молекул из ионов в результате разбавления затрудняется: для образования молекулы должно произойти столкновение ионов, вероятность которого с разбавлением уменьшается.
