
- •Характеристика химических свойств
- •Типы химических реакций: присоединения, разложения, обмена и замещения; кислотно-основные равновесия, окислительно-восстановительные, комплексообразования.
- •Развитие представлений о строении атома. Планетарная модель атома Резерфорда, противоречия модели. Модель строения атома водорода Бора. Условие стационарности орбит.
- •Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
- •Кривая зависимости энергии от межъядерного расстояния:
- •Обменный и донорно-акцепторный механизм образования ковалентной связи
- •Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
- •Межмолекулярные взаимодействия: ориентационные, индукционные, дисперсионные. Межмолекулярная водородная связь.
- •Периодический закон Менделеева. Физическое обоснование закона. Структура Периодической системы: периоды, ряды, группы и подгруппы. Электронные семейства.
- •Орбитальный радиус
- •I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
- •Основные понятия химической термодинамики: система, классификация термодинамических систем, термодинамические параметры, гомогенные и гетерогенные системы.
- •Внутренняя энергия. Классификация термодинамических процессов. Первое начало термодинамики. Закон Гесса. Следствие из закона Гесса.
- •Второе начало термодинамики. Энтропия.
- •Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
- •Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
- •Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- •Способы выражения концентрации растворов: массовая, объемная, молярная, молярная эквивалентов, мольная, моляльность.
- •Коллигативные свойства растворов. Закон Рауля. Эбулиоскопия и криоскопия.
- •Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
- •Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
- •Константа диссоциации, закон разбавления Оствальда.
- •Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
- •1) Произведение растворимости
- •Гидролиз. Различные случаи частичного гидролиза солей.
- •Случаи необратимого гидролиза солей. Взаимоусиливающий гидролиз.
- •Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
- •Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
- •Типичные окислители и восстановители. Метод ионно-электронных схем.
- •Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
- •Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
- •Химическая стойкость металлов в растворах солей.
- •Электрохимические процессы и системы. Двойной электрический слой.
- •Химические источники тока. Батарейки и аккумуляторы. Процессы при разрядке и зарядке свинцового аккумулятора, Даниэля-Якоби, щелочные аккумуляторы. Топливные элементы.
- •Электролиз. Законы электролиза Фарадея. Электродные процессы при электролизе расплавов и растворов.
- •40. Способы защиты от коррозии металлов: обработка внешней среды, защитные покрытия, электрохимическая защита, легирование, рациональное конструирование.
1) Произведение растворимости
Вещества, в зависимости от своей природы, обладают различной растворимостью в воде, которая колеблется от долей миллиграмма до сотен граммов на литр. Трудно растворимые электролиты образуют насыщенные растворы очень маленьких концентраций, поэтому можно считать, что степень их диссоциации достигает единицы. Таким образом, насыщенный раствор труднорастворимого электролита представляет собой систему, состоящую из собственно раствора, находящегося в равновесии с осадком растворенного вещества. При постоянных внешних условиях скорость растворения осадка равна скорости процесса кристаллизации:
КnАm ↔ n К+m(осадок) + mA-n(раствор)
Для описания этого гетерогенного равновесного процесса используют константу равновесия, называемую произведением растворимости ПР=[K+m]n[A-n]m, где [K+m] и [A-n] – концентрации ионов в насыщенном растворе (моль/л).
Например:
AgCl= Ag+ +Cl-, ПР = [Ag+] [Cl-]; здесь n=m=1.
PbI2 = Pb2+ +2I-, ПР =[Pb2+] [I-]2; здесь n=1, m=2.
ПР зависит от природы растворенного вещества и температуры. ПР является табличной величиной. Зная ПР, можно вычислить концентрацию насыщенного раствора вещества, а также оценить его растворимость в г. на 100 мл воды (величина S, приводимая в справочной литературе) и определить возможности выпадения вещества в осадок. Для уравнения (1) взаимосвязь концентрации насыщенного раствора трудно растворимого вещества (См, моль/л) с величиной ПР определяется следующим уравнением:

где n и m –стехиометрические коэффициенты в ур. 1.
2) Условие образования осадка: произведение молярных концентраций ионов, возведенных в степень стехиометрических коэффициентов (ПК), должно быть больше величины произведения растворимости (ПР):
AnBm « nAm+ + mBn–
ПК(AnBm) = (CA+m)n•(CB–n)m > ПР(AnBm)
Если ПК(AnBm) < ПР(AnBm), то осадок не образуется. Следовательно, зная концентрации ионов малорастворимого электролита в растворе, можно ориентировочно оценить, выпадет ли в данном случае осадок.
3) Переосаждение – приём борьбы с окклюдированными примесями. Осадок растворяют в подходящем растворителе (растворе кислоты и т. п.) и снова осаждают. Так как основной причиной окклюзии является захват посторонних веществ в процессе роста, то ясно, что количество примесей в повторно осажденном осадке будет меньше.
4) Комплексные (координационные) соединения составляют обширную группу веществ высшего порядка неорганического и органического происхождения. Они обеспечивают жизнь: гемоглобин – комплексное соединение железа – переносит кислород из лёгких в ткани, хлорофилл – комплексное соединение магния – отвечает за фотосинтез в растениях витамин В12 – комплексное соединение кобальта и т. д. Свойства и строение комплексных соединений объясняет координационная теория Вернера (1893 г., Швейцария).
Комплексное соединение – это вещество, в узлах кристаллической решётки которого находятся сложные частицы (комплексные ионы или молекулы), построенные за счёт координации одним атомом обычных молекул и ионов; эти частицы способны существовать и при переходе вещества в растворённое или расплавленное состояние. Комплексное соединение, как правило, состоит из двух сфер – внутренней и внешней.
Комплексный ион (или внутренняя сфера комплексного соединения) – частица, состоящая из комплексообразователя – обычного иона d- или f- металла в определённой степени окисления, и окружающих его лигандов - противоположно заряженных ионов или нейтральных молекул.
II К4[PtCl6] гексахлороплатинат (II) калия
I [Ag(NH3)2]Cl хлорид диамминсеребра (I)
Комплексный ион сохраняет в значительной степени стабильность при растворении, его границы показывают квадратными скобками.
Заряд внутренней сферы равен алгебраической сумме зарядов комплексообразователя и лигандов:
III
[Fe(CN)6]x +3 + 6(-1) = x x = -3
Если известен заряд внутренней сферы и лигандов, легко определить заряд комплексообразователя:
X
[Pt(NH3)4Cl2]+2 x + 4·0 + 2(-1) = +2 x = +4
Ионы, не разместившиеся во внутренней сфере, более удалены от центрального атома, они составляют внешнюю сферу. Связь внутренней сферы с внешней ионогенная, она легко расщепляется в водном растворе, – т. е. это диссоциация сильного электролита:

[Cu(NH3)4]SO4 [Cu(NH3)4]2+ + SO42-
Ковалентная связь между комплексообразователем и лигандами значительно прочнее, она имеет донорно-акцепторное происхождение.

1)Константа равновесия химической реакции равна отношению произведений равновесных парциальных давлений продуктов реакции в степени их стехиометрических коэффициентов к произведению равновесных парциальных давлений исходных веществ в степени их стехиометрических коэффициентов.
Для равновесной реакции, протекающей в газовой фазе
аА + bB = cC + dD,


2) Выражение константы равновесия через равновесные молярные концентрации компонентов (Кс):
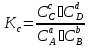
Связь констант химического равновесия:

Δν - изменение стехиометрических коэффициентов реагирующих веществ.
3)Выражение константы равновесия через равновесные мольные доли компонентов (Кх):


4)Выражение константы равновесия через фугитивность (для смеси реальных газов) (Кf):

где fi – равновесные фугитивности компонентов
5)Выражение константы равновесия через активность (для реальных растворов) (Ка):

где аi – равновесные активности компонентов
