
- •Характеристика химических свойств
- •Типы химических реакций: присоединения, разложения, обмена и замещения; кислотно-основные равновесия, окислительно-восстановительные, комплексообразования.
- •Развитие представлений о строении атома. Планетарная модель атома Резерфорда, противоречия модели. Модель строения атома водорода Бора. Условие стационарности орбит.
- •Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
- •Кривая зависимости энергии от межъядерного расстояния:
- •Обменный и донорно-акцепторный механизм образования ковалентной связи
- •Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
- •Межмолекулярные взаимодействия: ориентационные, индукционные, дисперсионные. Межмолекулярная водородная связь.
- •Периодический закон Менделеева. Физическое обоснование закона. Структура Периодической системы: периоды, ряды, группы и подгруппы. Электронные семейства.
- •Орбитальный радиус
- •I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
- •Основные понятия химической термодинамики: система, классификация термодинамических систем, термодинамические параметры, гомогенные и гетерогенные системы.
- •Внутренняя энергия. Классификация термодинамических процессов. Первое начало термодинамики. Закон Гесса. Следствие из закона Гесса.
- •Второе начало термодинамики. Энтропия.
- •Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
- •Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
- •Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- •Способы выражения концентрации растворов: массовая, объемная, молярная, молярная эквивалентов, мольная, моляльность.
- •Коллигативные свойства растворов. Закон Рауля. Эбулиоскопия и криоскопия.
- •Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
- •Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
- •Константа диссоциации, закон разбавления Оствальда.
- •Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
- •1) Произведение растворимости
- •Гидролиз. Различные случаи частичного гидролиза солей.
- •Случаи необратимого гидролиза солей. Взаимоусиливающий гидролиз.
- •Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
- •Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
- •Типичные окислители и восстановители. Метод ионно-электронных схем.
- •Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
- •Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
- •Химическая стойкость металлов в растворах солей.
- •Электрохимические процессы и системы. Двойной электрический слой.
- •Химические источники тока. Батарейки и аккумуляторы. Процессы при разрядке и зарядке свинцового аккумулятора, Даниэля-Якоби, щелочные аккумуляторы. Топливные элементы.
- •Электролиз. Законы электролиза Фарадея. Электродные процессы при электролизе расплавов и растворов.
- •40. Способы защиты от коррозии металлов: обработка внешней среды, защитные покрытия, электрохимическая защита, легирование, рациональное конструирование.
-
Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
Сильные электролиты — это такие электролиты, которые в водных растворах полностью диссоциируют на ионы, т. е. их степень диссоциации равна 1 (100%). К сильным электролитам относятся: 1) соли; 2) сильные кислоты (HClO4, НСlO3, НNО3, H2SO4, HCl, НВr, HI и др.); 3) щелочи (LiОН, NaOH, КОН, RbOH, СsОН, Ca(OH)2, Sr(OH)2, Ba(OH)2.
В водных растворах сильные электролиты обычно полностью диссоциированы, поэтому число ионов в них больше, чем в растворах слабых электролитов той же концентрации. Если в растворах слабых электролитов концентрация ионов мала, расстояния между ними велики и взаимодействие ионов друг с другом незначительно, то в не очень разбавленных растворах сильных электролитов среднее расстояние между ионами вследствие значительной концентрации сравнительно мало. Например, в насыщенном растворе хлорида натрия среднее расстояние между ионами всего только в 2 раза больше, чем в кристаллах NaCl. При этом силы межионного притяжения и отталкивания довольно велики. В таких растворах ионы не вполне свободны, движение их стеснено взаимным притяжением друг к другу. Благодаря этому притяжению каждый ион как бы окружен шарообразным роем противоположно заряженных ионов, получившим название «ионной атмосферы».
В
отсутствие внешнего электрического
поля ионная атмосфера симметрична и
силы, действующие на центральный ион,
взаимно уравновешиваются. Если же
приложить к раствору постоянное
электрическое поле, то разноименно
заряженные ионы будут перемещаться в
противоположных направлениях. При этом
каждый ион стремится двигаться в одну
сторону, а окружающая его ионная атмосфера
— в противоположную, вследствие чего
направленное перемещение иона замедляется,
а следовательно, уменьшается число
ионов, проходящих через раствор в единицу
времени, т.е. сила тока. Чем больше
концентрация раствора, тем сильнее
проявляется тормозящее действие ионной
атмосферы на электрическую проводимость
раствора. Значения степени диссоциации
хлорида калия, вычисленные при 18 °С по
электрической проводимости его растворов,
показывают, что с ростом концентрации
α падает
Однако падение степени диссоциации объясняется не образованием молекул, а увеличением тормозящего действия ионной атмосферы. В связи с этим определяемое по электрической проводимости (или другими методами) значение степени диссоциации сильных электролитов называется кажущейся степенью диссоциации.
Аналогично силы межионного притяжения и отталкивания влияют и на величину осмотического давления, которая, несмотря на полную диссоциацию, все же меньше, чем следовало бы ожидать при удвоенном, утроенном и большем числе частиц. Следовательно, все свойства раствора электролита, зависящие от концентрации ионов, проявляются так, как если бы число ионов в растворе было меньше, чем это соответствует полной диссоциации электролита.
Для
оценки состояния ионов в растворе
пользуются величиной, называемой
активностью (та
эффективная, условная концентрация
раствора, соответственно которой он
действует при химических реакциях).Активность
иона а
равна его концентрации С,
умноженной на коэффициент
активности f:

Коэффициенты активности различных ионов различны. Кроме того, они изменяются при изменении условий, в частности при изменении концентрации раствора. В концентрированных растворах коэффициент активности обычно меньше единицы, а с разбавлением раствора он приближается к единице. Значение f, меньшее единицы, указывает на взаимодействие между ионами, приводящее к их взаимному связыванию. Если же коэффициент активности близок к единице, то это свидетельствует о слабом межионном взаимодействии. Действительно, в очень разбавленных растворах средние расстояния между ионами настолько велики, что действие межионных сил почти не проявляется.
В разбавленных растворах природа ионов мало влияет на значения их коэффициентов активности. Приближенно можно считать, что коэффициент активности данного иона зависит только от его заряда и от ионной силы раствора I, под которой понимают полусумму произведений концентраций всех находящихся в растворе ионов на квадрат их заряда:

Вычислим
ионную силу раствора, содержащего 0,1
моль/л хлорида натрия и 0,1 моль/л хлорида
бария. Концентрация ионов Na+(C1)
равна 0,1 моль/л, Z1
= 1; концентрация ионов Ba2+
(C2)
равна 0,1 моль/л, Z2
= 2; общая концентрация хлорид-ионов (C3)
составляет 0,1 + 0,1 •
2
= 0,3 моль/л, Z3
= -I.
Тогда

Кислотность или щелочность раствора можно выразить другим, более удобным способом: вместо концентрации ионов водорода указывают ее десятичный логарифм, взятый с обратным знаком. Последняя величина называется водородным показателем и обозначается через pH:

Например, если [Н+] = 10-5 моль/л, то pH = 5; если [Н+] = 10-9 моль/л, то pH = 9 и т. д. Отсюда ясно, что в нейтральном растворе ([H+] = = 10-7 моль/л) pH = 7. В кислых растворах pH < 7, и тем меньше, чем кислее раствор. Наоборот, в щелочных растворах pH > 7, и тем больше, чем больше щелочность раствора.
Для измерения pH существуют различные методы. Приближенно реакцию раствора можно определить с помощью специальных реактивов, называемых индикаторами, окраска которых меняется в зависимости от концентрации ионов водорода. Наиболее распространенные индикаторы — метиловый оранжевый, метиловый красный, фенолфталеин.
|
Название индикатора |
Цвет индикатора в различных средах |
||
|
кислой |
нейтральной |
щелочной |
|
|
Метиловый оранжевый |
Красный (pH < 3,1) |
Оранжевый (3,1 < pH <4,4) |
Желтый (pH > 4,4) |
|
Метиловый красный |
Красный (pH < 4,2) |
Оранжевый (4,2 < pH < 6,3) |
Желтый (pH > 6,3) |
|
Фенолфталеин |
Бесцветный (pH < 8,0) |
Бледно-малиновый (8,0 < pH < 9,8) |
Малиновый (pH > 9,8) |
|
Лакмус |
Красный (pH < 5) |
Фиолетовый (5 < pH < 8) |
Синий (pH > 8) |
-
Равновесия в растворах электролитов. Случаи необратимых процессов с образованием малодиссоциирующих веществ (слабые кислоты и основания, нерастворимые соли, переосаждение, ПР, Кд и Кн, условие образования осадков, комплексные ионы). Расчёт констант равновесия ионообменных процессов.
Растворы электролитов – сложные системы, свойства которых зависят от характера взаимодействий образующих их частиц вещества. При образовании растворов и в результате протекания в них химических реакций устанавливаются химические, а иногда и фазовые равновесия, среди которых можно выделить 4 основных типа: 1)кислотно-основные; 2)гетерогенные равновесия с участием осадков; 3)равновесия в растворах координационных соединений; 4)окислительно-восстановительные равновесия.



Необратимость таких реакций обусловлена тем, что здесь единственным малодиссоциированным соединением является вода. Несколько иначе протекают другие реакции нейтрализации:
а) слабая кислота + сильное основание
СН3СООН+КОН => СН3СООК+Н2О
СН3СООН+ОН- => СН3СОО-+Н2О;
б) слабое основание + сильная кислота
NH4OH+HNO3 => NH4NO3+H2O
NH4OH+H+ => NH4++H2O;
в) слабое основание + слабая кислота
NH4OH+ СН3СООН =>СН3СОО NH4+Н2О,
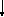
NH4OH+ СН3СООН => СН3СОО- + NH4+ +Н2О.
С образованием нерастворимой соли: Ba(NO3)2 + H2SO4 =>BaSO4 + 2HNO3
