
- •Характеристика химических свойств
- •Типы химических реакций: присоединения, разложения, обмена и замещения; кислотно-основные равновесия, окислительно-восстановительные, комплексообразования.
- •Развитие представлений о строении атома. Планетарная модель атома Резерфорда, противоречия модели. Модель строения атома водорода Бора. Условие стационарности орбит.
- •Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
- •Кривая зависимости энергии от межъядерного расстояния:
- •Обменный и донорно-акцепторный механизм образования ковалентной связи
- •Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
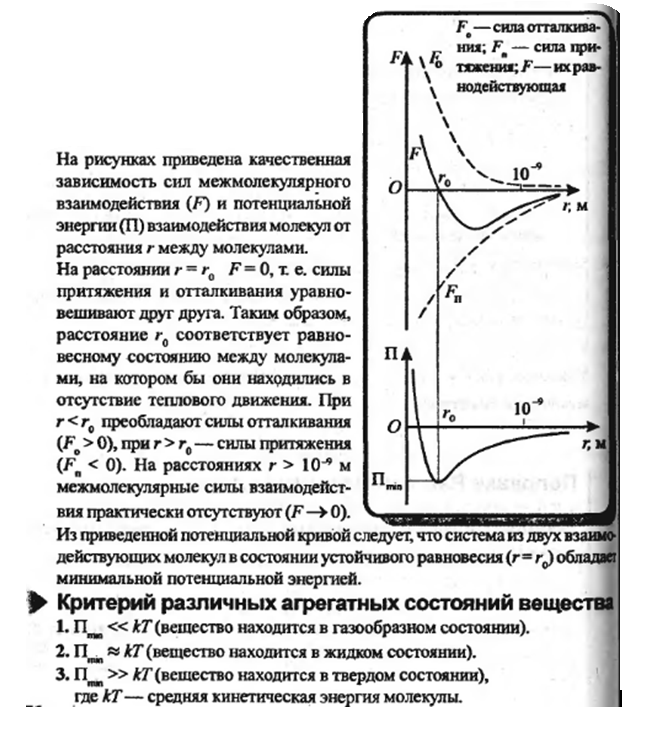
- •Межмолекулярные взаимодействия: ориентационные, индукционные, дисперсионные. Межмолекулярная водородная связь.
- •Периодический закон Менделеева. Физическое обоснование закона. Структура Периодической системы: периоды, ряды, группы и подгруппы. Электронные семейства.
- •Орбитальный радиус
- •I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
- •Основные понятия химической термодинамики: система, классификация термодинамических систем, термодинамические параметры, гомогенные и гетерогенные системы.
- •Внутренняя энергия. Классификация термодинамических процессов. Первое начало термодинамики. Закон Гесса. Следствие из закона Гесса.
- •Второе начало термодинамики. Энтропия.
- •Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
- •Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
- •Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- •Способы выражения концентрации растворов: массовая, объемная, молярная, молярная эквивалентов, мольная, моляльность.
- •Коллигативные свойства растворов. Закон Рауля. Эбулиоскопия и криоскопия.
- •Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
- •Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
- •Константа диссоциации, закон разбавления Оствальда.
- •Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
- •1) Произведение растворимости
- •Гидролиз. Различные случаи частичного гидролиза солей.
- •Случаи необратимого гидролиза солей. Взаимоусиливающий гидролиз.
- •Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
- •Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
- •Типичные окислители и восстановители. Метод ионно-электронных схем.
- •Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
- •Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
- •Химическая стойкость металлов в растворах солей.
- •Электрохимические процессы и системы. Двойной электрический слой.
- •Химические источники тока. Батарейки и аккумуляторы. Процессы при разрядке и зарядке свинцового аккумулятора, Даниэля-Якоби, щелочные аккумуляторы. Топливные элементы.
- •Электролиз. Законы электролиза Фарадея. Электродные процессы при электролизе расплавов и растворов.
- •40. Способы защиты от коррозии металлов: обработка внешней среды, защитные покрытия, электрохимическая защита, легирование, рациональное конструирование.
-
Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
Химическая связь – это результат взаимодействия электронов и ядер, ведущей к образованию устойчивой многоатомной системы.
А+B->AB
EполнА+ЕполнВ>EполнAB
Основными чертами хс являются:
-
Электронная природа
-
Снижение общей энергии двух- или многоатомной системы по сравнению с суммарной энергией изолированных частиц, из которых эта система была образована
-
ХС – результат перекрывания атомных орбиталей взаимодействующих атомов.
-
Перераспределение электронной плотности в области химической связи по сравнению с простым наложением электронных плотностей несвязанных атомов, сближенных на расстояние связи
По своей природе хс представляет собой взаимодействие между положительно заряженными ядрами и отрицательно заряженными электронами, а также электронов друг с другом. Оптимальным оказывается такое расстояние, при котором силы притяжения и отталкивания уравновешиваются. Ha таком расстоянии потенциальная энергия двух взаимодействующих атомов минимальна. Это расстояние называется длиной связи. Энергия, необходимая для того, чтобы разделить два связанных между собой атома и удалить их друг от друга на расстояние, на котором они уже не испытывают силы притяжения друг к другу, называется энергией связи. Чем прочнее химическая связь, тем больше энергии нужно затратить для ее разрыва; поэтому энергия разрыва связи служит мерой ее прочности. Энергия разрыва связи всегда положительна. Из этого следует, что при образовании химической связи энергия всегда выделяется за счет уменьшения потенциальной энергии системы взаимодействующих электронов и ядер. Поэтому потенциальная энергия образующейся частицы (молекулы, кристалла) всегда меньше, чем суммарная потенциальная энергия исходных свободных атомов. Таким образом, условием образования химической связи является уменьшение потенциальной энергии системы взаимодействующих атомов.
Кривая зависимости энергии от межъядерного расстояния:
Ковалентная неполярная связь — вид химической связи, образующийся между атомами с одинаковой электроотрицательностью. Связь происходит за счёт образования общей электронной пары.
В случае, когда электроотрицательности элементов, вступающих во взаимодействие, не равны, но близки по значению, общая электронная пара смещается в сторону элемента с большей электроотрицательностью. При этом на нем образуется частичный отрицательный заряд (за счет отрицательно заряженных электронов):

В результате на атомах соединения образуются частичные заряды Н+0,18 и Cl–0,18; а в молекуле возникают два полюса — положительный и отрицательный. Такую ковалентную связь называют полярной.
Ковалентная полярная связь — вид ковалентной связи, образующейся при взаимодействии атомов, электроотрицательность которых отличается.
Образовавшийся
частичный заряд на атомах в молекуле
обозначают греческой буквой
 (дельта), а направление смещения
электронной пары — стрелкой:
(дельта), а направление смещения
электронной пары — стрелкой:![]()
Ионная химическая связь — это связь, образующаяся между ионами за счет сил электростатического притяжения. Процесс присоединения электронов в ходе химических взаимодействий атомами с большей электроотрицательностью называется восстановлением, а процесс отдачи электронов атомами с меньшей электроотрицательностью — окислением.
Схему образования ионной связи между атомами натрия и хлора можно представить следующим образом:
![]()
Ионная химическая связь присутствует в оксидах, гидроксидах и гидридах щелочных и щелочноземельных металлов, в солях, а также в соединениях металлов с галогенами.
Ионы могут быть как простыми (одноатомными): Cl–, Н+, Na+, так и сложными (многоатомными): NH4–. Заряд иона принято записывать вверху после знака химического элемента. Вначале записывается величина заряда, а затем его знак.
Металлическая связь – хим. связь в металлах. У металлов имеется избыток валентных орбиталей и недостаток электронов. При сближении атомов их валентные орбитали перекрываются благодаря чему электроны свободно перемещаются из одной орбитали в другую, осуществляется связь между всеми атомами металла. Связь, которую осуществляют относительно свободные электроны между ионами металла в кристаллической решетке, называется металлической связью. Связь сильно делокализована и не обладает направленностью и насыщенностью , т. к. валентные электроны равномерно распределены по кристаллу. Наличие свободных электронов обусловливает существование общих свойств металлов: непрозрачность, металлический блеск, высокая электро и теплопроводность, ковкость и пластичность.
Водородная связь – одна из разновидностей взаимодействия между полярными молекулами, образуется между электроотрицательными атомами одной молекулы и атомами водорода другой, типа Н-Х (Х – это F, O, N, Cl, Br, I) за счет сил электростатического притяжения. Водородные связи могут быть межмолекулярными или внутримолекулярными. Внутримолекулярная – образуется между атомами одной молекулы; межмолекулярная – между атомами двух молекул.
Связь между водородом и одним из этих атомов характеризуется достаточной полярностью, поскольку связующее электронное облако смещено в сторону более электроотрицательного атома. Водород в данном случае расположен на положительном конце диполя. Два и более таких диполя взаимодействуют между собой так, что ядро атома водорода одной молекулы (положительный конец диполя) притягивается неподеленной электронной парой второй молекулы. Данная связь проявляется в газах, жидкостях и твердых телах.
-
Метод валентных связей. Основные положения метода валентных связей. Ковалентная связь. Ее характеристики: длина связи, энергия связи, кратность, насыщаемость и направленность. Обменный и донорно-акцепторный механизм. - и -связывание. Теория гибридизации. Пространственное строение молекул.
Метод валентных связей (локализованных электронных пар) предполагает, что каждая пара атомов в молекуле удерживается вместе при помощи одной или нескольких общих электронных пар. Поэтому химическая связь представляется двухэлектронной и двухцентровой, т. е. локализована между двумя атомами. В структурных формулах соединений обозначается черточкой: H-Cl, H-H, H-O-H
В её основе лежат следующие положения:
-
Химическая связь образуется двумя электронами с разными спинами, эта пара принадлежит двум атомам.
-
Связь тем прочнее, чем в большей степени перекрываются взаимодействующие электронные облака.
-
Образование химической связи может происходить двумя механизмами:
Обменный механизм представляет собой образование связи между двумя неспаренными электронами разных атомов.
Возможен и другой механизм образования ковалентной связи за счет неподелённых электронных пар одного атома и свободных орбиталей другого. Такая связь называется донорно-акцепторной и отличается от обычной ковалентной связи только происхождением электронной пары.
Связь, возникающая при взаимодействии электронов с образованием обобщенных электронных пар, называется ковалентной.
В случае если взаимодействующие атомы имеют равные значения электроотрицательности, общая электронная пара в равной степени принадлежит обоим атомам, то есть находится на равном расстоянии от обоих атомов. Такая ковалентная связь называется неполярной. Она имеет место в простых веществах-неметаллах: H2, О2, N2, Cl2 и т. д.
При взаимодействии атомов, имеющих различные значения электроотрицательности, например водорода и хлора, общая электронная пара оказывается смещенной в сторону атома с большей электроотрицательностью, то есть в сторону хлора. Атом хлора приобретает частичный отрицательный заряд, а атом водорода — частичный положительный. Это пример полярной ковалентной связи.
