
- •Характеристика химических свойств
- •Типы химических реакций: присоединения, разложения, обмена и замещения; кислотно-основные равновесия, окислительно-восстановительные, комплексообразования.
- •Развитие представлений о строении атома. Планетарная модель атома Резерфорда, противоречия модели. Модель строения атома водорода Бора. Условие стационарности орбит.
- •Природа химической связи. Кривая зависимости энергии от межъядерного расстояния. Типы химической связи: ковалентная, ионная, металлическая, водородная.
- •Кривая зависимости энергии от межъядерного расстояния:
- •Обменный и донорно-акцепторный механизм образования ковалентной связи
- •Метод молекулярных орбиталей. Основные положения метода молекулярных орбиталей. Порядок связи. Магнитные свойства молекул.
- •Межмолекулярные взаимодействия: ориентационные, индукционные, дисперсионные. Межмолекулярная водородная связь.
- •Периодический закон Менделеева. Физическое обоснование закона. Структура Периодической системы: периоды, ряды, группы и подгруппы. Электронные семейства.
- •Орбитальный радиус
- •I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду i1 резко понижается – он минимален у щелочных металлов.
- •Основные понятия химической термодинамики: система, классификация термодинамических систем, термодинамические параметры, гомогенные и гетерогенные системы.
- •Внутренняя энергия. Классификация термодинамических процессов. Первое начало термодинамики. Закон Гесса. Следствие из закона Гесса.
- •Второе начало термодинамики. Энтропия.
- •Свободная энергия Гиббса. Критерий самопроизвольности протекания химических реакций.
- •Химическая кинетика. Понятие скорости химической реакции. Молекулярность, порядок реакции. Классификация химических реакций: параллельные, последовательные и сопряженные.
- •Растворы. Физико-химические основы процесса растворения. Процесс гидратации. Растворимость. Классификация растворов: ненасыщенные, насыщенные, пересыщенные. Диаграмма состояния воды.
- •Способы выражения концентрации растворов: массовая, объемная, молярная, молярная эквивалентов, мольная, моляльность.
- •Коллигативные свойства растворов. Закон Рауля. Эбулиоскопия и криоскопия.
- •Коллигативные свойства растворов. Закон Генри. Закон Вант-Гоффа.
- •Растворы электролитов. Основные положения теории электролитической диссоциации. Изотонический коэффициент. Степень электролитической диссоциации.
- •Константа диссоциации, закон разбавления Оствальда.
- •Сильные электролиты. Активность. Ионная сила раствора. Водородный показатель.
- •1) Произведение растворимости
- •Гидролиз. Различные случаи частичного гидролиза солей.
- •Случаи необратимого гидролиза солей. Взаимоусиливающий гидролиз.
- •Количественные характеристики гидролиза. Степень гидролиза. Константа гидролиза. Факторы, влияющие на интенсивность гидролиза.
- •Окислительно-восстановительные реакции. Основы теории. Классификация реакций: межмолекулярные, внутримолекулярные, диспропорционирования, контрдиспропорционирования.
- •Типичные окислители и восстановители. Метод ионно-электронных схем.
- •Электродный потенциал. Критерий направленности окислительно-восстановительных процессов. Уравнение Нернста.
- •Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
- •Химическая стойкость металлов в растворах солей.
- •Электрохимические процессы и системы. Двойной электрический слой.
- •Химические источники тока. Батарейки и аккумуляторы. Процессы при разрядке и зарядке свинцового аккумулятора, Даниэля-Якоби, щелочные аккумуляторы. Топливные элементы.
- •Электролиз. Законы электролиза Фарадея. Электродные процессы при электролизе расплавов и растворов.
- •40. Способы защиты от коррозии металлов: обработка внешней среды, защитные покрытия, электрохимическая защита, легирование, рациональное конструирование.
-
Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей. Роль оксидных пленок.
Химическая стойкость металлов в воде, водных растворах кислот (соляная, серная, азотная, царская водка) и щелочей
Способность того или иного металла сопротивляться коррозии, называется коррозийной стойкостью. Эта способность определяется скоростью протекания коррозии в определенных условиях. Чтобы оценить скорость коррозии, используют количественные и качественные характеристики.
Например, в присутствии кислорода и чистой воды, железо быстро корродирует, реакция идет по формуле:
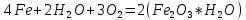
Азотная
кислота
( )
в концентрации более 50% вызовет
пассивацию металла, - он покроется хоть
и хрупким, но все же защитным слоем.
Дымящая азотная кислота безопасна для
железа.
)
в концентрации более 50% вызовет
пассивацию металла, - он покроется хоть
и хрупким, но все же защитным слоем.
Дымящая азотная кислота безопасна для
железа.
Серная
кислота
( )
в концентрации более 70% пассивирует
железо, а если сталь марки Ст3 держать
в 90% серной кислоте при температуре
40°С, то в данных условиях скорость ее
коррозии не превысит 140 мкм в год. Если
же температура составит 90°С, то коррозия
пойдет с в 10 раз большей скоростью.
Серная кислота концентрацией 50% железо
растворит.
)
в концентрации более 70% пассивирует
железо, а если сталь марки Ст3 держать
в 90% серной кислоте при температуре
40°С, то в данных условиях скорость ее
коррозии не превысит 140 мкм в год. Если
же температура составит 90°С, то коррозия
пойдет с в 10 раз большей скоростью.
Серная кислота концентрацией 50% железо
растворит.
Соляная кислота (HCl) является очень агрессивной по отношению к металлам. Даже коррозионностойкие стали подвергаются разрушению, когда концентрация кислоты выше среднего. Если же раствор достаточно сильно разбавлен, такие стали коррозии не подвергаются.
«Царская водка» (Смесь HNO3, HCl и H2O) же используется для растворения благородных металлов и их сплавов, сульфидов, окисленных руд, ртути, соединений мышьяка и др.
Роль оксидных пленок
Оксидные плёнки используются для защиты металла от коррозии. Оксидные покрытия получаются в результате химического или электрохимического образования слоя оксидов на поверхности металла. Эти плёнки, как правило, толще естественных оксидных плёнок, их можно окрашивать или покрывать лаком для повышения защитных свойств. Известно, что оксидные плёнки настолько прочно удерживаются поверхностью алюминия, что сильно затрудняют смачивание этого металла другими, расплавленными металлами, а следовательно, и подыскание удовлетворительного припоя для алюминия.

Пассивация металлов - переход поверхности металла в неактивное, пассивное состояние, связанное с образованием тонких поверхностных слоёв соединений, препятствующих коррозии.
Механизм пассивации
При взаимодействии металлов с теми или иными компонентами растворов (расплавов) в определённом диапазоне потенциалов на поверхности металла образуются адсорбционные или фазовые слои (плёнки). Эти слои образуют плотный, почти непроницаемый барьер, благодаря чему коррозия сильно тормозится или полностью прекращается. Пассивация проводится химически или электрохимически. В последнем случае создаются условия, когда ионы защищаемого металла под действием тока переходят в раствор, содержащий ионы, способные к образованию очень малорастворимых соединений.
-
Химическая стойкость металлов в растворах солей.
Химическая стойкость — это способность материала или покрытия сохранять свои защитные свойства при воздействии на них различных агрессивных (химических) сред. Поэтому говоря о химической стойкости металлов, мы говорим прежде всего о коррозионных свойствах металла. При растворении в воде солей электропроводность ее увеличивается, отсюда и скорость коррозии должна увеличиваться. Однако, как показывают многочисленные опыты коррозия зависит от концентрации раствора и интенсивности поступления кислорода к поверхности металла. Так же, при взаимодействии менее активного Ме с раствором соли более активного Ме причиной коррозии, является его взаимодействие с продуктом гидролиза соли (щелочью или кислотой)
1. Взаимодействие металлов с водными растворами солей представляет собой окислительно-восстановительный процесс. Самые активные щелочные и щёлочноземельные металлы будут взаимодействовать в растворе любой соли прежде всего с водой как окислителем с образованием соответствующего гидроксида и молекулярного воздуха. Металлы менее активные будут окисляться или катионом растворенной соли, или водой слабощелочном растворе соли, у которой гидролизуется анион.
2. Взаимодействие металлов с катионом растворённой соли характерно для металлов, контактирующих с раствором соли малоактивного металла, катион которого является достаточно сильным окислителем для растворяемого металла.
3. В случае солей, образованных катионами металлов средней активности более активные металлы не только вытесняют менее активные из растворов их солей, но и довольно заметно реагируют с их кислотами, образующимися при их гидролизе.
