
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия»
- •Атомно-эмиссионная фотометрия пламени
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Определение калия по методу градуировочного графика
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •1. Цель и задачи работы.
- •Определение содержания натрия в анализируемом растворе.
- •1. Цель и задачи работы.
- •Определения содержания кальция в анализируемом растворе.
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Сущность и основы метода ик-спектроскопии
- •Фурье спектрометр фсм 1201
- •Фотометрический анализ
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение концентрации ионов меди(II) в водных растворах дифференциальным методом и методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения.
- •Выбор светофильтра
- •Определение меди(II) по методу градуировочного графика.
- •Определение меди(II) дифференциальным методом.
- •Определение титана (IV) методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Определение титана (IV) по методу градуировочного графика
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфора по методу градуировочного графика
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •Приготовление стандартных растворов
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфат-ионов по методу градуировочного графика
- •Определение нитрит-ионов по методу градуировочного графика
- •Оформление лабораторного журнала.
- •Определение меди(II) в водных растворах методом градуировочного графика и дифференциальным методом.
- •1. Цель и задачи работы.
- •Определение железа (III) в водных растворах методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.4. Определение железа (III) в водных растворах методом градуировочного графика.
- •Определение титана (IV) методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.3. Определение титана (IV) методом градуировочного графика.
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •1. Цель и задачи работы.
- •3.4. Определение фосфора в водных растворах методом градуировочного графика.
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •1. Цель и задачи работы.
- •Определение нитрит-ионов методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.5. Определение нитрит-ионов методом градуировочного графика.
- •Вопросы для самоконтроля
- •Фототурбидиметрия.
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение сульфатов в растворе
- •Приготовление стандартных растворов и раствора сравнения:
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача. Определение содержания сахара в анализируемом образце
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Оформление лабораторного журнала
- •1.2. Оборудование и реактивы
- •1.3. Рефрактометрическое определение сахара в молоке
- •Вопросы для самоподготовки
- •Определение содержания глюкозы в анализируемом растворе по методу градуировочного графика.
- •Поляриметрическое определение сорбита в смеси.
- •Оформление лабораторного журнала
- •Определение глюкозы
- •Цель и задачи работы
- •Определение сорбита
- •1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
- •Определение солесодержания вод скважин методом прямой кондуктометрии.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •Определение качества очистки дисстилированной воды.
- •Опредление качества очистки бидистиллированной воды
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат-ионов методом кондуктометрического титрования
- •Оформление лабораторного журнала
- •Определение солесодержания вод скважин методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •1. Цель и задачи работы
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат ионов методом кондуктометрического титрования
- •Вопросы для самоконтроля.
- •Потенциометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •1. Иономер универсальный Анион-4100. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4.Ячейка. 5. Бюретка. 6. Магнитная мешалка.
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •Определение нитрат-ионов по методу градуировочного графика
- •Определение нитрат-ионов методом добавок
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце.
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания фосфорной кислоты и дигидрофосфата натрия в анализируемом образце.
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титрования.
- •Приготовление модельного раствора
- •Определение содержания железа (II) в анализируемом растворе
- •Определение свинца (II) в растворе.
- •Контрольная задача. Определение свинца (II) в растворе.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе (рабочий электрод – платиновый)
- •Определение железа (III) в растворе (рабочий электрод – стеклянный)
- •Оформление лабораторного журнала
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •1. Цель и задачи работы.
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титровании.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе ( рабочий электрод - платиновый)
- •Определение железа (III) в растворе (рабочий электрод - стеклянный)
- •Вопросы для самоподготовки.
- •Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Оформление лабораторного журнала
- •Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности.
- •Вопросы для самоподготовки
-
Вопросы для самоконтроля
-
Какова природа происхождения атомных спектров?
На использовании какого явления основана пламенная фотометрия?
На измерении каких величин осуществляется качественный и количественный анализ в атомных спектральных методах?
Что определяется термином «потенциал возбуждения». Как он соотносится с интенсивностью спектральной линии?
Приведите эмпирическую зависимость интенсивности излучения от концентрации определяемого компонента.
Какие процессы происходят с веществами в пламени катализатора?
В чём заключается явление самопоглощения? Как оно влияет на проведение анализа?
Приведите принципиальную схему прибора для атомно-эмиссионной спектроскопии (АЭС).
Какие отличия имеет пламенный фотометр от приборов АЭС? Покажите на принципиальной схеме.
Каково назначение основных узлов пламенного фотометра?
Какие элементы и почему можно анализировать методами АЭС и пламенной фотометрии?
Какие преимущества и недостатки имеет пламенная фотометрия перед АЭС?
В чём заключаются методы определения элементов АЭС: - градуировочного графика; - трёх эталонов; - добавок; - ограничивающих растворов?
Каковы основные характеристики атомно-эмиссионного метода анализа?
-
ИК-спектроскопия органических веществ
Сущность и основы метода ик-спектроскопии
Инфракрасный спектр химического соединения является одной из его наиболее важных характеристик.
Как известно, при инфракрасной спектроскопии в диапазоне каждой химической группировке органической молекулы соответствует определенный набор полос поглощения, которые хорошо изучены и приведены в соответствующих справочниках. Инфракрасная область спектра занимает диапазон длин волн от границы видимой до микроволновой области .то есть от 0,75 мк до 200 мк. Однако обычно под инфракрасной областью подразумевают более узкий интервал от 2,5 до 26 мк.
Спектры в этих областях содержат ценную информацию о строении соединений, но они еще недостаточно хорошо изучены даже для качественного применения. Для характеристики инфракрасного излучения обычно используют волновые числа, то есть величины, обратные длинам волн, измеренным в сантиметрах. Единицей волнового числа является обратный сантиметр (см-1). Так, интервал 2,5-16 мк соответствует интервалу 4000-625 см-1.
Движение химически связанных атомов напоминает непрерывное колебание системы шариков, связанных пружинами. Их движение можно рассматривать как результат наложения двух колебаний - растягивающего и изгибающего. Частоты колебаний зависят не только от самой природы отдельных связей, таких, как С-Н или С-О, но и от всей молекулы и ее окружения. Амплитуды колебаний связей и вместе с ними колебаний электрических зарядов увеличиваются, когда на них воздействуют электромагнитные волны (инфракрасные лучи).
Молекулой поглощаются только те частоты инфракрасного излучения, энергия которых точно соответствует разностям между двумя уровнями энергии связи. Амплитуда данного колебания, следовательно, возрастает не постепенно, а скачком. Значит, при облучении образца инфракрасным светом с непрерывно меняющейся частотой определенные участки спектра излучения должны поглощаться молекулой, вызывая растяжение или изгиб соответствующих связей. Луч, проходящий через вещество, ослабляется в области поглощения. Регистрируя интенсивность прошедшего излучения в зависимости от волновых чисел или длин волн, получают кривую, на которой видны полосы поглощения. Это и есть инфракрасный спектр.
Некоторые связи имеют характерные свойства: кратные связи сильнее одинарных, а связи типа X-Н (N-Н, О-Н, С-Н и т.д.) имеют очень легкий концевой атом водорода.Валентные колебания этих специфических связей лежат в области частот,характерной для соответствующего типа связей (рис.1.)

Рис.1. Области расположения полос поглощения характеристических групп
В области ниже 1600 см-1 проявляются полосы поглощения, обусловленные растяжением одинарных связей (С-С, С-N, С-О, С-галоген и т.д.), а также деформацией угла между связями. Силы всех одинарных связей приблизительно одного порядка, и, кроме того, они обычно соединены кумулятивно, например С-С-С-О. Это приводит к более сильному взаимодействию между связями, расширению области появления соответствующих полос поглощения и большой чувствительности положения полос даже к небольшим изменениям структуры.
Низкочастотная область инфракрасного спектра (1300-650 см-1) известна как область «отпечатков пальцев» - каждое соединение имеет в этом интервале свою специфическую спектральную кривую. Инфракрасная спектроскопия, таким образом, позволяет более эффективно идентифицировать соединения, чем стандартный метод измерения точки плавления.
Положение полосы определяется силой связи и массой связываемых атомов. Чем сильнее связь и чем меньше массы атомов, тем выше частота поглощения данной связи, то есть тем больше энергии нужно затратить на колебание связи. Так, например, сила связи возрастает при переходе от одинарной к двойной и тройной связям, и, соответственно, возрастают частоты валентных колебаний от 700-1500 до 1600-1800 и до 2000- 2500 см-1.
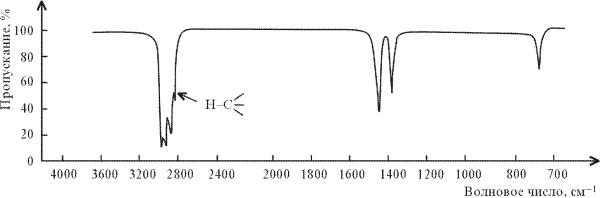 Рис.2.
ИК-спектр н-гексана СН3(СН2)СН3
Рис.2.
ИК-спектр н-гексана СН3(СН2)СН3
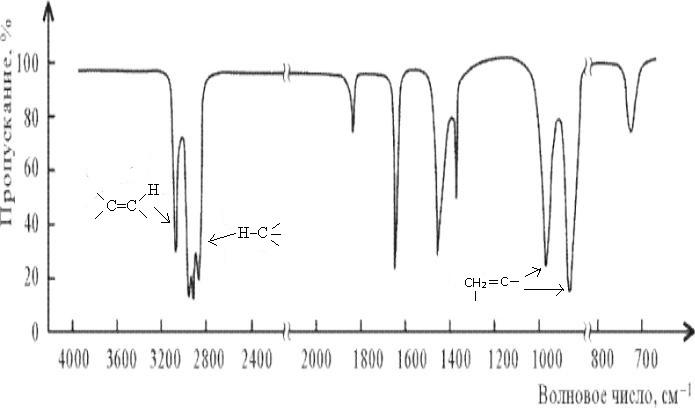 Рис.3.
ИК-спектр гексана-1 СН2=СН(СН2)3СН3
Рис.3.
ИК-спектр гексана-1 СН2=СН(СН2)3СН3
Частота валентного колебания С=О проявляется в области 2000-1500 см-1 и очень чувствительна к изменениям структуры молекулы и ее окружению, а поэтому информация о поглощении карбонильной группы оказывается чрезвычайно полезной при исследовании органических соединений (рис. 4).
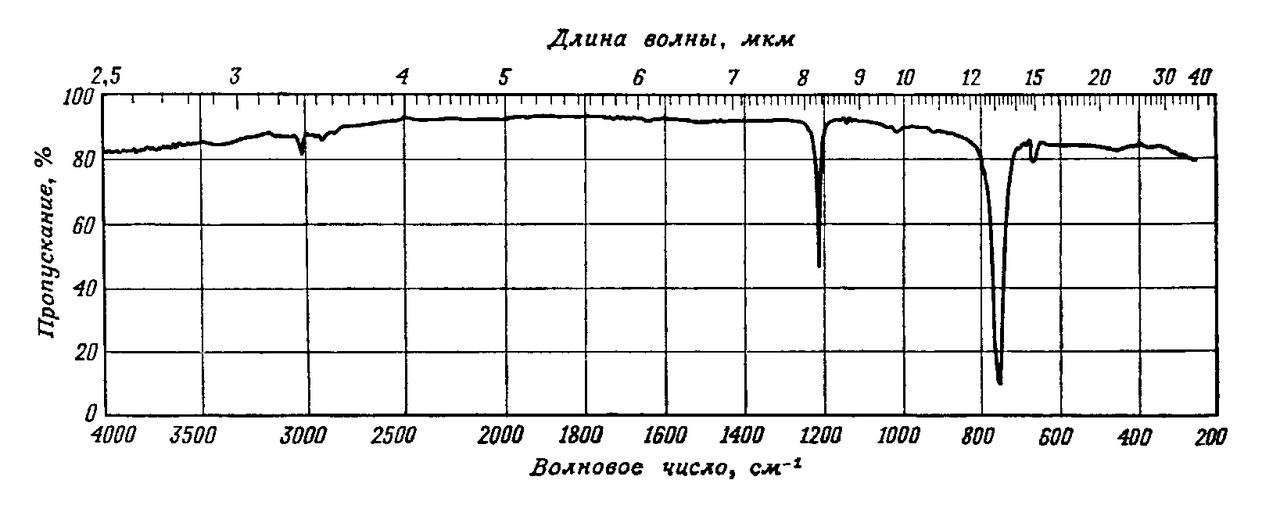

Колебание не обязательно сопровождается появлением инфракрасной полосы поглощения. Поглощение имеет место только тогда, когда колебание приводит к изменению распределения заряда внутри молекулы. Чем больше это изменение, тем сильнее поглощение. Соответственно полосы углеводородов, состоящих только из атомов углерода и водорода, являются слабыми, а полосы, относящиеся к связям, соединяющим атомы, сильно различающиеся между собой по степени электроотрицательности, например С-N, С-О, С=О, С-N, обычно довольно сильными.
Достаточно интенсивные полосы поглощения, проявляющиеся в области, характерной для определенной группы, и пригодные для идентификации этой группы, называются характеристическими полосами поглощения или характеристическими частотами. За последние время собрано огромное количество данных ,относящихся к этим полосам, и многие полосы в области «отпечатков пальцев» теперь также эффективно используются для характеристики различных групп.
При наличии одинарной связи возможны два типа колебаний ,одно из которых связано с изменением длины связи вдоль ее оси(валентные колебания), а другое с изгибом (деформацией) связи. Деформационные колебания химических связей требует меньших частотах ,чем валентные колебания тех связей.
Для метильной группы характерны четыре типа колебаний (схематично представленных на рис. 5 ,а-г),а для метиленовой группы ,кроме того ,еще два типа колебаний ,обусловленных внеплоскостными «веерными» и «крутильными» деформауиями (рис. 5, и,к).
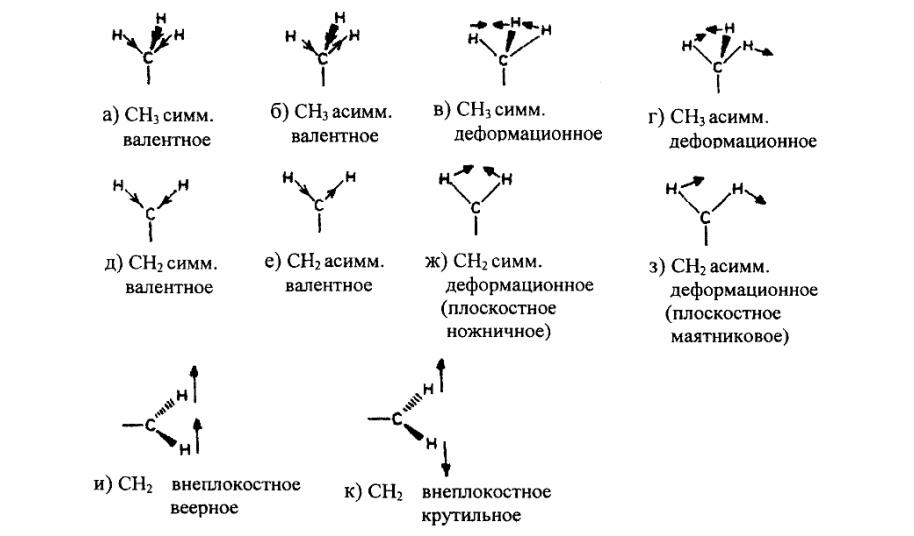
Рис.5. Типы колебаний в метильной и метиленовой группах.
