
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия»
- •Атомно-эмиссионная фотометрия пламени
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Определение калия по методу градуировочного графика
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •1. Цель и задачи работы.
- •Определение содержания натрия в анализируемом растворе.
- •1. Цель и задачи работы.
- •Определения содержания кальция в анализируемом растворе.
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Сущность и основы метода ик-спектроскопии
- •Фурье спектрометр фсм 1201
- •Фотометрический анализ
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение концентрации ионов меди(II) в водных растворах дифференциальным методом и методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения.
- •Выбор светофильтра
- •Определение меди(II) по методу градуировочного графика.
- •Определение меди(II) дифференциальным методом.
- •Определение титана (IV) методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Определение титана (IV) по методу градуировочного графика
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфора по методу градуировочного графика
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •Приготовление стандартных растворов
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфат-ионов по методу градуировочного графика
- •Определение нитрит-ионов по методу градуировочного графика
- •Оформление лабораторного журнала.
- •Определение меди(II) в водных растворах методом градуировочного графика и дифференциальным методом.
- •1. Цель и задачи работы.
- •Определение железа (III) в водных растворах методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.4. Определение железа (III) в водных растворах методом градуировочного графика.
- •Определение титана (IV) методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.3. Определение титана (IV) методом градуировочного графика.
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •1. Цель и задачи работы.
- •3.4. Определение фосфора в водных растворах методом градуировочного графика.
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •1. Цель и задачи работы.
- •Определение нитрит-ионов методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.5. Определение нитрит-ионов методом градуировочного графика.
- •Вопросы для самоконтроля
- •Фототурбидиметрия.
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение сульфатов в растворе
- •Приготовление стандартных растворов и раствора сравнения:
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача. Определение содержания сахара в анализируемом образце
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Оформление лабораторного журнала
- •1.2. Оборудование и реактивы
- •1.3. Рефрактометрическое определение сахара в молоке
- •Вопросы для самоподготовки
- •Определение содержания глюкозы в анализируемом растворе по методу градуировочного графика.
- •Поляриметрическое определение сорбита в смеси.
- •Оформление лабораторного журнала
- •Определение глюкозы
- •Цель и задачи работы
- •Определение сорбита
- •1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
- •Определение солесодержания вод скважин методом прямой кондуктометрии.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •Определение качества очистки дисстилированной воды.
- •Опредление качества очистки бидистиллированной воды
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат-ионов методом кондуктометрического титрования
- •Оформление лабораторного журнала
- •Определение солесодержания вод скважин методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •1. Цель и задачи работы
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат ионов методом кондуктометрического титрования
- •Вопросы для самоконтроля.
- •Потенциометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •1. Иономер универсальный Анион-4100. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4.Ячейка. 5. Бюретка. 6. Магнитная мешалка.
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •Определение нитрат-ионов по методу градуировочного графика
- •Определение нитрат-ионов методом добавок
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце.
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания фосфорной кислоты и дигидрофосфата натрия в анализируемом образце.
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титрования.
- •Приготовление модельного раствора
- •Определение содержания железа (II) в анализируемом растворе
- •Определение свинца (II) в растворе.
- •Контрольная задача. Определение свинца (II) в растворе.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе (рабочий электрод – платиновый)
- •Определение железа (III) в растворе (рабочий электрод – стеклянный)
- •Оформление лабораторного журнала
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •1. Цель и задачи работы.
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титровании.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе ( рабочий электрод - платиновый)
- •Определение железа (III) в растворе (рабочий электрод - стеклянный)
- •Вопросы для самоподготовки.
- •Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Оформление лабораторного журнала
- •Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности.
- •Вопросы для самоподготовки
-
Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
Введение
Ход работы
-
Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
1. Бюретку заполняют раствором
 .
.
2. Аликвотную часть 5,0 см3 раствора HCl переносят в потенциометрическую ячейку с помощью пипетки. В раствор помещают стеклянный и хлоридсеребрянный электроды.
3. Включают магнитную мешалку, измеряют значение pH исходного раствора и записывают в таблицу 12.1.
4. Приливают по 0,5 см3 титранта до объема титранта 15,0 см3. Измерение pH проводят через 20 сек после прибавления очередной порции титранта и записывают в таблицу 12.1.(ориентировочное титрование).
5. Ориентировочно устанавливают точку эквивалентности по максимальному приращению pH.
6. Для точного определения точки эквивалентности титруют вторую порцию 5,0 см3 анализируемого раствора. Вблизи точки эквивалентности титрант приливают порциями по 0,2 см3. Значения pH записывают в таблицу 12.2.(точное титрование).
7. Точное титрование повторяют 2 раза .
8. По результатам точное титрования строят логарифмические и дифференциальные кривые титрования в координатах pH - f(V) и
ΔpH/ΔV = f(V).
9. Находят средний объем раствора, израсходованного на титрование.
10. По известным формулам
рассчитывают молярную концентрацию
эквивалентов раствора
 и
титра
и
титра
 .
.
-
Контрольная задача. Определение содержания фосфорной кислоты и дигидрофосфата натрия в анализируемом образце.
1. Анализируемый раствор, включающий фосфорную кислоту (5,0 мл) и дигидрофосфат натрия (5,0 мл), переносят в кювету для титрования и разбавляют дистиллированной водой.
2. Проводят ориентировочное и точное титрование раствором NaOH с точным титром до 15,0 см3 титранта, обнаруживая два скачка потенциала (первый - небольшой, второй - основной). Результаты записывают в таблицы 12.3 (ориентировочное титрование) и 12.4 (точное титрование).
4. По результатам точного титрования в водном растворе строят кривые титрования в координатах pH - f(V) и ΔpH/ΔV = f(V).
7. Рассчитывают содержание и концентрацию фосфорной кислоты и дигидрофосфата натрия по известным формулам.
-
Определение железа (II) в присутствии железа (III) методом потенциометрического титрования.
Метод основан на потенциометрическом
титровании ионов
 раствором бихромата калия в сернокислой
среде с индикаторным платиновым
электродом и хлорсеребряным электродом
сравнения. При титровании протекает
следующая реакция:
раствором бихромата калия в сернокислой
среде с индикаторным платиновым
электродом и хлорсеребряным электродом
сравнения. При титровании протекает
следующая реакция:



Ход работы.
-
Приготовление модельного раствора
Для приготовления модельного раствора аликвотную часть 5,0 см3 стандартного раствора сульфата железа (II) переносят с помощью пипетки в мерную колбу вместимостью 100 см3, прибавляют 5,0 см3 хлорида железа (III), 10,0 см3 раствора серной кислоты и доводят до метки дистиллированной водой.
-
Определение содержания железа (II) в анализируемом растворе
1. В ячейку титрования отбирают пипеткой 10 см3 модельного раствора, приливают 10 см3 раствора серной кислоты. В полученный раствор помещают платиновый и хлоридсеребрянный электроды.
2. Проводят ориентировочное и точное титрование анализируемого раствора стандартным раствором бихромата калия по пункту 12.2.1.1. По достижении скачка потенциалов титрование продолжают до тех пор, пока изменение ЭДС будет незначительно (до объема титранта 10,0 см3).
3.Титрование повторяют 2 раза. Результаты заносят в таблицы 12.7(ориентировочное титрование) и 12.8. (точное титрование).
4. По результатам точного титрования
строят кривые титрования в координатах
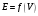 и
и
 .
.
5. Находят среднее значение объема раствора бихромата калия, израсходованного на титрование сульфата железа (II), и рассчитывают содержание и концентрацию железа (II) и сульфата железа (II) по известным формулам.
