
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия»
- •Атомно-эмиссионная фотометрия пламени
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Определение калия по методу градуировочного графика
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •1. Цель и задачи работы.
- •Определение содержания натрия в анализируемом растворе.
- •1. Цель и задачи работы.
- •Определения содержания кальция в анализируемом растворе.
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Сущность и основы метода ик-спектроскопии
- •Фурье спектрометр фсм 1201
- •Фотометрический анализ
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение концентрации ионов меди(II) в водных растворах дифференциальным методом и методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения.
- •Выбор светофильтра
- •Определение меди(II) по методу градуировочного графика.
- •Определение меди(II) дифференциальным методом.
- •Определение титана (IV) методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Определение титана (IV) по методу градуировочного графика
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфора по методу градуировочного графика
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •Приготовление стандартных растворов
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфат-ионов по методу градуировочного графика
- •Определение нитрит-ионов по методу градуировочного графика
- •Оформление лабораторного журнала.
- •Определение меди(II) в водных растворах методом градуировочного графика и дифференциальным методом.
- •1. Цель и задачи работы.
- •Определение железа (III) в водных растворах методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.4. Определение железа (III) в водных растворах методом градуировочного графика.
- •Определение титана (IV) методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.3. Определение титана (IV) методом градуировочного графика.
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •1. Цель и задачи работы.
- •3.4. Определение фосфора в водных растворах методом градуировочного графика.
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •1. Цель и задачи работы.
- •Определение нитрит-ионов методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.5. Определение нитрит-ионов методом градуировочного графика.
- •Вопросы для самоконтроля
- •Фототурбидиметрия.
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение сульфатов в растворе
- •Приготовление стандартных растворов и раствора сравнения:
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача. Определение содержания сахара в анализируемом образце
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Оформление лабораторного журнала
- •1.2. Оборудование и реактивы
- •1.3. Рефрактометрическое определение сахара в молоке
- •Вопросы для самоподготовки
- •Определение содержания глюкозы в анализируемом растворе по методу градуировочного графика.
- •Поляриметрическое определение сорбита в смеси.
- •Оформление лабораторного журнала
- •Определение глюкозы
- •Цель и задачи работы
- •Определение сорбита
- •1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
- •Определение солесодержания вод скважин методом прямой кондуктометрии.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •Определение качества очистки дисстилированной воды.
- •Опредление качества очистки бидистиллированной воды
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат-ионов методом кондуктометрического титрования
- •Оформление лабораторного журнала
- •Определение солесодержания вод скважин методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •1. Цель и задачи работы
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат ионов методом кондуктометрического титрования
- •Вопросы для самоконтроля.
- •Потенциометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •1. Иономер универсальный Анион-4100. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4.Ячейка. 5. Бюретка. 6. Магнитная мешалка.
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •Определение нитрат-ионов по методу градуировочного графика
- •Определение нитрат-ионов методом добавок
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце.
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания фосфорной кислоты и дигидрофосфата натрия в анализируемом образце.
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титрования.
- •Приготовление модельного раствора
- •Определение содержания железа (II) в анализируемом растворе
- •Определение свинца (II) в растворе.
- •Контрольная задача. Определение свинца (II) в растворе.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе (рабочий электрод – платиновый)
- •Определение железа (III) в растворе (рабочий электрод – стеклянный)
- •Оформление лабораторного журнала
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •1. Цель и задачи работы.
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титровании.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе ( рабочий электрод - платиновый)
- •Определение железа (III) в растворе (рабочий электрод - стеклянный)
- •Вопросы для самоподготовки.
- •Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Оформление лабораторного журнала
- •Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности.
- •Вопросы для самоподготовки
-
Вопросы для самоконтроля.
В чем различие прямой и косвенной кондуктометрии? Какой метод более селективен? Почему?
В каком современнном методе анализа используют кондуктометрические детекторы?
Электропроводность раствора азотной кислоты, как показали соответствующие измерения, составляет 0,02273 см. Константа ячейки, в которой проводили измерения, была определена в специальном эксперименте. Рассчитайте концентрацию азотной кислоты в растворе, если константа ячейки равна 0,0053 м-1.
Растворимость
 в воде при
в воде при
 и давлении
и давлении
 1 атм составляет 1,45 г/дм3. Используя
соответствующие величины предельной
подвижности ионов и удельной
электропроводности воды, находящейся
в равновесии с воздухом, рассчитайте
степень диссоциации диоксида углерода
в воде при
1 атм составляет 1,45 г/дм3. Используя
соответствующие величины предельной
подвижности ионов и удельной
электропроводности воды, находящейся
в равновесии с воздухом, рассчитайте
степень диссоциации диоксида углерода
в воде при
 .
Мольная доля
.
Мольная доля
 в сухом воздухе равна 0,000314.
в сухом воздухе равна 0,000314.
Кондуктометрическое титрование 10 см3
0,01 моль/дм3 раствора
 проводилось 0,01 моль/дм3 стандартным
водным раствором
проводилось 0,01 моль/дм3 стандартным
водным раствором
 .
Рассчитайте удельную электропроводность
раствора а) перед началом титрования
до добавления серной кислоты, б) в точке
эквивалентности и в) после добавления
к раствору
.
Рассчитайте удельную электропроводность
раствора а) перед началом титрования
до добавления серной кислоты, б) в точке
эквивалентности и в) после добавления
к раствору
 вдвое большего по сравнению с
стехиометрическим количеством
вдвое большего по сравнению с
стехиометрическим количеством
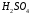 .
Суммарным ионным эффектом можно
пренебречь. Обсудите, насколько
целесообразно такое титрование.
.
Суммарным ионным эффектом можно
пренебречь. Обсудите, насколько
целесообразно такое титрование.
Произведение растворимости сульфата
свинца (II) равно приблизительно
 моль2/дм6 . Рассчитайте
удельную электропроводность насыщенного
раствора сульфата свинца (II),
полагая, что при нейтральном рН ионы
существуют в растворе в виде простых
ионов.
моль2/дм6 . Рассчитайте
удельную электропроводность насыщенного
раствора сульфата свинца (II),
полагая, что при нейтральном рН ионы
существуют в растворе в виде простых
ионов.
-
Потенциометрия
-
Цель и задачи работы
-
Изучение возможностей и аппаратурного оформления прямой потенциометрии и овладение приемами практического применения потенциометрического титрования.
-
Оборудование и реактивы
1. Установка для потенциометрического титрования (рис. 12.1)
2. Иономер универсальный Анион-4100.
3. Цилинд вместимостью 100 см3.
4. Стеклянный и хлорсеребряный электроды.
5. Магнитная мешалка.
6. Химический стакан объемом 50, 100 см3.
7. Коническая колба объемом 250 см3.
8. Пипетка объемом 10 см3.
9. Бюретка объемом 25 см3.
10. Мерная колба объемом 100 см3.
11. Гидроксид натрия, водный раствор
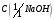 = 0,1 моль/дм3.
= 0,1 моль/дм3.
12. Соляная кислота, водный раствор
 = 1 моль/дм3.
= 1 моль/дм3.
13. Соляная кислота, водный раствор
 = 0,1 моль/дм3 (стандартный раствор).
= 0,1 моль/дм3 (стандартный раствор).
14. Уксусная кислота, раствор
 = 1 моль/дм3.
= 1 моль/дм3.
15. Ацетон.
16. Индикатор метиловый оранжевый, водный раствор с массовой долей 0,1%.
17. Платиновый электрод.
18. Серная кислота, раствор
 = 1 моль/дм3.
= 1 моль/дм3.
19. Бихромат калия, стандартный раствор
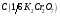 =0,01моль/дм3.
=0,01моль/дм3.
20. Сульфат железа (II), раствор
 = 0,1 моль/дм3 (готовится перед
анализом).
= 0,1 моль/дм3 (готовится перед
анализом).
21. Хлорид железа (III), раствор
 = 0,3 моль/дм3 .
= 0,3 моль/дм3 .
22. Хлорид олова, раствор
 = 1% масс. в растворе хлороводородной
кислоты
= 1% масс. в растворе хлороводородной
кислоты
 = 1 моль/л.
= 1 моль/л.
23. Гексоцианоферрат (III) калия, 1%-ный раствор.
24. Гексоцианоферрат (II) калия, стандартный раствор c(1/2 K4Fe(CN)6) = 0,1000 моль/дм3 раствор.
25. Нитрат свинца, c(1/1 Pb(NO3)2) = 0,1000 моль/дм3 раствор.
26. ЭТДА, стандартный раствор c(1/1 ЭДТА) = 0,0500 моль/дм3.
27. Ацетат аммония, 25%-ый раствор.
28. Cоль Мора , 0,01 М раствор.
29. Хлорид железа (III), c(1/1 FeCl3) = 0,0500 моль/дм3 .

Рис 12.1. Схема установки для потенциометрического титрования:
