
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия»
- •Атомно-эмиссионная фотометрия пламени
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Определение калия по методу градуировочного графика
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •1. Цель и задачи работы.
- •Определение содержания натрия в анализируемом растворе.
- •1. Цель и задачи работы.
- •Определения содержания кальция в анализируемом растворе.
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Сущность и основы метода ик-спектроскопии
- •Фурье спектрометр фсм 1201
- •Фотометрический анализ
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение концентрации ионов меди(II) в водных растворах дифференциальным методом и методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения.
- •Выбор светофильтра
- •Определение меди(II) по методу градуировочного графика.
- •Определение меди(II) дифференциальным методом.
- •Определение титана (IV) методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Определение титана (IV) по методу градуировочного графика
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфора по методу градуировочного графика
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •Приготовление стандартных растворов
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфат-ионов по методу градуировочного графика
- •Определение нитрит-ионов по методу градуировочного графика
- •Оформление лабораторного журнала.
- •Определение меди(II) в водных растворах методом градуировочного графика и дифференциальным методом.
- •1. Цель и задачи работы.
- •Определение железа (III) в водных растворах методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.4. Определение железа (III) в водных растворах методом градуировочного графика.
- •Определение титана (IV) методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.3. Определение титана (IV) методом градуировочного графика.
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •1. Цель и задачи работы.
- •3.4. Определение фосфора в водных растворах методом градуировочного графика.
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •1. Цель и задачи работы.
- •Определение нитрит-ионов методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.5. Определение нитрит-ионов методом градуировочного графика.
- •Вопросы для самоконтроля
- •Фототурбидиметрия.
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение сульфатов в растворе
- •Приготовление стандартных растворов и раствора сравнения:
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача. Определение содержания сахара в анализируемом образце
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Оформление лабораторного журнала
- •1.2. Оборудование и реактивы
- •1.3. Рефрактометрическое определение сахара в молоке
- •Вопросы для самоподготовки
- •Определение содержания глюкозы в анализируемом растворе по методу градуировочного графика.
- •Поляриметрическое определение сорбита в смеси.
- •Оформление лабораторного журнала
- •Определение глюкозы
- •Цель и задачи работы
- •Определение сорбита
- •1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
- •Определение солесодержания вод скважин методом прямой кондуктометрии.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •Определение качества очистки дисстилированной воды.
- •Опредление качества очистки бидистиллированной воды
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат-ионов методом кондуктометрического титрования
- •Оформление лабораторного журнала
- •Определение солесодержания вод скважин методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •1. Цель и задачи работы
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат ионов методом кондуктометрического титрования
- •Вопросы для самоконтроля.
- •Потенциометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •1. Иономер универсальный Анион-4100. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4.Ячейка. 5. Бюретка. 6. Магнитная мешалка.
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •Определение нитрат-ионов по методу градуировочного графика
- •Определение нитрат-ионов методом добавок
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце.
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания фосфорной кислоты и дигидрофосфата натрия в анализируемом образце.
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титрования.
- •Приготовление модельного раствора
- •Определение содержания железа (II) в анализируемом растворе
- •Определение свинца (II) в растворе.
- •Контрольная задача. Определение свинца (II) в растворе.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе (рабочий электрод – платиновый)
- •Определение железа (III) в растворе (рабочий электрод – стеклянный)
- •Оформление лабораторного журнала
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •1. Цель и задачи работы.
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титровании.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе ( рабочий электрод - платиновый)
- •Определение железа (III) в растворе (рабочий электрод - стеклянный)
- •Вопросы для самоподготовки.
- •Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Оформление лабораторного журнала
- •Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности.
- •Вопросы для самоподготовки
-
Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
1. Собрать установку для кулонометрического титрования с потенциометрической фиксацией точки эквивалентности по схеме (см. Рис. 1.)
Рис. 1. Схема лабораторной установки.
2. В анодное пространство ячейки внести 50 см3, а в катодное 2,5 см3 ацетатного буферного раствора рН=3,7.
3. Включить магнитную мешалку и кулонометр.
4. Для автоматической регистрации результатов эксперимента необходимо войти в программу «ЕХР pr2.exe».
5. Провести предэлектролиз.
6. Внести в анодное пространство ячейки аликвоту (1 или 2 см3) раствора тиосульфата натрия.
7. После проведения электролиза на дисплее появится время титрования до точки эквивалентности в сек.
8. Измерения каждой аликвоты провести по 3 раза.
-
Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
Определение кислот основано
на электрогенерации ионов
 из
из
 на платиновом электроде и последующем
их взаимодействии с ионами
на платиновом электроде и последующем
их взаимодействии с ионами
 .
При этом на катоде протекают следующие
реакции:
.
При этом на катоде протекают следующие
реакции:

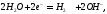
а в растворе:

После завершения химической
реакции избыток ионов
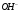 создает в растворе щелочную реакцию,
что обнаруживается визуально по изменению
окраски кислотно-основного индикатора
или потенциометрически (
создает в растворе щелочную реакцию,
что обнаруживается визуально по изменению
окраски кислотно-основного индикатора
или потенциометрически ( -метрически)
со стеклянным индикаторным электродом.
Для повышения электропроводности в
исследуемый раствор добавляют
индифферентный сильный электролит.
-метрически)
со стеклянным индикаторным электродом.
Для повышения электропроводности в
исследуемый раствор добавляют
индифферентный сильный электролит.
Ход работы
1. Собрать установку для кулонометрического титрования с потенциометрической фиксацией точки эквивалентности по схеме (см. Рис. 1.)
другая
Рис. 1. Схема лабораторной установки.
2. В катодное пространство ячейки помещают 25 см3 раствора сульфата калия и доводят объем раствора до 50 см3 дистиллированной водой. В анодную камеру вносят 2,5 см3 раствором сульфата калия.
3. Включить магнитную мешалку и кулонометр.
4. Для автоматической регистрации результатов эксперимента необходимо войти в программу «ЕХР pr2.exe».
5. Провести предэлектролиз.
6. Внести в анодное пространство ячейки аликвоту (1 или 2 см3) раствора соляной кислоты.
7. После проведения электролиза на дисплее появится время титрования до точки эквивалентности в сек.
8. Измерения каждой аликвоты провести по 3 раза.
-
Оформление лабораторного журнала
-
Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
-
1. Цели и задачи работы
2. Ход работы
3. Написать уравнения реакции анодного окисления йодид-ионов с образованием элементарного йода и реакцию окисления тиосульфата натрия йодом в кислой среде. Для обеих реакций привести полное, ионное сокращенное уравнения. Написать окислительно-восстановительные процессы.
4. Привести график зависимости потенциала от времени.
5. Внести результаты измерения в Таблицу 1. и рассчитать среднее время титрования с доверительным интервалом для каждой из аликвот, массу тиосульфата натрия с помощью закона Фарадея.
Результаты определения тиосульфата натрия
Таблица 1.
|
№ |
Объем пробы, мл |
Время титрования, сек |
Среднее время титрования, сек |
Масса тиосульфата, мг |
Среднее значение, мг |
|
1 |
1 |
|
|
|
|
|
2 |
|
|
|||
|
3 |
|
|
|||
|
4 |
2 |
|
|
|
|
|
5 |
|
|
|||
|
6 |
|
|
6. Расчёт результатов определения тиосульфата натрия (точность расчётов – 4 значащих цифры, для массы 0,0001 г). Привести расчётные формулы и расчёты, рассчитанные значения занести в таблицы 12.18.
Результаты определения тиосульфата
Таблица 12.18.
|
с(1/1 S2O32-), моль/дм3 |
T(S2O32-), г/см3 |
n(1/1 S2O32-), моль |
ν(S2O32-), моль |
m(S2O32-), г |
|
|
|
|
|
|
|
с(1/1 Na2S2O3), моль/дм3 |
T(Na2S2O3), г/см3 |
n(1/1 Na2S2O3), моль |
ν(Na2S2O3), моль |
m(Na2S2O3), г |
|
|
|
|
|
|
5. Расчёт относительной погрешности:

