
- •Сборник методических указаний к лабораторным работам
- •«Аналитическая химия»
- •Атомно-эмиссионная фотометрия пламени
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Определение калия по методу градуировочного графика
- •Приготовление стандартных растворов:
- •Подготовка прибора к работе:
- •Построение градуировочного графика
- •1. Цель и задачи работы.
- •Определение содержания натрия в анализируемом растворе.
- •1. Цель и задачи работы.
- •Определения содержания кальция в анализируемом растворе.
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Сущность и основы метода ик-спектроскопии
- •Фурье спектрометр фсм 1201
- •Фотометрический анализ
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение концентрации ионов меди(II) в водных растворах дифференциальным методом и методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения.
- •Выбор светофильтра
- •Определение меди(II) по методу градуировочного графика.
- •Определение меди(II) дифференциальным методом.
- •Определение титана (IV) методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Определение титана (IV) по методу градуировочного графика
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •Приготовление стандартных растворов:
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфора по методу градуировочного графика
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •Приготовление стандартных растворов
- •Приготовление раствора сравнения
- •Выбор светофильтра
- •Определение фосфат-ионов по методу градуировочного графика
- •Определение нитрит-ионов по методу градуировочного графика
- •Оформление лабораторного журнала.
- •Определение меди(II) в водных растворах методом градуировочного графика и дифференциальным методом.
- •1. Цель и задачи работы.
- •Определение железа (III) в водных растворах методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.4. Определение железа (III) в водных растворах методом градуировочного графика.
- •Определение титана (IV) методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.3. Определение титана (IV) методом градуировочного графика.
- •Определение фосфора в виде синего фосфорномолибденового комплекса методом градуировочного графика
- •1. Цель и задачи работы.
- •3.4. Определение фосфора в водных растворах методом градуировочного графика.
- •Определение фосфора в виде фосфорномолибденованадиевой гетерополикислоты
- •1. Цель и задачи работы.
- •Определение нитрит-ионов методом градуировочного графика.
- •1. Цель и задачи работы.
- •3.5. Определение нитрит-ионов методом градуировочного графика.
- •Вопросы для самоконтроля
- •Фототурбидиметрия.
- •Цель и задачи работы
- •Оборудование и реактивы
- •Определение сульфатов в растворе
- •Приготовление стандартных растворов и раствора сравнения:
- •1. Цель и задачи работы.
- •Вопросы для самоконтроля
- •Рефрактометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •Программа работы
- •Рефрактометрическое определение сахара в молоке.
- •Подготовка пробы к анализу:
- •Порядок работы на рефрактометре:
- •Контрольная задача. Определение содержания сахара в анализируемом образце
- •Определение содержания хлорида натрия в водном растворе. Приборы и реактивы.
- •Приготовление стандартных растворов:
- •Построение градуировочного графика.
- •Контрольная задача. Определение содержания хлорида натрия в анализируемом растворе
- •Оформление лабораторного журнала
- •1.2. Оборудование и реактивы
- •1.3. Рефрактометрическое определение сахара в молоке
- •Вопросы для самоподготовки
- •Определение содержания глюкозы в анализируемом растворе по методу градуировочного графика.
- •Поляриметрическое определение сорбита в смеси.
- •Оформление лабораторного журнала
- •Определение глюкозы
- •Цель и задачи работы
- •Определение сорбита
- •1. Иономер-кондуктометр; 2. Магнитная мешалка; 3. Кондуктометрический датчик; 4. Ячейка; 5. Бюретка
- •Определение солесодержания вод скважин методом прямой кондуктометрии.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •Определение качества очистки дисстилированной воды.
- •Опредление качества очистки бидистиллированной воды
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •Определение слабой кислоты и соли слабого основания в их смеси.
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания борной кислоты и солянокислого гидроксиламина в испытуемой смеси
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат-ионов методом кондуктометрического титрования
- •Оформление лабораторного журнала
- •Определение солесодержания вод скважин методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение качества очистки дистиллированной и бидистиллированной воды методом прямой кондуктометрии
- •1. Цель и задачи работы.
- •Определение слабой кислоты и соли слабого основания в их смеси методом кондуктометрического титрования
- •1. Цель и задачи работы
- •Определение ионов и в их смеси методом кондуктометрического титрования
- •Определение сульфат ионов методом кондуктометрического титрования
- •Вопросы для самоконтроля.
- •Потенциометрия
- •Цель и задачи работы
- •Оборудование и реактивы
- •1. Иономер универсальный Анион-4100. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4.Ячейка. 5. Бюретка. 6. Магнитная мешалка.
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •Определение нитрат-ионов по методу градуировочного графика
- •Определение нитрат-ионов методом добавок
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания хлороводородной и уксусной кислот в анализируемом образце.
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •Стандартизация раствора (вторичного стандарта) по первичном стандарту hCl
- •Контрольная задача. Определение содержания фосфорной кислоты и дигидрофосфата натрия в анализируемом образце.
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титрования.
- •Приготовление модельного раствора
- •Определение содержания железа (II) в анализируемом растворе
- •Определение свинца (II) в растворе.
- •Контрольная задача. Определение свинца (II) в растворе.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе (рабочий электрод – платиновый)
- •Определение железа (III) в растворе (рабочий электрод – стеклянный)
- •Оформление лабораторного журнала
- •Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
- •1. Цель и задачи работы.
- •Определение хлороводородной и уксусной кислот в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение фосфорной кислоты и дигидрофосфата натрия в растворе при их совместном присутствии методом потенциометрического титрования
- •1. Цель и задачи работы
- •Определение железа (II) в присутствии железа (III) методом потенциометрического титровании.
- •Определение железа (III) в растворе
- •Определение железа (III) в растворе ( рабочий электрод - платиновый)
- •Определение железа (III) в растворе (рабочий электрод - стеклянный)
- •Вопросы для самоподготовки.
- •Контрольная задача. Определение содержания тиосульфата натрия в анализируемом образце
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Оформление лабораторного журнала
- •Опредление тиосульфата натрия методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности
- •Определение хлороводородной кислоты методом кулонометрического титрования с потенциометрической фиксацией точки эквивалентности.
- •Вопросы для самоподготовки
1. Иономер универсальный Анион-4100. 2. Стеклянный электрод. 3. Хлорсеребряный электрод. 4.Ячейка. 5. Бюретка. 6. Магнитная мешалка.
-
Определение нитрат-ионов методом прямой потенциометрии методом градуировочного графика и методом добавок
Ионометрический метод основан на извлечении нитратов раствором алюмокалиевых квасцов или дистиллированной водой с последующим измерением концентрации нитратов с помощью ионселективного нитратного электрода.
Метод добавок в ионометрии основан на сравнении потенциалов исследуемого раствора и растворов, которые содержат исследуемый раствор и добавку известного количества исследуемого вещества.
Ход работы
-
Работа с прибором
Индикаторный электрод и электрод сравнения поместить в потенциометрическую ячейку со стандартным раствором и подключить к иономеру. Включить иономер в режим измерения потенциала.
-
Приготовление стандартных растворов.
Для приготовления раствора с концентрацией: 0,01 моль/дм3 - переносят в мерную колбу (колба 2) вместимостью 100 см3 10 см3 рабочего раствора (колба 1); 0,001 моль/дм3 - переносят в мерную колбу (колба 3) вместимостью 100 см3 10 см3 раствора из колбы 2; 0,0001 моль/дм3 - переносят в мерную колбу (колба 4) вместимостью 100 см3 10 см3 раствора из колбы 3.
-
Градуировка электрода
Для проведения калибровки электрода готовят серию стандартных растворов нитрата натрия путем последовательного десятикратного разведения рабочего раствора концентрацией 0,1моль/дм3 дистиллированной водой.
Погружают электродную пару в первый стандартный раствор (в ячейке - 20 см3) и при перемешивании измеряют потенциал индикаторного электрода относительно вспомогательного электрода. Запись величины потенциала производят после того, как значение перестает изменяться в пределах ±1 мВ. Затем повторяют эту процедуру для остальных значений рNO3.
По окончании калибровки промывают погружаемую часть электрода дистиллированной водой до рNO3=6.
Измеряя потенциал каждого стандартного раствора, вводят величины рNO3 и величины Е (мВ) в память прибора, следуя его инструкции по эксплуатации.
-
Определение нитрат-ионов по методу градуировочного графика
1. Построение градуировочного графика.
Поочередно измеряют потенциал для каждого раствора, начиная с самого разбавленного и переходя к более концентрированному. Перед каждым измерением электроды тщательно промывают дистиллированной водой до рNO3=6. На основе полученных данных строят гадуировочный график зависимости Е=f(рNO3).
2. Контрольная задача
Помещают в потенциометрическую ячейку 20 см3 контрольного раствора, повторяют измерения 5 раз. Находят искомую концентрацию по градуировочному графику.
-
Определение нитрат-ионов методом добавок
Для определения массовой доли по методу добавок в 6 мерных колб с контрольным образцом вместимостью 50 см3 вносят рассчитанные объемы 0,1 моль/дм3 раствора нитрата натрия. Объем всех растворов доводят до метки 1%-ным раствором алюмокалиевых квасцов. В потенциометрическую ячейку переносят 20 см3 раствора из каждой колбы, измеряют потенциал. Концентрацию нитратов определяют графически по графику зависимости потенциала Е от (рNO3)доб. (графический метод) и алгебраическим с использованием уравнения Нернста:
EM
= const
+ S*
рNO3
= const
– 58 lg
(CNO3-)
= const
– 58 lg
(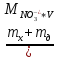 ,
где
,
где
S –крутизна электродной функции;
CNO3- - концентрация нитрат-ионов в растворе, моль/дм3;
mx – масса нитрат-ионов , г;
mд – масса добавки нитрата, г;
V – объем колбы;
MNO3- - молярная масса нитрат-иона, г/моль.
Содержание нитратов находили по формуле:
ω NO3-
, % =
 ,
где
,
где
C – концентрация нитрат-ионов, моль/дм3;
K – коэффициент разбавления;
M – молярная масса нитрат-иона, г/моль;
m –масса навески, г.
