
- •Часть I
- •Введение
- •1. Введение в химию элементов
- •1.1. Распространённость химических элементов в природе
- •1.2. Распространенность химических элементов в атмосфере, гид-росфере и биосфере
- •1.3. Некоторые закономерности в изменении химических свойств элементов и их соединений
- •1.4. О форме таблицы д. И. Менделеева
- •2. Химия s-элементов и их соединений
- •2.1. Щелочные металлы
- •2.2. Бериллий, магний и щёлочноземельные металлы
- •3. Химия р-элементов и их соединений
- •3.2. Алюминий
- •2AlCl3(г)Al2Cl6(г)
- •3.3. Галлий, индий, таллий
- •3.4. Углерод
- •3.5. Кремний
- •3.6. Германий, олово, свинец
- •3.7. Азот
- •3.8. Фосфор
- •3.9. Мышьяк, сурьма, висмут
- •3.10. Кислород
- •3.11. Сера
- •3.12. Селен, теллур, полоний
- •3.13. Водород
- •3.14. Галогены
- •3.15. Благородные газы
- •Рекомендуемая литература
- •Оглавление
- •1. Введение в химию элементов 5
- •2. Химия s-элементов и их соединений 19
- •3. Химия р-элементов и их соединений 36
- •Начала химии Химия элементов и их соединений
- •Часть I
2AlCl3(г)Al2Cl6(г)
ΔGо298 = ΔGообр.Al2Cl6(г) − 2 ΔGообр.AlCl3(г) = −1209 − 2(−571) = −67 кДж
ΔGо = −RTlnKравн.
Kравн
=
![]() =
=
![]() =
=
![]() =
=
![]()
Пусть начальная концентрация AlCl3(г) составляла 1 моль/л, начальная концентрация Al2Cl6(г) – 0 моль/л. Примем равновесную концентрацию Al2Cl6(г) равной х моль/л, тогда равновесная концентрация AlCl3(г) составит (1 – 2х) моль/л. Подставляем величины в уравнение для константы равновесия:
Кравн.
=
![]() =
=
![]()
Решая уравнение относительно х, получим:
х1 = 0,5 + 0,49∙10−6
х2 = 0,5 – 0,49∙10−6.
Первый корень не подходит по смыслу, таким образом, степень димеризации AlCl3(г) составляет:
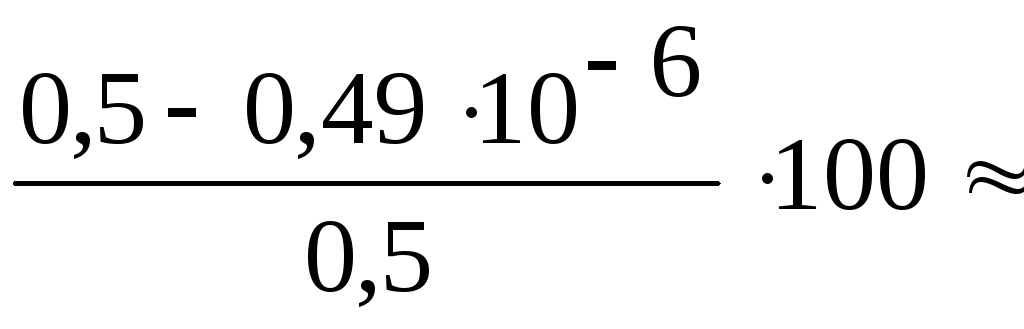 99,9999 %.
99,9999 %.
Следует отметить, что поскольку обсуждалось газовое равновесие, то константой равновесия должна быть Кр и в вычислениях должны были фигурировать давления (фугитивности), однако конечный результат в этом случае был бы тот же самый.
Сульфат алюминия образует двойные соли с сульфатами одновалентных металлов – квасцы. Кристаллическая решётка этих соединений содержит гексааквакомплексы [Э(H2O)6]+, [Al(H2O)6]3+ и анионы SO42−. Поэтому состав квасцов соответствует формуле ЭAl(SO4)2∙12H2O. Квасцы способны образовывать и другие Э3+; двойные соли можно рассматривать как комплексы со сравнительно небольшой величиной константы устойчивости.
Применение
Поскольку Al мягкий металл, то его сплавляют с металлами, повышающими его твёрдость и коррозионную устойчивость (например с Mg и Cu). Именно поэтому Al используют преимущественно в виде сплавов, важнейшим из них является дюралюмин (дюраль), в котором к Al приплавлены Cu, Mg, Mn. Широко используются также сплавы Al с Ni, Sn, Zn и другими металлами.
Алюминиевые сплавы находят применение в авто- и авиастроении, при строительстве морских и речных судов, в качестве конструкционных материалов при строительстве зданий. Незаменим Al при изготовлении проводов внутренней проводки. Алюминиевая фольга применяется в пищевой промышленности, на основе тонкого алюминиевого порошка изготавливают краску («алюминиевая бронза»). Металлический Al используется как восстановитель в металлотермических производствах.
Корунд, являющийся кристаллической формой Al2O3, твёрд и используется как абразивный материал. Природный корунд может давать прозрачные кристаллы. Некоторые примеси окрашивают эти кристаллы в красивые тона, такие модификации корунда относят к полудрагоценным камням (сапфиры, рубины).
Al2(SO4)3∙18H2O используют для коагуляционной очистки питьевой воды и в бумажной промышленности. Дело в том, что бумага, пропитанная сульфатом алюминия, легко насыщается с поверхности коллоидной смесью глины и смолистых веществ, что увеличивает способность бумаги удерживать краску. Галогениды алюминия (особенно AlCl3, являющийся сильной кислотой Льюиса) широко используются в качестве катализаторов в органической химии.
Задание 6. По справочным данным определить, в каком объёме воды растворяется 1 г AlF3 (возможным гидролизом пренебречь).
Решение. Рассматриваемое равновесие:
AlF3(к)
![]() Al3+
+ 3F−
Al3+
+ 3F−
Насыщенный раствор
ΔGо298 = 3ΔGообр.F−(р-р, ст.с.) + ΔGообр.Al3+(р-р, ст.с.) − ΔGообр.AlF3(к) =
= 3(−277,7) + (−490) − (−1431,1) = 108 кДж
ΔGо = −RTlnKравн. = −RTlnПР
ПР =
![]() =
=
![]() =
=
![]() =
=
![]() .
.
Если растворимость AlF3(к) составляет р моль/л, то в насыщенном растворе равновесные концентрации составляют:
[Al3+] = p моль/л; [F−] = 3p моль/л.
Подставляем в выражение для ПР:
ПР = [Al3+]∙[F-]3 = p∙(3p)3 = 27p4 = 1,16∙10−19
Отсюда:
р = 8,10∙10−6 моль/л; M(AlF3) = 84 г/моль; р = 8,10∙10−6 моль/л ∙ 84 г/моль = 6,8∙10−4 г/л
В 1 литре воды растворяется 6,8∙10−4 г AlF3
В х литрах воды − 1 г AlF3
х =
![]() =
1471 л
=
1471 л
