
- •Часть I
- •Введение
- •1. Введение в химию элементов
- •1.1. Распространённость химических элементов в природе
- •1.2. Распространенность химических элементов в атмосфере, гид-росфере и биосфере
- •1.3. Некоторые закономерности в изменении химических свойств элементов и их соединений
- •1.4. О форме таблицы д. И. Менделеева
- •2. Химия s-элементов и их соединений
- •2.1. Щелочные металлы
- •2.2. Бериллий, магний и щёлочноземельные металлы
- •3. Химия р-элементов и их соединений
- •3.2. Алюминий
- •2AlCl3(г)Al2Cl6(г)
- •3.3. Галлий, индий, таллий
- •3.4. Углерод
- •3.5. Кремний
- •3.6. Германий, олово, свинец
- •3.7. Азот
- •3.8. Фосфор
- •3.9. Мышьяк, сурьма, висмут
- •3.10. Кислород
- •3.11. Сера
- •3.12. Селен, теллур, полоний
- •3.13. Водород
- •3.14. Галогены
- •3.15. Благородные газы
- •Рекомендуемая литература
- •Оглавление
- •1. Введение в химию элементов 5
- •2. Химия s-элементов и их соединений 19
- •3. Химия р-элементов и их соединений 36
- •Начала химии Химия элементов и их соединений
- •Часть I
3.4. Углерод
Природные источники, аллотропные модификации
В природе углерод и его основные соединения представлены карбонатами, углём, нефтью, сланцами, природным газом, графитом, алмазом.
До недавних пор были известны четыре аллотропные модификации углерода: две природные – графит и алмаз, две искусственные – полиин и поликумулен (α- и β-карбины). Самой распространённой формой углерода является графит, кристаллическая решётка которого состоит из плоских слоёв атомов, образованных правильными шестиугольниками, слабо связанных друг с другом и отстоящих друг от друга на расстояние 335 пм. Именно этим объясняется способность графита делиться на чешуйки. Связь между атомами слоя описывается с позиции sp2-гибридизации, расстояние между атомами составляет 154 пм. За счёт делокализованных π-электронов графит обладает электропроводностью, она проявляется вдоль слоёв структуры графита.
В алмазе каждый атом углерода образует четыре ковалентные связи с соседними атомами (sp3-гибридизация, расстояние между атомами 154 пм). В результате все атомы, образующие алмаз, связаны сетью ковалентных связей в одну трёхмерную макромолекулу. Алмаз характеризуется наивысшей твёрдостью и высоким лучепреломлением, не проводит электрический ток, химически инертен. При нагревании свыше 2000 оС алмаз (без доступа кислорода) превращается в графит.
Мировая добыча природных алмазов исчисляется десятками миллионов карат (1 карат = 0,2 г), из которых до 90 % идут на технические нужды. Крупнейший из добытых алмазов «Куллинан» имел массу 621 г, из него было изготовлено 105 бриллиантов.
Принимая во внимание величины плотностей алмаза и графита (3,51 и 2,23 г/см3 соответственно), можно сделать вывод о возможности перехода графита в алмаз при высоких давлениях. И действительно, процесс превращения графита в алмаз происходит при давлениях около 100000 атм и температуре 1500–2000 оС с использованием каталитических систем на основе d-элементов.
В настоящее время синтетические алмазы чаще получают при низких давлениях пиролизом метана в присутствии атомарного водорода. Последний лучше реагирует с графитом, чем с алмазом и удаляет графит в виде углеводородов из продуктов реакции. Таким способом получают алмазные пленки и крупинки алмазов.
В 1963 г. В. В. Коршаком, А. М. Сладковым, В. И. Касаточкиным путём каталитического окисления ацетилена была получена третья аллотропная модификация углерода, составленная из ацетиленовых фрагментов (−С≡С−С≡С−)n. Эта модификация получила название полиин или α-карбин. Он образован длинными цепями атомов углерода (sp-гибридизация), между которыми реализуется сравнительно слабое взаимодействие.
Четвёртая модификация углерода – поликумулен или β-карбин – была получена искусственным путём и состоит также из линейных макромолекул, в которых атомы углерода соединены двойными связями (=С=С=)n. При озонолизе β-карбина получается угольная кислота, тогда как при озонолизе α-карбина – щавелевая кислота.
Теоретики давно предсказывали возможность существования аллотропных молекулярных модификаций углерода. Около двадцати лет назад они были обнаружены и получили название «фуллерены». Они представляют собой большие кластеры атомов С, в настоящее время известны фуллерены от С18 до С84 и более. Первыми были обнаружены фуллерены С60 и С70. Молекула С60 напоминает по форме покрышку олимпийского футбольного мяча – в ней 32 грани, 20 из которых являются шестиугольниками, а 12 – пятиугольниками. Каждый атом углерода в этой молекуле связан с тремя другими (sp2-гибридизация), а неиспользованные р-электроны образуют систему π-связей. Механизмы межатомного связывания в фуллеренах и объемном графите сходны, что даёт основание рассматривать фуллерены как сферическую форму графита.
Для синтеза фуллеренов применяют газофазный метод, где предварительно испаряют графит, а затем из газовой фазы на подходящих подложках формируют кластеры углерода. Получены фуллерены, где в молекулу С60 «загнаны» 3 атома щелочного металла, что делает их металлическими проводниками, а при низких температурах – сверхпроводниками. Получены и продукты замещения части атомов углерода в С60 на другие атомы. Внутри сферы С60 проявляется сильное давление, приводящее к сжатию электронных оболочек внутренних атомов. Удалось получить «луковичные» фуллерены, представляющие собой несколько сферических молекул, вложенных одна в другую. В результате внутренние сферы, испытывая огромное давление внешних сфер, достаточно легко превращаются в алмаз.
Помимо фуллеренов и «луковичных» структур известны наночастицы, нановоронки (подробнее о наночастицах и нанохимии – во второй части пособия) и нанотрубки. Последние открыты в 1991 г. и представляют собой закрученные в рулон графитовые слои. Внутренний диаметр таких трубок меняется от 0,7 нм до 10 нм в зависимости от условий синтеза. В настоящее время используют три основных способа получения графитовых нанотрубок: горение электрической дуги с графитовыми электродами, лазерное испарение графита и пиролиз газообразных соединений углерода.
Области практического применения графитовых нанотрубок ещё более широки, чем фуллеренов. Это и разделение веществ, и уникальные каталитические системы, и сверхпрочные материалы, и транзисторы из трёх атомов, и миниатюрнейшие процессорные устройства, и многое другое. А если учесть, что слоистые атомно-молекулярные системы встречаются не только у углерода, то возможности получения нанотрубочных композиций велики и разнообразны.
Химические свойства
Валентные возможности углерода по методу валентных связей (ВС) 2 и 4, степени окисления атома в соединениях от −4 до +4, основные соединения представлены степенью окисления +4.
При спекании порошкообразного угля (графита) с порошками металлов образуются карбиды. Карбиды d-элементов – химически инертные, тугоплавкие соединения. Карбиды щёлочноземельных элементов обсуждены выше.
В электрической дуге углерод способен соединяться с азотом, образуя дициан:
2С + N2
![]() (CN)2
(CN)2
При сгорании в избытке кислорода углерод образует углекислый газ; при недостатке кислорода, когда СО2 контактирует с раскаленным углем, образуется оксид углерода:
СО2
+ С![]() 2СО
2СО
Указанное равновесие чрезвычайно важно, так как кокс (уголь) широко используется в качестве восстановителя при получении металлов из оксидов. При температурах свыше 1000 оС указанное равновесие смещено вправо, поэтому при написании уравнений реакций высокотемпературного восстановления оксидов коксом следует писать справа СО, например:
Fe2O3
+ 3C
![]() 2Fe
+ 3CO
2Fe
+ 3CO
Наоборот, при температурах ниже 400 оС данное равновесие смеще-но влево, и в уравнениях следует писать СО2, например:
2CuO
+ C
![]() 2Cu
+ CO2
2Cu
+ CO2
Углерод не растворяется ни в минеральных кислотах, ни в растворах щелочей. Порошок углерода медленно окисляется концентрированной азотной кислотой и концентрированной серной кислотой (при нагревании):
С + 4HNO3 (конц.) = CO2 + 4NO2 + 2H2O
C + 2H2SO4
(конц.)
![]() CO2
+ 2SO2
+ 2H2
CO2
+ 2SO2
+ 2H2
Соединения
Оксид углерода (II), или угарный газ, малорастворим в воде, не взаимодействует с ней, как и с растворами минеральных кислот и щелочей; иными словами, СО является несолеобразующим оксидом. Ядовит; попав в лёгкие, он в сотни раз быстрее кислорода соединяется с гемоглобином крови, блокируя его способность переносить кислород.
Основным промышленным источником СО являются генераторный газ (продукт неполного сгорания кокса) и водяной газ, получаемый пропусканием водяного пара над раскалённым коксом:
H2O
+ C
![]() CO
+ H2
CO
+ H2
Лучшим лабораторным вариантом получения СО является обезвоживание (H2SO4(конц.), P2O5) концентрированного раствора муравь-иной кислоты:
HCOOH
![]() CO
+ H2O
CO
+ H2O
Строение молекулы по методу МО:
КК(σ2S)2(σ2S*)2(π2p)4(σ2pz)2; кратность связи равна трём.
СО проявляет исключительно восстановительные свойства:
4CO + Fe3O4
![]() 4CO2
+ 3Fe
4CO2
+ 3Fe
CO + Cl2
![]() COCl2
COCl2
С восстановительной активностью связаны и наиболее удобные химические способы обнаружения СО. Во-первых, это восстановление солей платиновых металлов до металла в растворе, например:
CO + PdCl2 + H2O = Pd↓ + CO2 + 2HCl
бесцв. черн.
Во-вторых, это восстановление бесцветного I2O5 до коричневого I2:
I2O5 + 5CO = 5CO2 + I2
Среди способов поглощения СО отметим образование комплексного соединения при пропускании этого газа через раствор хлоридного комплекса меди (I):
CO + H[CuCl2] = [CuCO]Cl + HCl
Многие металлы образуют с СО карбонилы. Их обычно получают прямым синтезом, например:
Ni + 4CO
![]() Ni(CO)4
Ni(CO)4
Re2O7
+ 17CO
![]() Re2(CO)10
+ 7CO2
Re2(CO)10
+ 7CO2
2CoCO3
+ 2H2
+ 8CO
![]() Co2(CO)8
+ 2CO2
+ 2H2O
Co2(CO)8
+ 2CO2
+ 2H2O
Условия синтеза: давление порядка 100–300 атм, температура 150–200 оС. При комнатной температуре карбинилы представляют собой жидкости, например Ni(CO)4, Fe(CO)5, или кристаллические вещества, например, Cr(CO)6, Fe2(CO)9. При температурах выше 200–250 оС они, как правило, разлагаются на металл и СО. Это используется в карбонильном методе очистки и получении чистых образцов металлов.
Промышленное получение диоксида углерода связано с термическим разложением карбонатов щёлочноземельных металлов, например:
CaCO3
![]() CaO
+ CO2
CaO
+ CO2
В лабораторных условиях СО2 получают, действуя минеральными кислотами на карбонаты:
CaCO3 + 2HCl = CaCl2 + CO2↑ + H2O
Na2CO3 + H2SO4 = Na2SO4 + CO2↑ + H2O
В целом СО2 характеризуется как кислотный оксид, окислительно-восстановительная активность ему не свойственна. Активные металлы, подожжённые на воздухе, продолжают гореть в атмосфере СО2:
2Mg
+ CO2
![]() 2MgO
+ C
2MgO
+ C
Основная масса растворённого в воде углекислого газа находится именно в форме СО2, и лишь незначительная его часть образует угольную кислоту – двухосновную кислородную кислоту. Константы диссоциации угольной кислоты являются кажущимися, так как они отнесены к общему количеству СО2 в растворе, а не к угольной кислоте, например, для первой ступени диссоциации:
 .
.
Как известно, Земля, получая энергию от Солнца, сама излучает в космос инфракрасные лучи, которое не пропускает углекислый газ. Накопление в атмосфере СО2 в результате деятельности человека должно вести к повышению температуры поверхности Земли (парниковый эффект). Для сравнения: атмосфера Венеры на 90 % состоит из углекисло-го газа, температура поверхности этой планеты около 500 оС. Техногенный выброс СО2 в атмосферу Земли составляет примерно 20 млрд т в год.
При температуре около 800 оС углерод и сера образуют сероуглерод:
C
+ 2S
![]() CS2
CS2
При комнатной температуре сероуглерод – жидкость, растворяющая Р, S, жиры, каучук и имеющая температуру кипения 46 оС. Сероуглерод является тиоангидридом, при температурах свыше 150 оС гидролизуется водяным паром:
CS2
+ 2H2O
![]() CO2
+ 2H2S
CO2
+ 2H2S
Сероуглерод при встряхивании с растворами сульфидов растворяется в них, образуя соли тиоугольной кислоты – тиокарбонаты:
CS2
+ Na2S
![]() Na2CS3
Na2CS3
Обработка растворов тиокарбонатов минеральными кислотами ведёт к вытеснению тиоугольной кислоты, разлагающейся на H2S и CS2:
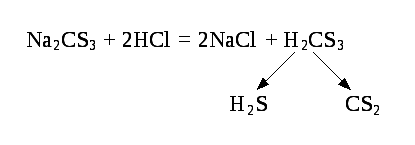
При температурах порядка 800 оС углерод образует с азотом дициан, являющийся ядовитым газом:
2C
+ N2
![]() (CN)2
(CN)2
Другие способы получения дициана:
2AgCN
![]() 2Ag
+ (CN)2
2Ag
+ (CN)2
Hg(CN)2 + HgCl2 = Hg2Cl2 + (CN)2
2CuSO4 + 4KCN = 2CuCN↓ + (CN)2 + 2K2SO4
В последнем случае для получения дициана следует обязательно вливать раствор цианида калия в раствор сульфата меди.
Дициан является термодинамически неустойчивым, ΔGо298 (CN)2 (г) = 309 кДж/моль, но устойчивым кинетически соединением. По химическим свойствам (CN)2 до некоторой степени сходен с галогенами, и поэтому получил название «псевдогалоген».
(CN)2 + H2 = 2HCN
(CN)2 + 2NaOH = NaCN + NaOCN + H2O
цианид цианат
(CN)2 + Cl2 = 2CNCl
хлорциан
Цианистый водород HCN является летучей жидкостью с tкип = 26 оС с запахом горького миндаля; сильный яд. В промышленности это соединение получают следующими каталитическими реакциями:
CO + NH3
![]() HCN + H2O
HCN + H2O
2CH4
+ 2NH3
+ 3O2
![]() 2HCN + 6H2O
2HCN + 6H2O
Безводный HCN – сильно ассоциированная жидкость с диэлектрической проницаемостью выше 100. Водный раствор HCN называется синильной кислотой, она чрезвычайно слабая, при 298,15 К Кдисс. = 6,0∙10−10. Именно по этой причине соли синильной кислоты – цианиды подвержены сильному гидролизу. Цианистый водород состоит из молекул двух видов, находящихся в таутомерном равновесии:
![]() .
.
При комнатной температуре это равновесие смещено влево.
Промышленное получение цианидов основано на следующих процессах:
NaNH2
+ C
![]() NaCN + H2
NaCN + H2
CaCN2
+ C + Na2CO3
![]() CaCO3
+ 2NaCN
CaCO3
+ 2NaCN
цианамид
кальция
K2CO3
+ 2NH3
+ C
![]() 2KCN + 3H2O
2KCN + 3H2O
Цианид-анион является сильным лигандом, дающим с ионами-комплексообразователями чрезвычайно прочные комплексы.
Известны циановая и изоциановая кислоты, находящиеся в таутомерном равновесии:
![]() .
.
Этим соединениям
изомерна гремучая кислота
![]() ,
соли которой могут взрываться при ударе.
,
соли которой могут взрываться при ударе.
Известны и тиоаналоги обсуждаемых соединений:
![]() .
.
Роданистый водород
(![]() )
– бесцветная маслянистая жидкость,
обладающая резким запахом и легко
разлагающаяся. Она хорошо растворяется
в воде, в водном растворе роданистоводородная
кислота достаточно сильная (Кдисс.
≈ 0,1), поэтому её соли – роданиды не
гидролизуются.
)
– бесцветная маслянистая жидкость,
обладающая резким запахом и легко
разлагающаяся. Она хорошо растворяется
в воде, в водном растворе роданистоводородная
кислота достаточно сильная (Кдисс.
≈ 0,1), поэтому её соли – роданиды не
гидролизуются.
Роданид калия можно получить, растворяя порошок серы в тёплом растворе цианида калия:
KCN
+ S
![]() KNCS
KNCS
или взаимодействием цианида калия с полисульфидами:
KCN + (NH4)2S2 = KNCS + (NH4)2S
Роданид аммония синтезируют при температуре 110 оС и повышен-ном давлении из концентрированного раствора аммиака, сероуглерода и гашёной извести:
2NH3
+ CS2
+ Ca(OH)2
![]() NH4NCS
+ CaS + 2H2O
NH4NCS
+ CaS + 2H2O
Роданиды являются реактивом на соли Fe3+ – при смешении растворов солей железа (III) с растворами роданидов наблюдается кроваво-красное окрашивание.
Большую практическую значимость имеет мочевина. Получение этого соединения двухстадийно. Сначала из NH3 и CO2 получают карбамат аммония – аммонийную соль амидоугольной кислоты:
CO2 + NН3 = NH4[О=С(NH2)O]
Затем, при нагревании до 180 оС под давлением 200 атм карбамат аммония, теряя воду, переходит в мочевину:

Мочевина является полным амидом угольной кислоты.
Соединения с металлами – карбиды – подразделяют на три группы. Первую составляют солеподобные карбиды щелочных и особенно щёлочноземельных металлов (Be2C, CaC2, Mg2C3), эти соединения разлагаются водой и минеральными кислотами с образованием углеводородов. Вторую группу составляют ковалентные соединения углерода с неметаллами типа B4C, SiC – химически инертные вещества, кристаллы которых характеризуются большой твёрдостью. Также химически инертны и тугоплавки интерметаллические карбиды внедрения d-элементов, составляющие третью группу и имеющие обычно состав МС и МС2.
Применение
На основе графита получают различные композиционные материалы; активированный уголь является хорошим адсорбентом. О перспективах использования фуллеренов и графитовых нанотрубок коротко было рассказано выше. Карбид кальция – источник получения ацетилена, ацетиленово-кислородное пламя развивает температуру до 3500 оС. Углекислый газ необходим при производстве соды и мочевины, в огромных количествах используется он для газирования жидкостей. Мочевина, в свою очередь, применяется как удобрение и является исходным соединением для получения производных угольной кислоты и ряда полимерных композиций.
Нефть, каменный уголь, природный газ и сланцы являются основой энергетики человечества.
