
- •Часть I
- •Введение
- •1. Введение в химию элементов
- •1.1. Распространённость химических элементов в природе
- •1.2. Распространенность химических элементов в атмосфере, гид-росфере и биосфере
- •1.3. Некоторые закономерности в изменении химических свойств элементов и их соединений
- •1.4. О форме таблицы д. И. Менделеева
- •2. Химия s-элементов и их соединений
- •2.1. Щелочные металлы
- •2.2. Бериллий, магний и щёлочноземельные металлы
- •3. Химия р-элементов и их соединений
- •3.2. Алюминий
- •2AlCl3(г)Al2Cl6(г)
- •3.3. Галлий, индий, таллий
- •3.4. Углерод
- •3.5. Кремний
- •3.6. Германий, олово, свинец
- •3.7. Азот
- •3.8. Фосфор
- •3.9. Мышьяк, сурьма, висмут
- •3.10. Кислород
- •3.11. Сера
- •3.12. Селен, теллур, полоний
- •3.13. Водород
- •3.14. Галогены
- •3.15. Благородные газы
- •Рекомендуемая литература
- •Оглавление
- •1. Введение в химию элементов 5
- •2. Химия s-элементов и их соединений 19
- •3. Химия р-элементов и их соединений 36
- •Начала химии Химия элементов и их соединений
- •Часть I
3. Химия р-элементов и их соединений
3.1. Бор
Природные источники и получение
В природе бор встречается исключительно в виде солей полиборных кислот, например, буры Na2B4O7∙10H2O, а также собственно борной кислоты Н3ВО3. При получении бора буру переводят в В2О3 (подкисление раствора и обезвоживание выделившейся Н3ВО3). Далее В2О3 восстанавливают Mg или Na при повышенных температурах:
В2О3
+ 3Mg
![]() 3MgO
+ 2B(аморф.)
3MgO
+ 2B(аморф.)
Бор получается в аморфном состоянии. Получение из него кристаллического бора затруднено из-за его высокой температуры плавления (2180 оС). Небольшие порции кристаллического бора получают по специальным методикам:
2BI3
![]() 2B(к)
+ 3I2
2B(к)
+ 3I2
3H2
+ 2BBr3
![]() 2B(к)
+ 3HBr
2B(к)
+ 3HBr
Возможно получение бора электролизом расплавов боратов и фторборатов.
Химические свойства бора
Кристаллический бор очень твёрд (твёрже его только алмаз), Sо298B(к) = 6,7 Дж/(моль∙К); относится к полупроводникам.
Валентные возможности
атома бора 1 и 3, степени окисления в
соединениях от −3 до +3 при доминирующей
+3. В большинстве соединений бора
химическую связь можно описать с позиции
sp2−гибридизации,
возможно и sp
(например
![]() )
и sp3
(например
)
и sp3
(например
![]() ).
).
При сильном прокаливании бор вытесняет элементы из оксидов CO2, SiO2, P4O10; это в значительной степени обусловлено очень низким значением энергии Гиббса образования В2О3 (к), при 298,15 К ΔGообрВ2О3(к)= = −1193,8 кДж/моль. Указанный оксид образуется при сгорании бора в атмосфере кислорода.
При спекании мелкораздробленного бора с порошками металлов образуются бориды этих металлов, например, MgB2, Mg3B2. Бор растворяется только в кислотах-окислителях:
B + 3HNO3
(конц.)
![]() H3BO3
+ 3NO2
H3BO3
+ 3NO2
2B + 3H2SO4 (конц.) = 2H3BO3 + 3SO2
Аморфный бор (или очень мелкораздробленный кристаллический) медленно растворяется в щелочах:
2B + 2KOH + 2H2O = 2KBO2 + 3H2
Наиболее эффективный способ переведения бора в растворимое в воде соединение – окисление «щелочным плавом»:
2B + 3KNO3
+ 2KOH
![]() 3KNO2
+ 2KBO2
+ H2O.
3KNO2
+ 2KBO2
+ H2O.
Соединения бора
Для бора достаточно характерно образование бороводородов (боранов). ВН3 (г) термодинамически нестабилен и легко димеризуется:
2BH3 (г) = B2H6 (г); ΔGо298 = −102 кДж.
Известны два гомологических ряда боранов с общей формулой BnHn+4 и BnHn+6, соединения первого ряда более стабильны. Все бороводороды имеют ΔGообр > 0, т. е. являются термодинамически неустой-чивыми соединениями, но характеризуются сравнительной кинетической устойчивостью. Принципиально бороводороды могут быть получены следующими способами:
Mg3B2 + 6HCl = B2H6 + 3MgCl2
6H2
+ 2BCl3
![]() B2H6
+ 6HCl
B2H6
+ 6HCl
2BCl3 + 6KH = B2H6 + 6KCl
В реальных условиях получается смесь боранов.
Особенности химической связи в этих соединениях рассмотрим на примере молекулы диборана В2Н6, в которой четыре атома Н и атомы В находятся в одной плоскости, а два других атома Н расположены над и под этой плоскостью:
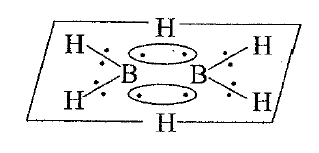
Первые четыре атома Н могут быть замещены на другие атомы без нарушения целостности молекулы диборана, тогда как попытка замещения двух других атомов водорода ведёт к разрушению молекулы. Как следует из электронного строения атомов бора и водорода на связи двух атомов бора с двумя атомами водорода по одному электрону у каждого атома бора и атома водорода, что явно не достаточно для образования четырёх двухцентровых связей. Поэтому об этих соединениях говорят как об «электронодефицитных» или «орбитальноизбыточных». Для объяснения химической связи в обсуждаемых соединениях привлекаются представления о трёхцентровой связи – пара электронов связывает не два, а три атома – атом водорода и два атома бора. Именно эта особенность химической связи в бороводородах (боранах) в значительной степени объясняет их химические свойства.
Для бороводородов характерны электроноакцепторные свойства:
B2H6 + 2K = K2B2H6
B2H6 + 2LiH = 2Li[BH4].
Они неустойчивы, загораются на воздухе:
B2H6 + 3O2 = B2O3 + 3H2O,
проявляют восстановительные свойства:
B2H6 + 6H2O = 2H3BO3 + 6H2
При прокаливании бора в атмосфере азота или оксида бора в атмосфере аммиака образуется нитрид бора – белый слоистый гетероатомный аналог графита. Он жирен на ощупь, делится на чешуйки, но не электропроводен, химически инертен.
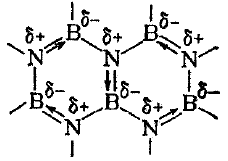
Если синтез вести при температурах свыше 1500 оС и давлении 60000–80000 атм, то получается алмазоподобная модификация нитрида бора. Техническое название этого продукта – боразон (США) и эльбор (СССР – Россия). По твердости этот материал близок к алмазу, но выдерживает нагрев до 2000 оС (алмаз сгорает уже при 800 оС).
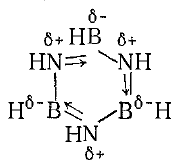
Известны и другие соединения азота и бора, например, B3N3H6 – триборинтриимид, называемый боразолом или неорганическим бензолом. Это соединение может быть получено:
3B2H6 + 6NH3 = 2B3N3H6 + 12H2
3Li[BH4] + 3NH4Cl = B3N3H6 + 3LiCl + 9H2
Это бесцветная жидкость, имеющая температуру плавления −56 оС и температуру кипения 55 оС. Молекула B3N3H6 изоэлектронна молекуле бензола, боразол похож на бензол по растворяющей способности и даже по запаху! Но боразол более реакционноспособен (полярные связи!), легче окисляется, растворим в воде и медленно в ней разлагается на H3BO3, NH3 и H2.
При высокой температуре образуется карбид бора:
7С + 2В2О3
![]() 6CO
+ B4C,
6CO
+ B4C,
являющийся отличным абразивным материалом.
В2О3 проявляет кислотные свойства, реагируя с основаниями с образованием боратов и метаборатов. Метабораты d-элементов окрашены, что позволяет использовать их для идентификации этих металлов.
Ортоборная кислота Н3ВО3 медленно образуется при гидратации В2О3:
В2О3 + Н2О → полиметаборные кислоты (НВО2)n → Н3ВО3
Она может быть выделена в кристаллическом виде из раствора при подкислении боратов:
Na2B4O7 + 2HCl + 5H2O = 4H3BO3 + 2NaCl,
имеет tпл. = 171 оС и ΔНраств. > 0. В кристаллическом виде представляет собой слоистый полимер со сравнительно прочными межмолекулярными водородными связями.
Борная кислота в водном растворе – слабая одноосновная кислота, при её нейтрализации получаются тетрабораты, метабораты и соли других полиборных кислот:
4H3BO3 + 2NaOH = Na2B4O7 + 7H2O
H3BO3 + NaOH = NaBO2 + 2H2O
H3BO3 нелетуча, поэтому вытесняет из солей более летучие кислоты, например:
H3BO3
+ NaCl
![]() NaBO2
+ HCl + H2O
NaBO2
+ HCl + H2O
В ортоборатах, например Mg3(BO3)2, содержатся ионы BO33−. В метаборатах одновременно присутствуют группы BO3 (структура правильного треугольника) и ВО4 (структура тетраэдра). Для боратов в кристаллическом состоянии характерны сложные структуры, в которых группы ВО3 и ВО4 образуют цепи и кольца, а в растворах – полиядерные ионы. В растворах при гидратации боратов фактически происходит превращение ионов О2− → ОН−.
Как соли слабых кислот бораты в водных растворах сильно гидролизованы и имеют рН > 7. Расплав буры растворяет оксиды металлов (так называемые перлы буры):
Na2B4O7
![]() 2NaBO2
+ B2O3
2NaBO2
+ B2O3
СoO
+ B2O3
![]() Co(BO2)2
Co(BO2)2
Na2B4O7
+ CoO
![]() 2NaBO2
+ Co(BO2)2
2NaBO2
+ Co(BO2)2
Галогенные соединения бора могут быть получены синтезом из элементов или восстановительным галогенированием оксида бора:
B2O3
+ 3C + 3Cl2
![]() 2BCl3
+ 3CO
2BCl3
+ 3CO
При комнатной температуре BCl3 и BF3 – газы, BBr3 – жидкость и BI3 – кристаллическое вещество. Все эти соединения являются фактически галогенангидридами борной кислоты, в водном растворе сильно гидролизованы:
BCl3 + 3H2O = H3BO3 + 3HCl
Гидролиз BF3 ведёт к образованию двух продуктов (H3BO3 и H[BF4]), что связано с взаимодействием ортоборной кислоты с HF:
4BF3 + 12H2O = 4H3BO3 + 12HF
12HF + 3H3BO3 = 3H[BF4] + 9H2O
4BF3 + 3H2O = H3BO3 + 3H[BF4]
Применение
Бор – компонент
сплавов;
![]() обладает большим сечением захвата
тепловых нейтронов, этим определяется
его использование в виде борсодержащих
сталей или карбида бора при изготовлении
контрольных стержней для ядерных
реакторов.
обладает большим сечением захвата
тепловых нейтронов, этим определяется
его использование в виде борсодержащих
сталей или карбида бора при изготовлении
контрольных стержней для ядерных
реакторов.
Бороводороды, в частности диборан В2Н6, представляют интерес как топливо.
Задание 4. Сравнить теплотворную способность угля, метана и диборана.
Решение. По справочным данным вычисляем энтальпии реакций сгорания:
С(к, графит) + О2(г) = CO2(г)
ΔНо298 = ΔНообр.СО2(г) = −393,5 кДж/моль.
CH4(г) + 2O2(г) = CO2(г) + 2Н2О(ж)
ΔНо298 = 2ΔНообр.Н2О(ж) + ΔНообр.СО2(г) − ΔНообр.СН4(г) =
= 2(−285,8) + (−399,5) – (−74,8) = -890,3 кДж
B2H6(г) + 3O2(г) = В2О3(к) + 3Н2О(ж)
ΔНо298 = 3ΔНообр.Н2О(ж) + ΔНообр.В2О3(к) − ΔНообр.В2Н6(г) =
= 3(−285,8) + (−1272,9) – 38 = −2168,3 кДж
На единицу массы (1 г) количество выделяющейся теплоты составит соответственно 32,8 кДж для углерода, 55,6 кДж для метана и 77,4 кДж для диборана.

Ортоборная кислота применяется для получения керамики, цементов, моющих средств и как дезинфицирующее вещество. Бура входит как компонент в состав флюсов для сварки и пайки металлов, вводится в шихту глазурей, эмалей, стекол и керамики, применяется в качестве микрокомпонента удобрений. Боралюмосиликатное стекло «пирекс» менее чем обычное растворимо в воде и имеет значительно меньший температурный коэффициент расширения, поэтому из него изготавливают жаростойкую и химическую посуду.
