
Хирургия аорты и магистральных артерий. Шалимов А.А
..pdf
|
|
|
|
|
|
69 |
Основные |
недостатки |
способа: |
технические |
трудности |
при |
резекции |
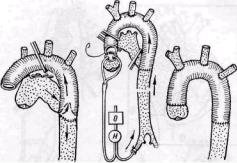
Рис. 30. Полное замещение дуги аорты по поводу ее аневризмы синтетическим сосудистым трансплантатом в условиях искусственного кровообращения (метод De Bakey). Селективная перфузия безымянной, левой общей сонной и венечных артерий аневризмы и замещении дуги аорты, расположенной кзади от временного шунта, большая продолжительность операции (13 анастомозов и 4 боковых сосудистых шва). Этот способ в настоящее время применяют очень редко.
Gwathmey и соавторы (1958) предложили временный шунт превращать в постоянный, ушивая наглухо поперечные сечения аорты и брахиоцефаль-ных ветвей после резекции аневризмы (рис. 29, б), что позволяет сократить продолжительность операции. Heberer и соавторы (1969) на основании собственного опыта и анализа данных литературы считают, что способ операции («постоянный шунт-трансплантат») в условиях средней гипотермии обеспечивает лучшие результаты, чем другие методы.
Преимущество способов «шунт-резекции» состоит в возможности избежать применения искусственного кровообращения, что особенно важно у пожилых больных. Отпадает необходимость в применении гепарина, в связи с чем уменьшается кровопоте-ря через поры протеза и возможно использование крупнопористых, в биологическом отношении более полноценных протезов.
2. Замещение дуги аорты в уело виях искусственного кровообращени? по De-Bakey и соавторам (1960, 1966) Схема подключения АИК обычна5 (рис. 30). Перфузию плечеголовногс ствола и левой сонной артерии осу ществляют независимо от общей пер фузии
с помощью отдельных насосо! (De |
Bakey |
и соавт., |
1953; Asano |
i соавт., 1969) или же |
||
канюли соединяют с общей |
системой артериальной |
перфузии |
(Guilment). |
|||
Целесообразнс осуществлять перфузию |
мозговых |
сосудов |
в |
условиях |
средней |
|
степенр гипотермии, что обеспечивает дополнительную защиту мозга (Nicks, 1972), После пережатия и рассечения аорть начинают перфузию коронарных сосудов. Аневризму иссекают полностьк или частично. Дефект аорты замещаю! сосудистым трансплантатом. Боковые ветви трансплантата анастомозирукл последовательно конец в конец с левой подключичной, левой сонной артериями и плече-головным стволом.
Предложено канюлировать сосуды вне операционного поля на грудной клетке — через правую и левую плечевые и левую сонную артерии, чтс облегчает манипулирование на аневризме (Реагсе и соавт., 1969; Nicks и соавт., 1972).
Все различные типы аневризм дуги аорты и ее восходящей части могут быть оперированы в условиях искусственного кровообращения. Недостатки способа — продолжительное время экстракорпорального кровообращения, гепаринизация, в связи с чем возможна значительная кровопотеря через поры протеза, необходимость использования мелкопористых протезов.
3. Метод ретроградной реваскуля-ризации, предложенный Hu-You-Lin и соавторами (1964), позволяет значительно уменьшить продолжительность искусственного
medwedi.ru
70
кровообращения. Протез вначале анастомозируют с нисходящей аортой (конец протеза в бок аорты), затем последовательно с левой подключичной, левой сонной артериями и плече-головным стволом (конец артерий в бок протеза). Зажим последовательно перекладывают прокси-мальнее каждого анастомоза, чтобы обеспечить ретроградную реваскуля-ризацию брахиоцефальных ветвей (рис. 31). Экстракорпоральное кровообращение и гепаринизация требуются только на последнем этапе операции — при анастомозировании протеза с восходящей аортой.
Операцию осуществляют через срединную стернотомию с левосторонней торакотомией по V межребер ью в положении больного на правом боку.
Carpentier и соавторы (1971) считают целесообразным применять методы ретроградной реваскуляризации при поражении всей дуги аорты, а способ De Bakey — в условиях искусственного кровообращения при поражении проксимальной части дуги аорты.
Лечение аневризм нисходящей аорты. Этот сегмент аорты относительно легко доступен для хирургического вмешательства. Операцию выполняют через левостороннюю задне-боковую торакотомию по V, а при низких аневризмах — по VI или V межреберьям. Этот разрез обеспечивает доступ к грудной аорте от левой подключичной артерии до диафрагмы, а также возможность использования шунтирования, в том числе экстракорпорального кровообращения, между левым предсердием и левой бедренной артерией.
Удаление аневризм нисходящей аорты представляет собой менее сложную проблему, чем проксимальных ее отделов. Основной задачей является защита спинного мозга от ишемии во время резекции аневризмы и пластики аорты. Для защиты спинного мозга эт ишемического повреждения предложены разные методы. К ним относятся: способ временного наружного нунтирования в обход резецируемого сегмента аорты с использованием сосудистого протеза или пластмассовой грубки (Kahn, 1970). Недостаток ме-
Рис. 31. Схема резекции аневризмы аорты методом ретроградной реваскуляризации (по Hu-You-Lin с соавт., 1964); протез анасто-мозируют с нисходящей аортой конец в бок, затем последовательно с левой подключичной, левой общей сонной (а) и безымянной артериями (б), перекладывая проксимальнее каждого анастомоза зажим, чтобы обеспечить ретроградную реваскуляризацию брахиоцефальных ветвей. Использование экстракорпорального кровообращения требуется только при анастомозировании протеза с восходящей аортой. Дугу аорты замещают синтетическим сосудистым протезом (в)
тода — значительная продолжительность операции.
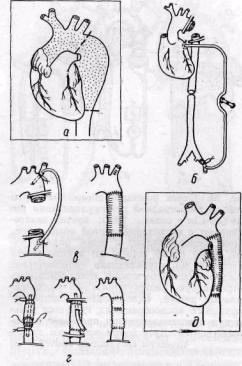
Метод временного внутреннего шунтирования. На шунт (пластмассовую трубку) одевают протез, резецируют аневризму, и анастомозы конец в конец ушивают на внутреннем шунте (рис. 32). Шунт удаляют через поперечный разрез протеза.
Кеап и Frimble (1968) применили простой метод резекции с использованием внутреннего шунта. Они не иссекают аневризму, а рассекают ее продольно, удаляют тромбы, атероматозные массы, иссекают избыток ткани и снова ушивают выключенный сегмент аорты. Оставление части стенки аневризмы, по их мнению, позволяет сохранить кровоснабжение спинного мозга через межреберные сосуды и избежать неврологических осложнений, связанных с резекцией большого сегмента аорты. Антикоагулянты и экстракорпоральное
71
кровообращение авторы не применяют, аорту пережимают во время операции на 2—3 мин.
Рис. 32. Методы резекции веретенообразной аневризмы нисходящей аорты:
а, д — резекция аневризмы и замещение ее сосудистым протезом; 6 — использование экстракорпорального шунта между левым предсердием и левой бедренной артерией; в — способ временного наружного шунтирования с применением пластмассовой трубки; г — способ временного внутреннего шунтирования; шунт удаляют через поперечный разрез протеза Способ экстракорпорального шунтирования между левым предсердием и бедренной
артерией с использованием насоса без оксигенератора в настоящее время применяют большинство авторов (Leads, Culiner, 1952; De Bakey и соавт., 1960; Taber, 1970, и др.). Объем перфузии 80— 100 мл/мин/кг (Taber, 1970). Преимущество способа: уменьшается продолжительность вмешательства на аорте, надежный контроль кровообращения, незначительная операционная крово-потеря. Недостатки: необходимость применения гепарина и в сбязи с этим использование биологически менее полноценных мелкопористых протезов.
Метод периферического экстракорпорального кровообращения заключается в следующем. Катетер ввод в нижнюю полую вену через бедре ную вену;
перфузию нижней полови] тела осуществляют через бедренн; артерию. По мнению Schildberg Heberer (1971), такой способ искус< венного кровообращения может бы применен при угрожаемом состояв пациента еще до выполнения торак томии.
Предложено использовать гипоте мию средней степени, что позволя пережимать аорту до 60 мин.
Резекция аневризмы без примен ния специальных методов защю спинного мозга при кратковременнс пережатии аорты (Crawford и соавп 1970): аневризматический мешок пос. его продольного рассечения и ушив ния боковых сосудов изнутри оста ляют in situ, дефект аорты замещай протезом (анастомоз конец в конец после чего его окутывают аневризм; тической оболочкой. Время переж; тия аорты не должно превышать 30-45 мин (Harrison, 1970). Crawford соавторы (1970) сравнили результат лечения двух групп больных с ане! ризмой нисходящей части аорты, л< ченных этим способом и с применение шунтирования, и не выявили сущее' венной разницы. Harrison (1970) C4i тает, что упрощение методики оперг ции без применения шунтировани имеет преимущество перед другим методами.
medwedi.ru
72
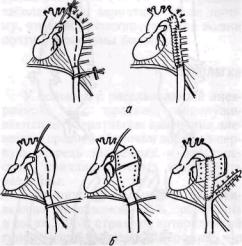
Наиболее важными факторами, вы зывающими ишемическое поврежде ние спинного мозга при резекции анен ризм нисходящей аорты, считаютс объем резекции, число лигируемы: сегментарных ветвей, характер и про тяженность поражения, варианты кро воснабжения спинного мозга. Опас ность возникновения параплегии боль ше при обширной резекции по повод] расслаивающей аневризмы аорты, Tai как сам по себе патологически! процесс вызывает облитерацию межре берных и поясничных артерий. Факти чески 4/э параплегии связаны с резек циями большого сегмента аорть (Schildberg, Heberer, 1971). В этой связи целесообразно выполнять экономную резекцию аневризмы, сохраняя, насколько возможно, межреберные артерии. При обширной резекции аорты необходимо вшить в протез крупные межреберные артерии, а тромбированные сосуды перевязать. Cranford и соавторы (1968) предложили имплантировать в протез заднюю стенку аорты с 8—12 межреберными артериями или резецировать аневризму лишь частично, ушивать аневризматический мешок, анастомо-зируя протез конец в конец — проксимально, конец в бок аорты -— дистально (рис. 33). Может быть использована также методика Кеоп и Frimble (1968), описанная выше.
Лечение торако-абдоминальных аневризм. Аневризмы этой локализации вовлекают в процесс сосуды, снабжающие кровью органы брюшной полости и забрюшинного пространства (чревной ствол, верхняя брыжеечная, почечные артерии), сдавливают пищевод и кардиальный отдел желудка. У большинства больных отмечаются боль в подложечной области, отрыжка, рвота, дисфагия, приступообразная боль в животе (брюшная жаба), нередко артериальная гипертензия. Нередко больным ошибочно ставят диагноз рака желудка.
Грудо-брюшные аневризмы обычно не определяются при пальпации. Для диагностики и уточнения локализации необходима аортография. Кли-нико-рентгенологические исследования грудной клетки, пищевода и желудка дают возможность заподозрить это заболевание. Перед операцией исследуют функцию почек.
В качестве трансплантата после резекции аневризмы применяют сложные сосудистые протезы с боковыми ветвями для замещения артерий под-диафрагмального сегмента аорты. Хирургическое лечение торако-абдоминальных аневризм представляет более сложную проблему по сравнению с лечением аневризм нисходящей аорты. Для предупреждения ишемического повреждения спинного мозга и органов
Рис. 33. Методы предупреждения ишемичес-ского повреждения спинного мозга при
резекции аневризмы нисходящей аорты: а — имплантация |
задней стенки |
аорты с |
||
межреберными артериями (8 — 12 артерий) в сосудистый |
протез; |
б |
— |
частичная |
резекция аневризмы с сохранением межреберных артерий |
(8—-12) |
и |
анастомозом |
|
конец в бок между протезом и аортой |
|
|
|
|
брюшной полости во время резекции аневризмы используют метод временного шунтирования синтетическим сосудистым протезом с последующим превращением его в постоянный шунт (методОе Bakey с соавт., 1960, рис. 34). При поражении только устья

73
чревной артерии может быть применен описанный выше способ Кеоп и Frimble (1962) с использованием временного внутреннего шунта. Чревную артерию вшивают в протез до удаления шунта. При аневризмах этой локализации применяют левосторонний торако-аб- доминальный доступ (торакофренола-паротомия). Разрез кожи — по VII или VIII межреберью от средней подмышечной линии в косом направлении, а затем по средней линии живота. Пересекают хрящи реберной дуги, плевру, брюшину, а также диафрагму до аортального отверстия. Вскрывают забрюшинное пространство слева. От-препаровывают аорту проксимально и дистально от аневризмы, чревную, почечные и верхнюю брыжеечную артерии и под них подводят турникеты. Производят боковое пережатие
Рис. 34. Схема резекции аневризмы грудобрюшного сегмента аорты методом временного наружного шунтирования синтетическим сосудистым протезом с последующим превращением временного шунта в постоянный (по De В a key с соавт., 1960)
зажимом Сатинского аорты выше аневризмы с тем, чтобы не нарушать кровоток в аорте, и вшивают конец сосудистого протеза в бок аорты. Трансплантат готовят до операции с ветвями для почечных, чревной и верхней брыжеечной артерий, которые должны быть несколько большего диаметра, чем артерии. Дистальный конец протеза анастомозируют с аортой ниже аневризмы конец в бок или конец в конец. Пересекают левую почечную артерию и ее дистальный конец анастомозируют с соответствующей ветвью протеза, после чего открывают параллельный кровоток по протезу. Затем аневризму иссекают, сшивают правую почечную артерию конец в конец с соответствующей ветвью протеза и открывают кровоток в правую почку. Подобным образом восстанавливают кровоток в чревной и верхней брыжеечной артериях. Проксимальное и дисталь-ное поперечное сечение аорты зашивают. Особое внимание необход: обращать на то, чтобы не было ш гиба отходящих от
протеза вет (опасность тромбоза). При такой тодике операции прекращение крс тока в почках не должно превыш 20—30 мин, в кишечнике и в печенр 40—50 мин. Аневризмы синусов Вальсаль Аневризма области корня аорты в л те расположения полулунных кла нов носит название аневризмы син Вальса львы. Эта патология встречг ся редко. В большинстве случаев блюдаются аневризмы правого сину Они имеют чаще сифилитическую п роду или развиваются вследст) врожденной неполноценности элас ческих структур аорты (синдр Марфана).
Клиническая картина определя ся симптомами часто развивающш при этой патологии недостаточно! аортального клапана, сужения прос та коронарных артерий, сдавления . точной артерии и правого предсерд (синдром правожелудочковой недос точности), верхней полой вены. AHI ризмы малого размера не выявля себя до разрыва, который
medwedi.ru
74
nponcxoi обычно в полость перикарда, прав отделы сердца с развитием синдро перенапряжения правого желудоч! Распознать аневризму синуса Baj сальвы до разрыва аневризмы край сложно.
Аневризмы синусов Вальсаль: иногда выявляются на обычн рентгенограмме, произведенной в nf вой задней косой позиции. Aopi и ангиокардиография позволя! диагностировать эту патологию, ос бенно при прорыве аневризмы в пр вый желудочек.
Прогноз при аневризме синус Вальсальвы неблагоприятный.
Результаты лечения. Аневризи грудной аорты являются наиболее т желой патологией в ангиохирурги Риск операций по поводу аневри; грудной аорты очень высокий. Наиб лее высокая
операционная летал ность, а также наибольшие технич ские трудности наблюдаются при удалении веретенообразных аневризм восходящего отдела и дуги аорты и составляют, по данным разных авторов, от 20 до 75% (Б. Д. Комаров, 1967; De Bakey и соавт., 1968; Heberer и соавт., 1969, и др.). Летальность при резекции аневризм нисходящей аорты значительно ниже — 12—38%. Неврологические осложнения (парапарез, параплегия) после резекции аневризмы нисходящей аорты наблюдаются у 5—10% больных (Heberer, Schild-berg, 1970).
Результаты хирургического лечения травматических аневризм грудной аорты значительно лучше по сравнению с таковыми при аневризмах другой природы (сифилис, атеросклероз, медионекроз), что обусловливается лучшим общим состоянием больных, в большинстве молодого возраста, с травматическими аневризмами.
Отмечено, что артериальная гипер-тензия, коронарная недостаточность, выраженный атеросклероз, недостаточность аортального клапана значительно увеличивают риск операции. Операционная летальность уменьшается в зависимости от накопления опыта лечения больных с этой патологией.
75
РАССЛАИВАЮЩИЕ АНЕВРИЗМЫ ГРУДНОЙ АОРТЫ
Расслаивающая аневризма представляет собой расслоение (диссек-цию) стенки аорты чаще в продольном направлении и на большом протяжении с кровоизлиянием между слоями, возникающее обычно при дегенеративных изменениях среднего слоя или повреждении стенки сосуда. Расслаивающая аневризма, в сущности, является осложнением заболеваний или повреждений аорты.
Заболевание впервые описано Morgagm (1761), более подробно — Maunoiz (1802) и Laennec (1819), которые дали ему название «расслаивающая аневризма». Расслаивающая аневризма считается относительно редким заболеванием, вероятно, также потому, что не
диагностируется при жизни почти у половины больных
ЭТИОЛОГИЯ
Убольных с расслаивающей аневризмой, как правило, обнаруживаются дегенеративные изменения элементов средней оболочки аорты, в первую очередь мышечных и эластических, причины которых могут быть различны.
Большинство больных с расслаивающей аневризмой (84%, по Dennis и соавт., 1965) страдают артериальной гипертензией и атеросклерозом, что послужило поводом считать гидравлический удар об аортальную стенку одним из основных механизмов патогенеза расслаивающей аневризмы. Однако значение артериальной гипер-тензии и сам механизм диссекции в настоящее время все еще недостаточно ясны. При гистологическом исследовании часто находят у больных описанный Erdheim (1930) идиопатиче-ский кистозный медионекроз аорты, который развивается обычно в восходящей части и в дуге аорты и в основном наблюдается в возрасте старше 40 лет. "Это заболевание характеризуется очагами некроза в мышечном слое стенки аорты, разрывом эластических мембран и образованием различной величины полостей, заполненных слизеподобной массой. Происхождение его связывают с инфекцией, интоксикацией, ревматизмом.
Улиц молодого возраста в этиологии расслаивающей аневризмы аорты значительную роль играют врожденные системные заболевания соединительной ткани, проявляющиеся дефектом эластических элементов (болезнь Марфана, синдром Ehlers — Dan I os и др.), слабость эластической ткани у беременных, развивающаяся под влиянием гормонов в последние 3 мес беременности. Известны случаи возникновения расслаивающей аневризмы при коарктации аорты, сифилисе, гигантоклеточном артериите, после аортографии и экстракорпорального кровообращения. Диссекция стенки аорты может быть также следствием прогрессирования истинной аневризмы или травмы аорты при тяжелых повреждениях грудной клетки с компрессией ее, множественными переломами ребер, грудины (O'Sullivan и соавт., 1972).
ПАТОЛОГИЧЕСКАЯ АНАТОМИЯ
Разрыв интимы и начало расслоения средней оболочки наблюдаются дистальнее левой подключичной артерии или в восходящей аорте, обычно над аортальным клапаном. Реже начало диссекции отмечается в дуге или брюшном отделе аорты.
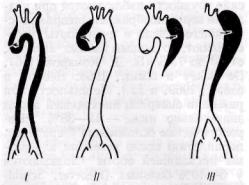
Расслоение стенки аорты, как правило, прогрессирует в дистальном направлении нередко на всем протяжении аорты. В зависимости от места разрыва интимы и протяженности диссекции выделяют различные типы расслаивающих аневризм. Большинство хирургов выделяют три основных их типа, описанные De Bakey и соавторами в 1965 г. (рис. 35).
Расслоение может распространяться на стенку ветвей аорты и вызвать сужение или закупорку ветвей дуги аорты, почечных, брыжеечных, подвздошных сосудов с развитием соответствующих ишемических синдромов. Закупорка межреберных и поясничных артерий может привести к ише-мическому поражению спинного мозга (параплегия). При вовлечении в процесс аортального кольца возникает недостаточность клапанов аорты.
medwedi.ru
76
Расслоение стенки развивается быстро и обычно не по всей окружности сосуда, а в продольном направлении в виде ленты или спирали и редко ограничивается одним сегментом аорты. Отслоенная наружная оболочка растягивается, истончается. В случае спонтанного течения у большинства больных происходит разрыв аневризмы, почти всегда заканчивающийся летальным исходом, в перикард (у
Рис. 35. Типы расслаивающей аневризмы аорты в зависимости от места начала расслоения и его протяженности (по De Bakey с соавт., 1965)
50% больных), плевру и средостение (у 20%), в брюшную полость и забрю-шинное пространство. Вторичный разрыв внутренней оболочки обычно в области дистальной границы аневризмы с образованием ложного внут-ристеночного канала («double-barrel- aorta» — «двуствольная аорта») и декомпрессией внутристеночной гематомы наблюдается относительно редко (у 10% больных). Редким исходом является тромбоз и облитерация внут-ристеночного канала.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Клиническая картина при расслаивающей аневризме может быть различной в зависимости от типа аневризмы и течения. У большинства больных наблюдается типичное острое начало с возникновением симптомов шока. Почти постоянный признак (у 70% больных)
— остро развивающаяся, продолжительная боль за грудиной, в межлопаточной области, в связи с чем большинству больных ставят предположительный диагноз инфаркта миокарда. Артериальная гипертензия в анамнезе, а у многих больных в начальной стадии заболевания, является одним из ведущих симптомов. Коллапс, в отличие от инфаркта миокарда, наблюдается редко и свидетельствует о значительной протяженности расслоения или разрыве аневризмы и внутреннем кровотечении. Важным клиническим дифференциально-диагностическим признаком, в отличие от инфаркта миокарда, И. Б. Олешкевич и соавторы (1974) считают нормальную частоту пульса или незначительную тахикардию (до 90 ударов в 1 мин) даже при коллаптоидном состоянии.
Для расслаивающей аневризмы характерен нисходящий тип развития симптомов: распространение боли с области груди, спины на область живота, развитие абдоминального синдрома, неврологических симптомов (параплегии), ишемии нижних конечностей. У некоторых больных абдоминальный синдром является ведущим в клинике заболевания, характеризуется сильной болью в животе, тошнотой, рвотой, болезненностью при пальпации и является причиной ошибочной диагностики острых абдоминальных хирургических заболеваний (перфоративная язва желудка и двенадцатиперстной кишки, острый холецистит, панкреатит, аппендицит) и даже оперативных вмешательств на органах брюшной полости. Logue и Sikes (1952) описали характерный для расслаивающей аневризмы симптом — появление пульсации в области грудино-ключичного сочленения.
Для диагностики имеют значение выявление возможных этиологических факторов (гипертония, системное заболевание соединительной ткани, беременность) и объективные данные: диастолический шум на аорте вследствие недостаточности аортального клапана, асимметрия пульсации на артериях шеи и верхних конечностей, изменение пульсации при
77
повторных исследованиях, парадоксальный пульс (признаки гемоперикардиума), абдоминальный синдром (тошнота, рвота, боль в животе, болезненность при пальпации), уремия (олигурия, ану-фия, увеличение остаточного азота крови), теми- и параплегия, ишемия нижних конечностей.
Многоосевая рентгеноскопия и рентгенография органов грудной клетки часто позволяют выявить рентгенологические признаки аневризмы: расширение тени, особенно при повторных исследованиях, или двойной контур аорты (патогномоничный признак), особенно отчетливо определяющиеся при кальцификации стенки аорты.
Наиболее точным, достоверным и решающим методом диагностики является аортография, однако применение ее при острой расслаивающейся аневризме не лишено риска. При тяжелом состоянии больного аортография противопоказана (Р. С. Ер-молкж, 1968; М. Я. Лапинер, 1969). Однако этот метод исследования в настоящее время является единственным, позволяющим определить характер патологии, локализацию разрыва интимы и протяженность расслоения стенки аорты. Контрастное вещество следует вводить непосредственно в область локализации предполагаемого разрыва интимы, так как в этом случае обеспечивается максимум информации при относительно низком риске для больного (Baron, 1971). Катетеризацию аорты осуществляют через правую плечевую или бедренную артерию. Анализ литературы показывает (Baron, 1971; Rosenberg, Mulder, 1972, и др.), что в настоящее время аортографию применяют чаще, чем раньше.
Основные показания к аортогра-фии сводятся к следующему: а) если предполагается хирургическое вмешательство, то есть с целью уточнения локализации разрыва интимы и распространенности диссекции; б) в случае сомнения в диагнозе для решения вопроса о целесообразности применения гипотензивной терапии; в) при окклюзии крупных ветвей аорты. Если аортография не выполнена в острой фазе заболевания, то при стабилизации процесса в хронической стадии она показана почти во всех случаях (Lindsay, Hurst, 1971). Точная и ранняя диагностика расслаивающей аневризмы аорты является сложной проблемой. В связи с острым началом заболевания, нередко тяжелым состоянием больного часто не представляется возможным провести подробное клиническое и специальное исследование. Дифференцировать приходится в первую очередь с инфарктом миокарда. Наибольшее значение имеют данные ЭКГ (несоответствие интенсивности боли и данных ЭКГ), биохимические (содержание трансаминаз в крови при аневризме не повышено) и рентгенологические исследования. При выраженном абдоминальном синдроме необходимо дифференцировать с прободной язвой желудка и двенадцатиперстной кишки, тромбозом мезентериальных сосудов, острым панкреатитом. При синдроме ишемии нижних конечностей надо исключить тромбоэмболию бифуркации аорты.
Бывают случаи атипичного, скрытого (немого) развития расслаивающей аневризмы, даже распространяющейся на большом протяжении аорты. Решающим для диагностики является ангиографическое исследование.
Прогноз при расслаивающей аневризме чрезвычайно неблагоприятный. Большинство больных умирают через несколько дней или часов после развития заболевания в результате разрыва аневризмы и кровотечения. Через 6—12 нед остаются живыми примерно 10% больных (Hirst и соавт., 1958) с хронической диссекцией в результате внутреннего разрыва в просвет сосуда или тромбирования ложного канала Пациенты с хронической диссекцией могут жить в течение нескольких лет. Практическим хирургам чаще приходится встречаться с хроническими стадиями расслаивающей аневризмы грудной аорты.
ЛЕЧЕНИЕ
Тяжелый прогноз при спонтанном течении расслаивающей аневризмы оправдывает относительно широкие показания к хирургическому лечению больных. Опубликованные данные в
medwedi.ru
78
отношении оптимальной тактики Л1 чения таких больных противоречивь Ряд хирургов считают оперативное л< чение в ранние сроки методом выбор почти во всех случаях расслаивающе аневризмы (И. В. Генов и соавт 1973; De Bakey и соавт., 1960, 196Е Vollmar, 1967, и др.). Другие являкл ся сторонниками медикаментозной (ги потензивной) терапии болыпинега больных с острой расслаивающе] аневризмой (Wheat и соавт., 1965 1969). Как и многие хирурги (Acai и соавт., 1969; Lindsay, Hurst, 1971 Rosenberg, Mulder 1972, и др.), мь придерживаемся мнения о необходимости дифференцированного Выборг метода лечения в зависимости от особенностей каждого отдельного случая, выделяя показания к срочному оперативному и медикаментозному лечению.
Медикаментозное лечение. При острой расслаивающей аневризме обследование и лечебные мероприятия следует производить в ургентном порядке. Помимо клинического обследования необходимо выполнить ЭКГ, рентгенографию грудной клетки, наладить постоянный контроль за артериальным давлением, пульсом, диурезом. При тампонаде перикарда производят его пункцию или дренирование через эпигастральную область. С целью уменьшения опасности прогрессиро-вания расслоения и разрыва аневризмы назначают гипотензивную терапию. Целесообразно применять средства, снижающие артериальное давление и уменьшающие силу сердечных сокращений. Арфонад вводят в
вену капельно в дозировке, обеспечивающей медленное (в течение 1—2 ч) снижение систолического давления до 100 мм рт. ст. и поддержание его на этом уровне. Назначают индерал самостоятельно или в сочетании с другими препаратами (1 мг в мышцы каждые 4—6 ч и 60—160 мг в день внутрь). Так как индерал оказывает незначительное (или совсем не оказывает) влияние на артериальное давление, то его целесообразно применять у больных с нормальным или близким к нормальному давлением, а также при длительном лечении. В последнем случае назначают также резерпин. Переливание крови противопоказано.
Исчезновение или ослабление боли свидетельствует о том, что прогрес-сирование расслоения приостановлено.
Наблюдение за больным предполагает следующие исследования: измерение артериального давления и частоты пульса, определение пульсации артерий на шее и конечностях (появление асимметрии, исчезновение пульсации!), аускультация тонов сердца (признаки развивающейся недостаточности аортальных клапанов), измерение диуреза и определение наличия эритроцитов в моче, гематокрита, повторные ЭКГ, рентгенография грудной клетки через 12 ч.
Этот комплекс начальных лечебных мероприятий целесообразно проводить у большинства больных независимо от того, какой способ лечения будет предпринят в дальнейшем. Такая тактика лечения позволяет остановить или замедлить развитие процесса, обеспечить время для обследования и организации операции, облегчает выбор оптимального способа лечения. В условиях неспециализированного хирургического отделения медикаментозное лечение, по сути, является методом выбора. К этому следует добавить, что риск операции, выполненной при стабилизации процесса, в хронической стадии значительно меньше, чем в острой фазе (De Bakey и соавт., 1965). Wheat и соавторы (1969) считают, что при контролируемой гипотензивной терапии более 80% больных можно вывести из острой стадии заболевания.
Хирургическое лечение. С хирургической точки зрения лучшим способом лечения расслаивающей аневризмы является резекция сегмента аорты в месте начального разрыва интимы, ушивание расслоенных оболочек и восстановление непрерывности аорты путем реанастомоза конец в конец или с интерпозициеи сосудистого трансплантата (рис. 36).
Этот способ оперативного лечения расслаивающей аневризмы, разработанный De Bakey и соавторами, находит все более широкое применение (Б. В. Петровский, 1965; Austen и соавт., 1967, 1970; Lindsay, Hurst, 1971, и др.). Наибольший риск операции (летальность до 80%) — при резекции аневризмы восходящей аорты, так как требуется полное искусствен-
