
Хирургия аорты и магистральных артерий. Шалимов А.А
..pdf49
сейнами кровообращение в нижних отделах тела значительно понижено, в связи с чем задерживаются рост и развитие организма, в более раннем возрасте развиваются симптомы ишемии нижних конечностей. С возрастом у больных развивается гипертензия малого круга кровообращения.
При постдуктальном типе коарктации с функционирующим артериальным протоком течение заболевания характеризуется быстрым развитием гипертензии малого круга кровообращения, легочной и сердечной недостаточности. Вследствие изменений как левых, так и правых отделов сердца, рано появляются признаки тяжелой недостаточности кровообращения (обычно в дошкольном возрасте, с 5—6 лет). Однако разрывы артерий и кровоизлияния в мозг наблюдаются относительно редко при этом типе коарктации.
Нарушения гемодинамики, подобные описанным выше, наблюдаются при артериальновенозном сбросе вследствие сочетания коарктации с другими пороками сердца и сосудов
— дефектами перегородок сердца, аорто-легочным свищом. В зависимости от величины сброса крови и степени сужения аорты в гемодинамических нарушениях превалируют явления сброса крови или признаки коарктацион-ного синдрома.
Предуктальный тип коарктации аорты с функционирующим артериальным протоком, расположенным ди-стально от сужения, характеризуется венозно-артериальным сбросом крови. Это так называемый инфантильный тип коарктации (по Bonnet, 1903).
При типичном варианте этого порока (широкий проток и полная или почти полная окклюзия аорты) верхняя часть тела получает артериальную кровь из системы ветвей дуги аорты, а нижняя обеспечивается почти исключительно венозной кровью из правого желудочка через легочную артерию и открытый артериальный проток. Проток, по сути, выполняет роль коллатерального сосуда и обычные пути коллатерального кровотока в утробном периоде практически не развиваются. Сужение аорты при отсутствии выраженного коллатерального кровотока приводит к повышению артериального давления в системе сосудов выше места сужения и перегрузке левого желудочка уже у новорожденных и детей раннего возраста. В связи с увеличением массы циркулирующей крови в малом круге (на величину сброса крови) отмечается перегрузка и правого сердца. В итоге рано развивается право-и левожелудочковая недостаточность. Заращение артериального протока отягощает и ускоряет развитие сердечной недостаточности, так как не успевает развиться достаточное коллатеральное кровообращение. В связи с этим при предуктальной коарктации в сочетании с открытым артериальным пороком большинство больных умирают на первом году жизни. Предуктальный тип коарктации особенно часто сочетается с другими пороками развития сердца и сосудов, что еще более отягощает прогноз заболевания (Та-wes и соавт., 1969, и др.).
При умеренном сужении просвета аорты и относительно узком артериальном протоке, малом венозном сбросе крови в аорту условия гемодинамики более благоприятны, что обеспечивает относительно продолжительные сроки жизни. В таких редких случаях наблюдается предуктальный (инфантильный) тип коарктации аорты у взрослых.
Атипичная локализация коарктации. Патофизиологические изменения
определяются локализацией и протяженностью сужения. Чем проксималь-нее по артериальному дереву расположено сужение аорты, тем больше перегрузка сердца и раньше развиваются признаки сердечной недостаточности, тем более тяжелая гипертензия, и раньше наступают мозговые осложнения.
Указанные нарушения в наибольшей степени выражены при коарктации дуги аорты.
При сужении грудо-брюшного и брюшного отделов аорты в большей степени выражена и раньше проявляется ишемия нижних конечностей. Уровень сужения выше и ниже отхождения почечных артерий влияет на почечный фактор возникновения гипертензии при коарктации. При инфраренальной локализации сужения артериальное давление обычно не повышено. При супра- и интрареналь-ной локализации сужения, особенно гипопластического типа, почечный кровоток значительно понижен. У некоторых больных
medwedi.ru
50
наблюдается сужение или окклюзия почечных артерий, обусловливающие злокачественное течение гипертензии.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Коарктационный синдром включает субъективные и объективные признаки, обусловленные различием режимов кровообращения выше и ниже места сужения аорты. Большинство больных отмечают головную боль, головокружения, носовые кровотечения, сердцебиение, одышку, онемение, зябкость, похолодание нижних конечностей, быструю утомляемость при ходьбе, перемежающуюся хромоту.
Увзрослых и у детей старшего возраста обычно хорошо развит верхний плечевой пояс при сравнительно менее развитых нижней половине туловища и нижних конечностях («фигура гимнаста», «фигура египетской фрески», И. А. Медведев, 1970). У многих больных определяется видимая и пальпируемая пульсация коллатера-лей на спине и боковых поверхностях грудной клетки, которая лучше обнаруживается в согнутом положении туловища с приведенными к груди руками.
Артерии шеи, головы, верхних конечностей, дуга аорты в яремной ямке интенсивно и напряженно пульсируют, в то время как пульсация артерий нижних конечностей ослаблена или не определяется. Основным диагностическим признаком является перепад давления между верхней и нижней половиной тела, определяемый исследованием пульса и артериального давления на верхних и нижних конечностях. Однако этот признак у детей выражен в меньшей степени, а у взрослых может быть следствием об-литерирующих заболеваний сосудов. Для коарктации характерно повышение максимального и пульсового давления, однако к концу третьего десятилетия жизни увеличивается и диастолическое давление (признак склеротических изменений сосудов).
Убольшей части больных границы сердца увеличены влево, виден усиленный верхушечный толчок. При аускультации определяется интенсивный систолический шум во II межре-берье слева. Характерным для коарктации аорты является выслушивание систолического шума на сосудах шеи и слева в межлопаточном пространстве. У ряда больных прослушивается также диастолический шум.
При электрокардиографическом исследовании чаще всего обнаруживаются признаки перегрузки (гипертрофии) левого желудочка. Со временем могут появиться признаки ишемии миокарда, нарушения внутри-желудочковой проводимости, которые рассматриваются как неблагоприятные прогностические симптомы (Wis-heart, 1970, и др.). Обычное рентгенологическое исследование позволяет у ряда больных выявить прямые и косвенные признаки коарктации аорты. По данным М. А Иваницкой, В. С. Савельева (1960), М. Димитрова и соавторов (1971), характерными являются следующие признаки: а) аортальная конфигурация сердца; б) расширение восходящего отдела аорты; в) увеличение тени верхнего средостения в связи с расширением левой подключичной артерии; г) удлинение в краниальном направлении (высокое стояние) дуги аорты; д) смещение контрастированного пищевода вправо в связи с давлением пристеночного расширения (аневризмы) аорты; е) увеличение амплитуды пульсации дуги аорты и левой подключичной артерии при малой амплитуде пульсации нисходящей аорты; ж) наличие у некоторых больных характерной вырезки («зарубки») на тени выпуклости аорты. У большинства больных (до 70%), чаще старше 12—14 лет, обнаруживаются узурации нижних краев ребер (IV—VIII) в их задней части. Выраженность этого признака зависит от степени развития коллатералей, частота его нарастает с возрастом больных. Некоторые авторы (X. X. Исаков, 1972; В. В. Сат-мари и С. Е. Дыкуха, 1974) большое значение придают томографии в левой боковой проекции как методу установления топического диагноза.
Рентгеноконтрастные методы исследования могут обеспечить получение наиболее достоверных диагностических данных. Однако их применяют относительно редко по двум основным причинам. Во-первых, способов общеклинической диагностики вполне достаточно (в 90% случаев) для установления диагноза коарктации. Во-вторых, одни
51
рентгеноконтрастные методы исследования представляют в большей или меньшей степени риск для больного, другие — недостаточно информативны, что удерживает хирургов от их
использования в случаях типичной клинической картины заболевания.
Можно выделить следующие показания к рентгеноконтрастному исследованию: а) при неясном диагнозе и подозрении на сочетание коарктации с другими пороками сердца и сосудов (открытый артериальный проток, дефекты перегородок, недостаточность аортального клапана); б) при подозрении на атипичную локализацию сужения; в) при подозрении на аневризму; г) при определении показаний к повторным операциям (рецидив ко-арктационного синдрома, аневризмы трансплантата).
Описанные выше данные касаются в основном взрослых больных и детей школьного возраста. В настоящее время практически важной представляется также диагностика коарктации аорты у детей раннего и дошкольного возраста вследствие высокой частоты заболевания, тяжести осложнений и внедрения в клиническую практику операций у детей этого возраста (В. И. Бураковский, Я. В. Волкола-ков, В. И. Францев и др.).
Клиническая картина заболевания у маленьких детей не имеет характерных признаков, наблюдаемых у детей старшего возраста, однако сопоставление симптомов позволяет заподозрить коарктацию аорты. Ведущим проявлением заболевания является выраженная сердечная недостаточность и тяжелое клиническое течение. Клинические симптомы неспецифичны, что усугубляется частыми другими сопутствующими пороками сердца, сосудов, осложнениями.
При аускультации выслушиваются обычно систолический и нередко си-столо- диастолический шумы во 11 межребер ье слева от грудины, в межлопаточной области. Рентгенологические данные неспецифичны и во многом определяются наличием сочетанных пороков и степенью стеноза аорты. При сочетании коарктации аорты с открытым артериальным протоком или с дефектом межжелудочковой перегородки размеры сердца обычно значительно увеличены за счет как правого желудочка, правого предсердия, так и левого желудочка, легочной рисунок усилен вследствие артериального сброса крови (В. И. Бураковский и соавт., 1968). Рентгеноконтрастное исследование целесообразно выполнять у больных, которым показано хирургическое лечение уже в этом возрасте — при неэффективной медикаментозной терапии сердечной недостаточности (Glass и соавт., 1960;Tawesn соавт., 1968, и др.).
Большинство больных с коаркта-цией аорты с выраженной сердечной недостаточностью умирают в раннем детском возрасте, у многих из них имеются сопутствующие пороки. У остальных развивается компенсация ге-модинамических изменений. У детей дошкольного возраста клинические признаки обычно минимальны и проявляются при типичной коарктации с 8—10-летнего возраста, а при соче-танных пороках значительно раньше — в возрасте 3—7 лет. У детей старше 5 лет обычными жалобами являются головокружения, головная боль, быстрая утомляемость, одышка, особенно при физическом напряжении, носовые кровотечения, похолодание нижних конечностей. При внимательном целенаправленном исследовании диагноз может быть поставлен на основании обычных клинико-рент-генологических исследований.
Сочетанные и атипичные формы коарктации аорты характеризуются некоторыми клиническими особенностями, которые позволяют заподозрить характер патологии, однако точный диагноз, как правило, основывается на данных рентгено-хирургиче-ских исследований.
При коарктации постдуктального типа с функционирующим артериальным протоком или в сочетании с дефектами перегородок сердца гипертен-зия в сосудах верхней половины туловища и признаки коллатерального кровообращения не выражены, отмечается высокое пульсовое давление за счет
пониженного диастолического и несколько повышенного систолического, раньше проявляются признаки ишемии нижних конечностей (осцил-лографические,
medwedi.ru
52
реографические, термометрические данные), гипертензия малого круга кровообращения и симптомы сердечной недостаточности.
Предуктальный тип коарктации с функционирующим артериальным протоком (венозноартериальный сброс крови) характеризуется признаками сердечной недостаточности уже в периоде новорожденности, расширением границ сердца вправо. Градиент давления и коллатеральные сосуды обычно не выражены.
При высоком расположении сужения в области дуги аорты, чаще между левой подключичной и левой общей сонной артериями, определяются признаки нарушения кровообращения в левой верхней конечности (пульсация на артериях ослаблена или не определяется, градиент давления между правой и левой верхними конечностями более 30 мм рт. ст., недоразвитие левой руки), ослабление пульсации и отсутствие систолического шума на левой сонной артерии, большая степень выраженности коллатеральных сосудов справа, узура-ция только в области правых верхних ребер.
При коарктации грудо-брюшной и брюшной аорты характерна выраженная ишемия нижних конечностей, в связи с чем нередко диагностируют облитерирующий эндартериит. Топической диагностике помогают выслушивание систолического шума на брюшной аорте при отсутствии его в области сердца, выявление узура-ции VI—X ребер. При вовлечении почечных артерий и резко выраженной артериальной гипертензии нередко ставят ошибочный диагноз злокачественной гипертонии.
В течении заболевания можно выделить несколько периодов. Критический период (В. И. Бураковский и соавт., 1968) наблюдается у новорожденных и у детей раннего возраста, когда в зависимости от характера патологии решается вопрос о жизнеспособности ребенка с данным пороком. Период компенсации или субклинических проявлений — от 1 года до 12—14 лет. Пер иод выраженных клинических проявлений — от 15 до 25 лет. Стадия декомпенсации, вторичных изменений и осложнений — после 25 лет. Этот период характеризуется нарастанием склеротических изменений сосудов, развитием аневризм, кровоизлияний в мозг, эндокардита, вторичными изменениями органов, прогрессированием сердечно-сосудистой недостаточности, разрывами аорты. Указанные изменения вызывают необратимые осложнения, которые часто приводят к летальному исходу.
Больные умирают в среднем в возрасте 32—35 лет (В. С. Смоленский и соавт., 1964; Campbell, 1970). Значительная часть больных умирает в возрасте до 1 года (38,7%, по Blackford, 1928). По данным Campbell (1970), исключая умерших детей в возрасте до 2 лет, 25% больных умирают до 20 лет, 50% — до 32 лет, 75% — до 46 лет и 90% — до 58 лет. Наиболее частые причины смерти — сердечная недостаточность, разрывы аорты и аневризм, эндокардит, кровоизлияние в мозг.
ЛЕЧЕНИЕ
Показания к операции. Единственным методом радикального лечения коарктации аорты является хирургическая коррекция порока.
Возраст больного можно рассматривать как более или менее удобный для оперативного лечения, но его нельзя относить к показаниям или противопоказаниям (И. А. Медведев, 1970). Оптимальный возраст для операции определяется, с одной стороны, развивающимися значительными изменениями сердца, сосудов и других органов, как следствие механизмов компенсации, с другой стороны,— возрастными особенностями аорты у детей (малый диаметр). Мнения авторов по этому вопросу остаются разноречивыми.
Однако наблюдается тенденция к применению операции в более раннем возрасте: раньше оптимальными границами считался возраст 8—15 лет, а в последние годы — от 4 до 12 лет.
Хирургическое лечение показано, независимо от возраста, при высокой гипертензии (больше 150 мм рт. ст.) в связи с опасностью расстройства мозгового кровообращения, а
53
также при появлении признаков сердечной декомпенсации. При сочетании коарктации с открытым артериальным протоком операция показана в более раннем возрасте. У новорожденных и грудных детей операция показана при резко выраженной сердечной недостаточности, не поддающейся медикаментозному лечению (В. И. Бураков-ский и соавт., 1968; Tawes и соавт., 1969), так как операционная смертность при этом значительно ниже, чем в случае лечения одними медикаментозными средствами.
Наличие последствий расстройств мозгового кровообращения не является противопоказанием к операции, хотя значительно увеличивает риск операции. Дискутабельным остается вопрос о показаниях к хирургическому лечению больных старших возрастных групп, особенно после 30 лет. Ostermil-ler и соавторы (1971) сообщили о 53 больных, оперированных в возрасте от 16 до 52 лет без летальных исходов. Однако ряд авторов считают операцию не показанной в этом возрасте в связи с высоким риском операции (Campbell и Suzman, 1955; Groves и Effler, 1960, и др.). Мы считаем, что тяжелый прогноз заболевания оправдывает высокий риск операции у большинства больных. В целом хирургическое лечение считаем целесообразным, за исключением следующих противопоказаний: острый эндокардит, выраженные изменения миокарда и сердечная недостаточность, не поддающаяся консервативному лечению.
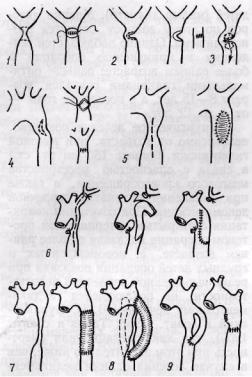
Рис. 24. Методы хирургической коррекции коарктации аорты:
/ — резекция суженного участка с анастомозом конец в конец; 2 — клиновидная резекция; 3 — анастомоз бок в бок без резекции; 4 — прямая истмопластика; 5 — непрямая истмопластика; 6 — истмопластика с использованием левой подключичной артерии; 7 — резекция с циркулярным протезированием аорты; 3 — метод обходного шунтирования сосудистым протезом; 9 — обходное шунтирование с использованием левой подключичной артерии
Методы хирургического лечения коарктации аорты. Предложено более 10
методов устранения порока хирургическим путем, что связано с большим многообразием анатомических форм его. Эти методы можно разделить на следующие основные группы (рис. 24).
I. Местнопластические реконструкции аорты: 1) резекция суженного участка с анастомозом конец в конец (Crawford и Nylin, 1944; Gross и Huf-nagcl, 1945); 2) клиновидная резекция коарктации (De Bakey и соавт., 1960) или анастомоз бок в бок без
medwedi.ru
54
резекции сужения (Bernhard, 1949); 3) прямая пластика (прямая истмопластика; Vosschulte, 1956, 1961); 4) непрямая истмо-
пластика аорты с использованием левой подключичной артерии (Schuma-cker, 1951) или
заплаты из синтетической ткани (Vosschulte и Stiller, 1965). |
|
||||||
II. Резекция |
коарктации |
с замещением |
циркулярным |
трансплантатом: 1) аортальным |
|||
гомотранспланта-том (Gross, |
1949); 2) |
гофрированным синтетическим |
сосудистым |
||||
протезом (De Bakey и соавт., 1960). |
|
|
|
|
|||
III. Методы |
создания |
обходных анастомозов: 1) способ in situ с использованием левой |
|||||
подключичной артерии (Blalock |
и |
Park, |
1944; |
Clagett, 1947), |
селезеночной |
||
артерии (Glenn и соавт., 1952); 2) обходное шунтирование гофрированным сосудистым протезом (De Bakey и соавт., 1955—1960).
Из 49 оперированных нами больных по поводу коарктации аорты непрямая истмопластика применена у 38, прямая — у 8, резекция с анастомозом конец в конец — у 1, резекция с циркулярным протезированием — у 2 больных.
Доступ к стенозированному участку осуществляют через левостороннюю торакотомию по IV или V меж-реберью Многие авторы (П. А. Куприянов и соавт., Е. Н. Мешалкин, И. А. Медведев, Г. М. Соловьев) предпочитают поднадкостничную резекцию IV или V ребра с последующим вскрытием плевры через надкостницу. Особенностью торакотомии и выделения крупных сосудов при коарктации аорты является проведение тщательного гемостаза, что не всегда достаточно просто, учитывая развитие коллатеральных сосудов, извитость и расширение, истончение их стенки. Мы используем электрокоагуляцию при торакотомии, а крупные сосуды грудной стенки перевязываем. При повреждении межкостных артерий может быть применен шов вокруг ребра кпереди и кзади от места повреждения (Voll-mar, 1967).
После отведения верхней доли легкого книзу и кпереди рассекают ме-диастинальную плевру вдоль левой подключичной артерии и нисходящей аорты позади блуждающего нерва на участке 3—5 см книзу от сужения. Уровень поражения аорты определяют по видимому сужению, уровню отхож-дения расширенных межреберных артерий и пальпаторно (разница пульсации, систолическое дрожание выше сужения, наличие «немой зоны»). Выделяют блуждающий нерв и отводят его медиальнее катетеромдержалкой. Выделяют последовательно подключичную артерию, дугу аорты проксимальнее ее и аорту ниже сужения. Вокруг указанных сосудов проводят держалки-катетеры, которыми они могут быть пережаты. После этого выделяют артериальную связку или артериальный проток, если он не облитерирован, и берут на держалку. Этот момент Г. Л. Ратнер (1965) называет «ключом» мобилизации аорты.
При выделении нисходящей аорты следует щадить блуждающий нерв и грудной проток, а при выделении дуги аорты и артериального протока необходимо обращать внимание на сохранение возвратного нерва. При выделении задней стенки аорты выше места сужения и подключичной артерии необходимо помнить об артерии Аббота, редуцированном остатке V аортальной дуги. Артерия тонкая (1,5—2 мм в диаметре), но повреждение ее может вызвать значительное кровотечение. Встречается она редко (у 9 из 98 больных, Г. М. Соловьев, Ю. А. Хримлян, 1968).
Целесообразно перевязывать ограниченное число межреберных артерий, обычно 1—2 пары. Иногда достаточно выделить их и временно пережать. Особенно осторожно следует выделять и перевязывать правые межреберные сосуды, находящиеся позади аорты. Их выделяют обычно в последнюю очередь.
Пересечение артериальной связки лучше производить после ее перевязки и прошивания лигатурами, так как может быть узкий или конусовидный просвет. Открытый артериальный проток после выделения прошивают со стороны легочной артерии аппаратом УАП-20, а аортальный конец после пересечения ушивают атравматиче-ской иглой.
55
Выделение сосудов целесообразно проводить в условиях контролируемой гипотонии. Протяженность выделения сосудов определяется анатомическим вариантом коарктации и предполагаемым планом реконструкции, Однако важным условием является достаточная мобилизация сосудов для контроля возможного кровотечения.
Пережатие аорты на время реконструкции является безопасным в том случае, если значительно не нарушается коллатеральный кровоток,особенно по левой подключичной артерии. При расположении коарктации у самого устья подключичной артерии целесообразно использовать для пережатия аорты зажим Сатинского или окончатый зажим Поттса, со-хоаняя кровоток в подключичной артерии.
Выбор метода реконструкции определяется анатомическими особенностями порока, характером патологических изменений стенки аорты, возрастом больного. Несомненно, имеет значение также и субъективная точка зрения хирурга.
Анализ отечественной и зарубежной литературы показывает тенденцию к более редкому использованию циркулярных аллопротезов аорты по мере увеличения опыта (И. А. Медведев, 1970) и более частому применению местнопластических реконструкций (X. X. Исаков, 1972; В. В. Сатма-ри, С. Е. Дыкуха, 1974).
При использовании любого метода реконструкции необходимо соблюдать следующие условия: а) диаметр анастомоза не должен быть меньше 3/4—2/3 нормального просвета аорты; б) не должно быть натяжения по линии швов; в) швы целесообразно накладывать через относительно малоизмененную стенку аорты.
Операцией выбора признана резекция сужения аорты с анастомозом конец в конец (рис 25). Однако эта операция имеет много ограничений к применению. Так, ее трудно осуществить у взрослых больных, поскольку стенка аорты у них склерозирована, нередко с кальцинозом и швы легко прорезываются даже при небольшом натяжении. Чаще этот метод используют у детей. Некоторые хирурги в последние годы применяют преимущественно этот метод (И. А. Медведев, 1970; Ostermiller и соавт., 1971, и др.).
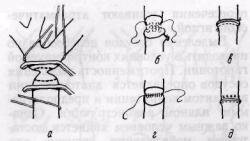
Рис. 25. Схема операции резекции коарктации перешейка аорты с анастомозом конец в конец:
а —• аорта пережата сосудистыми зажимами выше и.ниже коарктации с сохранением кровотока в левой подключичной артерии; 6, в — матрацный выворачивающий шов; г — обвивной непрерывный шов; д — отдельные ГГ-образные швы на переднюю стенку аорты
Чтобы избежать натяжения по линии швов, дефект аорты после резекции сужения не должен превышать 1,5—2 см. Б. А. Королев и А. Б. Королев (1970) считают возможным накладывать анастомоз конец в конец при диастазе до 3—4 см, а у детей до 5 см за счет мобилизации подключичной артерии и дуги аорты. В зависимости от формы коарктации, диаметра аорты используют различные приемы для расширения анастомоза с тем, чтобы диаметр его соответствовал нормальному просвету аорты.
Применяют два вида швов: а) матрацный выворачивающий на заднюю полуокружность аорты (вначале накладывают швы на расстоянии и затягивают после сопоставления) и обвивной или матрацный шов на переднюю стенку; б) обвивной непрерывный шов вначале на заднюю стенку (из просвета аорты), а затем на переднюю. У детей переднюю стенку ушивают отдельными П-образными швами, которые в меньшей степени ограничивают рост аорты в области анастомоза.
medwedi.ru
56
Очень редко наблюдаются благоприятные анатомические условия, обычно при очень ограниченном по протяженности сужении и при внутренней диафрагме, когда удается выполнить клиновидную резекцию участка сужения с оставлением части задне-медиальной стенки аорты. Диафрагму иссекают; анастомоз в сущности мало отличается от анастомоза конец в конец.
Истмоплостика, главным образом непрямая, в последнее время находит все более широкое применение (X. X. Исаков, 1972; В. В. Сатмари, С. Е. Дыкуха, 1974; Wisheart, 1970).
Сущность прямой истмопластики заключается в продольном рассечении суженного сегмента аорты с последующим сшиванием ее в поперечном направлении. Анатомические условия для выполнения этой операции встречаются редко.
Техника непрямой истмопластики заключается в следующем. После пережатия аорты выше и ниже суженного участка продольно рассекают переднюю стенку аорты в области сужения. Иссекают диафрагму со стороны интимы. Нормальный просвет аорты восстанавливают вшиванием в дефект сосуда заплаты из сосудистого протеза.
При резком сужении прибегают к «комбинированной истмопластике» (X. X. Исаков, 1972; В. В. Сатмари, С. Е. Дыкуха, 1974), которая включает элементы прямой и непрямой истмопластики: накладывают 2—3 П-образных шва в поперечном направлении на медиальный и латеральный углы наиболее суженного участка после его рассечения. Таким образом удается расширить заднюю стенку аорты и уменьшить ширину вшиваемой заплаты.
Преимущества методов истмопластики состоят в том, что требуется меньшая мобилизация аорты и обеспечивается возможность роста анастомоза у детей за счет сохраняющегося участка задней стенки (Vosschlulte, 1961). Выполнение истмопластики связано с меньшим операционным риском по сравнению с резекцией и анастомозом конец в конец. Истмопластику применяют при легкой и средней степени сужения; она может быть использована при относительно распространенных сужениях и при склеротических изменениях аорты.
Непрямая истмопластика с использованием для заплаты лоскута на ножке из левой подключичной артерии находит применение в основном у детей младшего возраста (В. И. Бураков-ский и соавт., 1970). Недостатком этого способа является опасность развития ишемии левой верхней конечности и subclavian-steal-синдрома, описанного отдельными авторами (В. В. Сатмари, С. Е. Дыкуха, 1974).
Циркулярное протезирование
Вторым по частоте использования методом реконструкции коарктации является резекция суженного участка с циркулярным протезированием — у 10 —40% больных, по данным И. А. Медведева (1970), De Bakey и соавторов (1960), Wisheard (1970).
Для циркулярной пластики вначале применяли гомотрансплантаты из аорты (Gross, 1949, 1953). Отрицательной стороной их является наклонность к кальцификации, сужению, тромбозу и разрывам в отдаленные сроки (Schuster, Gross, 1962). Поэтому в настоящее время применяют гофрированные протезы из тефлона, дакрона, лавсана и других синтетических материалов.
Основными показаниями к применению циркулярного протезирования при реконструкции коарктации являются: а) распространенные коарктации (гипопластический тип); б) возраст старше 30 лет, когда выражены атеросклеротические изменения стенки аорты; в) пост- и престенотические аневризмы; г) повторные операции по поводу рестеноза, аневризм в области шва. Этот метод пластики остается всегда резервным методом, который может быть использован при безуспешной попытке выполнить другие способы коррекции.
Техника операции типичная и не требует детального описания. Вначале выполняют проксимальный анастомоз, а затем дистальный. Накладывают непрерывный обвивной
57
шов сначала на заднюю, а затем на переднюю полуокружность анастомоза. Над протезом очень редкими швами сшивают медиастинальную плевру.
Недостатки сегментарной циркулярной аллопластики связаны с недостатками аллопластических материалов, а также с фиксированной величиной их просвета, что может быть причиной повторного стеноза у детей. Считается, что ширина протеза у детей, независимо от возраста, должна составлять не менее 15—17 мм (Ю. Е. Березов, 1967, и др.). Ширину анастомоза с протезом иногда целесообразно увеличивать за счет включения в анастомоз подключичной артерии с рассечением части ее стенки.
Методы обходного шунтирования при коарктации перешейка аорты находят ограниченное применение. Обходное шунтирование сосудистым протезом может быть выполнено с меньшим риском для больного при резко выраженных патологических изменениях аорты на участке, примыкающем к коарктации. Наложение анастомозов осуществляют при тангенциальном пережатии аорты в области ее дуги и нисходящего отдела.
В настоящее время практически отказались от применения обходного шунтирования с использованием левой подключичной артерии. Это обусловлено недостаточностью диаметра анастомоза, возможностью перегиба артерии у самого устья с последующей обтурацией просвета, опасностью расстройств кровообращения в левой верхней конечности (Wisheard, 1970).
Наиболее физиологичным и приемлемым способом коррекции порока у детей является резекция с анастомозом конец в конец (С. М. Кавалеров, 1969; В. И. Бураковский и соавт., 1970; Tawes и соавт., 1969; Wisheard, 1970). Хорошая эластичность стенки аорты у детей позволяет сблизить концы аорты без пересечения колла-тералей. Рост анастомоза обеспечивается прерыванием линии шва: отдельными П-образными швами (Schuster и Gross, 1962), тремя обвивными непрерывными швами (Pelletier и со-авт., 1969), отдельными узловыми или П-образными швами на переднюю полуокружность анастомоза (В. И. Бу-раковский и соавт., 1970).
Однако до настоящего времени отсутствуют точные клинические данные о возможности адекватного роста анастомоза у детей. Литературные сведения, основанные на экспериментальных исследованиях, противоречивы (Moss и соавт., 1959; Bull и соавт., 1963). Pelletier и соавторы (1969) изучили отдаленные результаты до 5 лет резекции коарктации с анастомозом конец в конец у детей в возрасте до 1 года методами аортографии и зондирования. Несмотря на отличные клинические результаты, у 50% больных выявлены остаточный стеноз и значительный градиент давления выше и ниже анастомоза. На основании этих исследований авторы ставят под сомнение рост анастомоза.
У детей используют также непрямую истмопластику с заплатой из сосудистого протеза (В. В. Сатмари, С. Е. Дыкуха, 3974), а также из левой подключичной артерии (В. И. Бураковский с соавт., 1970). При реконструкции распространенных коарктации гипопластического типа применяют также обходное шунтирование левой подключичной артерии с нисходящей аортой — операция Blalook — Park (Tawes и соавт., 1969). При распространенном гипопластическом типе сужения используют также циркулярное протезирование аорты. При этом диаметр протеза и анастомозов должен быть не менее 15—17 мм (В. И. Бура-ковский и соавт., 1970). Для наложения достаточно широких анастомозов рассекают переднюю стенку дуги аорты или левой подключичной артерии, а также стенку нисходящей аорты.
При сочетании коарктации с другими пороками сердца и сосудов вопрос о целесообразности одновременной или последовательной хирургической коррекции
решают индивидуально в зависимости от характера гемодина-мических нарушений. Для уточнения тактики необходима точная кардиологическая диагностика. При открытом артериальном протоке показана одномоментная коррекция коарктации и перевязка протока. При сопутствующей недостаточности аортального клапана вследствие
medwedi.ru
58
двустворчатой аномалии развития целесообразно устранить только коарктацию, так как после этого явления недостаточности клапанов могут уменьшиться или исчезнуть. При сопутствующем выраженном стенозе аорты (клапанном или подкла-панном) с высоким градиентом давления выше и ниже стеноза (больше 50 мм рт. ст.) показано двухэтапное хирургическое лечение с первоначальным устранением стеноза аорты или одновременная коррекция пороков, так как устранение только коарктации может привести к коронарной недостаточности (Schuster, Gross, 1962). При сочетании коарктации с дефектами перегородок сердца производят двух-этапную или одновременную коррекцию пороков (Г. М. Соловьев, Ю. А Хримлян, 1968; Burford и соавт., 1960; Pontius, 1962).
Методы реконструкции при коарктациях атипичной локализации. При
коарктации дуги аорты основным методом хирургической коррекции является обходное шунтирование сосудистым протезом из восходящей до нисходящей аорты при тангенциальном пережатии аорты без полного перерыва кровотока в ней. Доступ — срединная стернотомия с дополнительной задне-латеральной торакото-мией слева или поперечная билатеральная торакотомия по IV межре-берью. При ограниченных стенозах может быть использована методика резекции с анастомозом конец в конец или пластическое расширение просвета синтетической заплатой (обычно в условиях искусственного кровообращения).
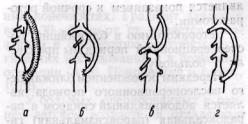
Коарктация нисходящей грудной аорты и брюшного отдела аорты редко бывает ограниченной по протяженности. Поэтому у большинства больных реконструкция возможна путем замещения протезом с резекцией сужения или методом обходного шунтирования с использованием сосудистых протезов (De Bakey и соавт., 1960) и селезеночной артерии (Glenn и соавт., 1952) (рис. 26). В последнем случае селезенку удаляют, а свободный конец артерии анастомозируют в бок аорты проксимальнее или дистальнее чревной артерии в зависимости от уровня расположения коарктации. Предложено также удлинять артериальный шунт свободным аутовенозным трансплантатом из большой подкожной вены бедра.
Осложнения хирургического лечения и летальность. Операционная летальность зависит от возраста больных и наличия сопутствующих пороков сердца и сосудов. В то время как летальность у молодых пациентов с типичной коарктацией перешейка аорты, по данным большинства авторов, составляет 1—6%, у детей раннего возраста и у взрослых больных, особенно старше 30 лет, она резко возрастает. Летальность оперированных детей в возрасте до 1 года равна 20— 45% (Schumacker и соавт., 1968; Та-wes и соавт., 1969), причем более чем у 80% умерших были сочетанные пороки. Летальность детей раннего возраста, но старше 6 мес, значительно уменьшается и достигает средних цифр при этой патологии (Tawes и соавт., 1969).
Летальность пациентов старше 30 лет—11,3%, старше 40 лет—13% (Braimbridge, Yen, 1965). Wisheart (1970) отмечает у всех умерших признаки ишемии левого желудочка до операции по данным ЭКГ и считает этот симптом важным в прогностическом отношении. Среди причин летальных исходов на первом месте стоит сердечная недостаточность, затем — разрывы анастомоза и кровотечения. • _', ' • -' i ' У, Г .
Рис. 26. Методы шунтирования при хирургической коррекции коарктации брюшной
'••
аорты:
