
Хирургия аорты и магистральных артерий. Шалимов А.А
..pdf29
протяженности целесообразно делать два разреза. Второй разрез производят над проксимальной границей окклюзии или же в области пораженной бифуркации артерии. Ретроградная эндартериэктомия является методом выбора, однако по специальным показаниям применяют и ортоградную полузакрытую эндартериэктомию: из крупных боковых ветвей (например, внутренней подвздошной, глубокой бедренной, передней берцовой артерий); для удаления гиалинизированного белого тромба при облитерирующем эндарте-риите (методика Н. И. Краковского).
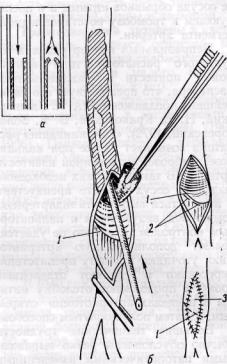
Чрезвычайно важным моментом является надежная фиксация дистального края срезанной интимы к стенке сосуда. При наличии флотирующего края интимы и значительном ее утолщении с образованием уступа под воздействием тока крови может произойти отслойка внутренней оболочки, подворачивание (инвагинация) ее края и перекрытие просвета сосуда (рис. 18, а). Это одна из наиболее частых причин послеоперационного ретромбоза оперированного сосуда.
Для профилактики этого осложнения считаем целесообразным следующие приемы: пересечение интимы в пределах малоизмененного участка сосуда; срезание ее под острым углом на уровне артериотомии; фиксация края интимы к сосудистой стенке П-образ-ными швами, а также частичное захватывание его в шов при наложении заплаты или анастомоза; перекрытие края интимы заплатой, с тем чтобы обеспечить некоторое расширение просвета в этом участке сосуда (рис. 18, б).
Важным моментом операции является контроль проходимости артерии после ее дезоблитерации. Оставление обрывков интимы на внутренней поверхности оперированного сосуда может быть причиной послеоперационных тромбозов. Контроль восстановленного сегмента сосуда осуществляем путем ощупывания доступных его участков, проведения бужей соответствующего диаметра, промывания сосуда физиологическим раствором под давлением в обоих направлениях, тщательного осмотра удаленного тромбинтимального субстрата с целью выявления в нем дефектов.
Перед ушиванием артерии освобождаем сосуд от зажимов, промываем рану кровью с целью удаления тромбов, в проксимальное и дисталь-ное сосудистое русло вводим раствор гепарина.
Шов артерии осуществляем описанными выше способами обычно с аутовенозной пластикой заплатой. Вначале снимаем зажим с дистального отдела сосудистой магистрали, проверяем герметичность шва, а затем снимаем центральный зажим.
Перед зашиванием раны мягких тканей обязательна проверка проходимости сосуда по пульсации дисталь-ных участков артерии или методом флоуметрии. При сомнениях в отношении проходимости сосуда, подозрении на наличие обрывков или флотирующего края интимы показана контрольная операционная артериография.
Эндартериэктомия является весьма сложной операцией. Успех ее в значительной степени определяется правильным и тщательным выполнением всех этапов операции, особенно эндар-териальных манипуляций. Могут быть следующие основные ошибки и осложнения операции.
Прорыв (разрыв) стенки артерии при грубом, неправильном манипулировании сосудистыми шпателями типа кольца или полукольца при отделении тромбинтимального субстрата; в результате захватывания стенки сосуда зажимами при извлечении отслоенного тромба; при отделении кальцинированной бляшки, поражающей
medwedi.ru
30
Рис. 18. Метод предупреждения подворачивания (а) края пересеченной при тромбэндартериэктомии интимы (б):
пересечение интимы (Л под острым углом на уровне артериотомии в пределах малоизмененного участка артерии, фиксация ее края П-образными швами (2) и перекрытие края интимы венозной заплатой (3)
всю стенку сосуда; при бужировании сосуда. Угроза разрыва стенки сосуда возникает при неравномерном поражении сосудистой стенки, выраженном кальцинозе, атероматозной язве. Разрыв стенки, особенно не диагностированный во время операции, может осложниться параартериаль-ным кровотечением и последующим тромбозом восстановленной артерии. Правильное определение показаний к операции эндартериэктомии, тщательное, щадящее оперирование с использованием усовершенствованного инструментария позволяет предупредить возникновение этого осложнения. Неправильный выбор слоя отделения тромбинтимального субстрата может привести к «разноэтажной» эндартериэктомии, оставлению в просвете сосуда обрывков интимы и в последующем к тромбозу восстановленного сегмента артерии.
Неправильный подбор размера сосудистого распатора типа кольца может привести к «заклиниванию» распатора, что препятствует его дальнейшему продвижению (А. А. Вишневский, Н. И. Краковский, В. Я. Золо-торевский, 1972). «Заклинивание» распатора возникает также при кальци-нозе, фиброзе, выраженной извитости артерии. В таких случаях необходимо выделить сосуд в месте препятствия и попытаться выполнить эндартериэк-томию под визуальным и пальпатор-ным контролем. Если это не удается, делают дополнительную артериото-мию, уточняют причину препятствия, пересекают и удаляют отделенный тромб и продолжают отслойку интимы в пределах артериотомии открытым, а затем полузакрытым епособом.
Большие технические трудности обычно обусловлены резко выраженными патологическими изменениями сосудистой стенки вследствие кальци-ноза или фиброза артерии. В последнем случае сосуд имеет вид плотного, относительно тонкого жгута. Иногда можно попытаться расширить просвет сосуда путем бужирования (А. А. Вишневский и соавт., 1972). Мы отмечали склонность к ретромбозам после этого вмешательства, поэтому считаем более целесообразной в таких случаях трансплантацию сосудов.
31
Тромбоз оперированного сегмента на операционном столе развивается вследствие технических ошибок (оставление в просвете обрывков интимы или флотирующего дистального ее края, сужение просвета сосуда в месте шва) или при резком усилении коагуляционных свойств крови. Необходимо проверить время свертывания крови, ввести раствор гепарина в проксимальное и дистальное сосудистое русло, произвести ревизию оперированного сосуда и удалить тромб. Вопрос о месте артериотомии — по линии сосудистого шва или на новом участке — решают индивидуально, однако первое и второе правомочно при соответствующих показаниях.
Несостоятельность участка стенки оперированной артерии проявляется кровотечением или имбибицией сосудистой стенки кровью. В этом участке возникают благоприятные условия для ретромбоза, параартериальной гематомы и аневризмы. Вопросы тактики при этом осложнении решают индивидуально: наложение П-образных швов, рассечение артерии и пластика аутовенозной заплатой, резекция сегмента артерии с последующей аллопластикой его веной.
Основываясь на собственном опыте, мы пришли к выводу, что при значительных технических трудностях, ошибках, осложнениях эндартериэк-томии целесообразно руководствоваться правилом: лучше изменить план операции и применить трансплантацию сосудов, чем выполнить эндарте-риэктомию некачественно.
Регенерация сосудистой стенки после эндар-териэктомии изучена в эксперименте и в клинике (М. Г. Маслова, 1963; В. Я. Золоторевский, 1972; Г. Д. Князева и М. М. Морозова, 1973). Исследования показали, что уже через несколько часов дефект интимы покрывается тонким слоем фибрина. Фибрин является питательной средой для тканевых элементов формирующейся соединительной ткани и стимулирует пролиферацию мезенхималь-ных клеток сосудистой стенки (И. В. Давыдовский, 1961). В дальнейшем происходит замещение фибрина соединительной тканью в основном за счет пролиферации соединительнотканных клеток интимы и среднего слоя. Через 2—6 мес на внутренней поверхности сосуда обнаруживается неоинтима, богатая клеточными элементами, выстланная изнутри слоем клеток, напоминающих сосудистый эндотелий. Через 1 год после операции количество клеток уменьшается, обнаруживаются эластические элементы (Г. Д. Князева, М. М. Морозова, 1973). Однако другие авторы не наблюдали регенерации эластических волокон в неоинтиме., а только коллагеновые волокна (В. Я. Золоторевский, 1972).
В более поздние сроки после операции у единичных больных отмечается кальциноз, склероз неоинтимы, кровоизлияния под нее, аневризмати-ческие расширения.
Результаты исследований в целом показывают, что восстановительные морфологические процессы в сосудистой стенке после эндартериэктомии развиваются вполне удовлетворительно. Это обосновывает применение операции в клинике. Есть основания считать, что при сохранении внутренней эластической мембраны, а также в случае, когда сосуд полностью не отделяется от окружающих тканей (сохранение иннервации и сосудистых связей), репаративные процессы проходят более благоприятно.
medwedi.ru
32
ТРАНСПЛАНТАЦИЯ СОСУДОВ
С конца XIX в. и до наших дней были предложены разнообразные материалы для замены сосудов — биологические (сосуды и другие ткани) и аллопластические (искусственные сосудистые протезы). Из многих способов реконструкции артерий методом трансплантации, исследованных в эксперименте и апробированных в клинике, в настоящее время применяют главным образом два: пластика артерий веной и аллопластика синтетическими сосудистыми протезами. Другие оставлены как непригодные или их используют очень ограниченно, например, пересадку ауто-, гомо- и гетероартерий, гомовены.
Практическая ценность трансплантатов, используемых для пластики артерий, определяется биологической совместимостью, механическими свойствами (прочность, эластичность, упругость), влиянием на троМбогенез, характером и частотой осложнений в ближайшие и отдаленные сроки после операции. Важна также доступность, то есть возможность иметь трансплантат достаточной длины и диаметра.
Трансплантация аутовены в настоящее время является основным методом реконструкции снабжающих артерий среднего и малого калибра (диаметром меньше 8 мм).
Аутовенозная пластика впервые была разработана в эксперименте и применена в клинике Carrel (1902, 1906). Первые успешные пересадки аутовены были применены для замещения дефектов артерий, возникших после резекции аневризм: Govenes (1906) использовал подколенную вену для замещения дефекта подколенной артерии методом in situ. Lexer (1907) осуществил свободную пластику сегментом большой подкожной вены бедра дефекта подмышечной артерии.
В 1949 г. Kunlin использовал большую подкожную вену бедра для обходного шунтирования окклюзиро-ванной бедренной артерии. С конца 50-х годов аутовенопластика находит все более широкое применение в хирургии тромбоблитерирующих заболеваний артерий (Dale, Mavor, 1959; Linton, Darling, 1962, 1967; OeWeese исоавт., 1966). Мы (А. А. Шалимов, 1961) впервые предложили методику замены и шунтирования периферических артерий одноименной сопровождающей веной без выделения ее из ложа (методом in situ) при реконструкции артерий по поводу облитерирующих заболеваний. Большинство авторов в настоящее время считают аутовенозную пластику наиболее предпочтительным методом реконструкции артерий среднего и малого калибра.
Это обусловлено биологической совместимостью, относительной доступностью и простотой изъятия вены, эластичностью, устойчивостью ее к инфекции и относительно низкими тромбогенными свойствами. Наличие неизмененной интимы обеспечивает продолжительное функционирование аутовенозного трансплантата.
Питание относительно тонкой стенки вены в начальный период после свободной пересадки происходит за счет крови, проходящей в ее просвете. Через 2—3 нед после трансплантации восстанавливаются сосудистые связи наружной оболочки вены с окружающими тканями. Дегенерация и склероз ее стенки обычно не выражены в значительной степени и сохраняются эластические элементы ткани, обусловливающие механическую прочность и стабильность стенки восстановленного сосуда.
33
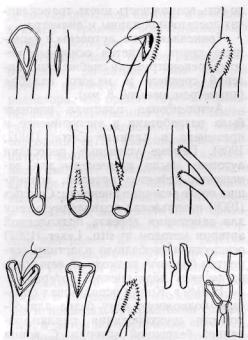
Рис. 19. Методы формирования анастомоза венозного шунта и артерии при малом калибре проксимального конца венозного шунта Компенсаторно-приспособительные изменения в ответ на высокое артериальное давление
в функционирующем аутовенозном трансплантате проявляются утолщением ее стенки, гиперплазией интимы и мышечного слоя. Происходит так называемая ар-териализация вены (Б. И. Даценко, 1964; May и соавт., 1965).
Наряду с указанными достоинствами аутовенозная пластика имеет ряд недостатков. Отмечено образование аневризм стенки пересаженной вены через несколько месяцев или лет после операции. Они развиваются чаще в результате
недостаточности стенки по линии шва. Гладкое приживление трансплантата без выраженной воспалительной реакции, инфекции и гематомы является лучшей мерой предупреждения неполноценности его стенки.
Недостатком метода является также отсутствие у части больных венозных аутотрансплантатов необходимой длины и диаметра.
В случае несоответствия длины или диаметра аутовенозного трансплантата параметрам дефекта артерии может быть использована следующая тактика (рис. 19): увеличение диаметра проксимальной части венозного шунта путем сшивания двух вен (Mercier и соавт., 1972) или основного ствола и его боковой ветви после их продольного рассечения; методика анастомоза бок в бок с подворачиванием края венозного шунта и расширением его начального отдела; увеличение диаметра анастомоза с помощью свободного треугольного лоскута из вены или продольного лоскута, выкроенного из артерии; удлинение трансплантата путем анастомозирования двух вен конец в конец (с помощью сосудосшивающего аппарата), вены и сегмента артерии (после дезоблитера-ции последней) или использования основного венозного ствола и его крупной боковой ветви, вены и аллопро-теза.
Техника операции аутовенопластики артерий заключается в следующем. Выделяют большую подкожную вену бедра и убеждаются в соответствии ее диаметра, отсутствии облитерации ее просвета. Если предполагается наложение анастомоза с бедренной артерией, то вену и артерию выделяют из одного продольного доступа. Начинать операцию в этом случае целесообразно с выделения вены, так как смещение тканей после обнажения артерии нередко затрудняет обнаружение вены. Излишнее рассечение клетчатки и отслойка внутреннего кожного лоскута при выделении вены могут осложниться некрозом лоскута, что имело место в наших наблюдениях.
medwedi.ru
34
При пластике методом обходного шунтирования выделяют только проксимальную и дистальную части ок-клюзированного сегмента артерии. Для успеха трансплантации важно накладывать анастомозы с относительно здоровыми участками артерии проксимальнее и дистальнее окклюзии.
Определяют необходимую длину венозного трансплантата и продолжают выделение вены. Изъятие большой подкожной вены на большом протяжении осуществляют через отдельные разрезы по проекционной линии сосуда. Избегают рассечения кожи в области коленного сустава. Некоторые авторы применяют один длинный разрез через все бедро или два больших разреза (Vollmar, 1967).
При выделении вена значительно спазмируется, нередко до половины своего диаметра. Выделение должно быть максимально щадящим, необходимо избегать захвата инструментами стенки вены. Боковые ветви пересекают и перевязывают. Лигатуры необходимо накладывать на некотором расстоянии (1—3 мм) от стенки венозного ствола, чтобы не было сужения, однако не должно быть также «слепых» культей боковых ветвей при оставлении длинной культи перевязанной ветви. Узлы тщательно завязывают тонкой капроновой (1 или 1—0) нитью, учитывая высокое кровяное давление в артериализованном трансплантате.
Просвет вены промывают раствором гепарина. При этом раствор нагнетают шприцем через катетер под давлением с целью проверки ее герметичности и преодоления веноспазма. Удаляют из наружной оболочки обрывки клетчатки, соединительнотканные перетяжки.
Следующий этап — наложение анастомозов. В настоящее время в хирургии облитерирующих заболеваний артерий применяют методику обходного шунтирования с анастомозами как по типу конец трансплантата в бок артерии, так и конец в конец. Анастомозы конец в конец используют чаще при пластике
травматических дефектов артерий, после удаления аневризм или при ограниченных по протяженности резекциях артерии.
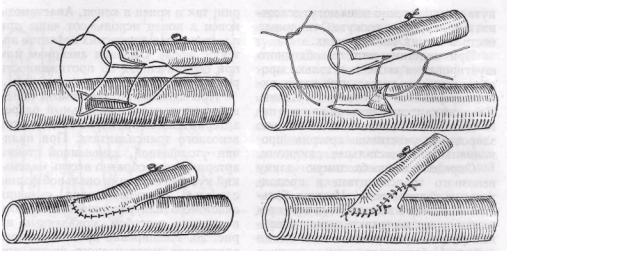
При наложении анастомоза конец в бок производят продольный разрез артерии длиной примерно 1,5 диаметра венозного трансплантата. При наличии утолщенной, измененной стенки артерии целесообразно иссечь маленький кусочек ее стенки овальной формы с целью предупреждения сужения анастомоза или расширить отверстия в артерии способом, показанным на рис. 20. Расширение проксимального анастомоза аутовенозного шунта при малом диаметре проксимального конца шунта достигаем также с помощью разработанного нами метода с использованием треугольного лоскута стенки артерии (рис. 21).
Применяют обычно непрерывный обвивной шов. Как правило, вкол иглы производят со стороны артерии, что позволяет избежать втягивания адвентиции вены и вворачивания края вены внутрь артерии.
Подготавливают ложе в тканях для трансплантата и последний проводят в туннель с помощью длинного зажима или разработанного нами специально го устройства. Чрезвычайно важно избежать перекручивания по оси, перегиба, сдавления венозного трансплантата в туннеле.
Известны два способа аутовенозного шунтирования артерий конечностей — с реверсией вены и без полного выделения ее из ложа, известного под названием in situ. В первом случае периферический конец вены подшивают к центральному сегменту артерии, а центральный конец вены — к периферическому сегменту артерии. При этом трансплантат полностью извлекается, пересекаются все его боковые ветви, сосудистые и нервные связи и переворачивается (реверсия) на 180° с целью устранения препятствия кровотоку
|
|
|
|
|
35 |
клапанов |
вены. |
Шунтирование |
с |
реверсией |
венозного |
Рис. 20. Метод расширения конце-бокового анастомоза вены и артерии при наличии утолщенной и ригидной вследствие патологического процесса стенки артерии трансплантата в настоящее время является основным методом реконструкции
периферических артерий конечностей при облитерирующих заболеваниях в нашей стране
иза рубежом. Однако ряд неудач при реверсионном способе шунтирования зависит именно от реверсии трансплантата (May с соавт., 1965, и др.). Они обусловлены возможностью перегиба и скручивания шунта по оси, значительной механической травмой при выделении и извлечении вены, полным нарушением сосудистых и нервных связей, относительно малым диаметром проксимального анастомоза, что нередко приводит к тромбозу шунта.
Указанных недостатков реверсион-ного способа можно избежать при шунтировании веной с оставлением ее в естественном ложе. Метод впервые был применен нами (А. А. Шалимов, 1961) и Hall (1962). Мы применяли вначале для шунтирования одноименную сопутствующую вену, Hall (1962), Rob (1963) — большую подкожную вену бедра. Разрушение венозных клапанов достигалось вначале их иссечением через множественные вено-томии на уровне расположения клапанов.
Рис. 21. Метод расширения анастомоза и устья венозного шунта при малом диаметре проксимальной части шунта
Метод in situ имеет важные преимущества по сравнению с реверсионным способом, особенно при длинном шунтировании от бедренной к подколенной артерии ниже коленного сустава и к берцовым артериям. Относительно большой диаметр проксимального анастомоза обеспечивает лучшие гемоди-намические характеристики шунта, сохранение нервных и сосудистых связей, предохраняет шунт от дистрофических
ипоследующих фиброзных изменений, сокращается продолжительность операции. Однако метод in situ в настоящее время не применяют отечественные хирурги и относительно редко его используют за рубежом в связи с отсутствием надежных способов закрытого, без множественных разрезов венозной стенки, разрушения всех лепестков клапанов. С целью вызывания недостаточности клапанов используют обычно зонды, предназначенные для венэктомии, бужи, катетеры, которые не обеспечивают надежного разрушения всех лепестков клапанов. В последние годы Skagseth и Hall (1973) предложили специальное устройство — разрушитель клапанов.
Нами разработано несколько вариантов специальных устройств для разрушения клапанов венозного шунта закрытым способом, а также способ разрушения
клапанов (см. рис. 118, 119). Применение этих инструментов обеспечивает безопасное и быстрое разрушение клапанов венозного шунта. Это позволяет более широко применять обходное шунтирование веной in situ при реконструкции распространенных окклюзии артерий бедрен-но-подколенно-берцовой области, уменьшить продолжительность операции и улучшить результаты лечения.
medwedi.ru
36
После наложения анастомозов вначале снимают дистальный зажим, проверяют герметичность дистального анастомоза, а затем снимают проксимальный зажим. Проходимость шунта и анастомозов проверяют по пульсации и методом флоуметрии.
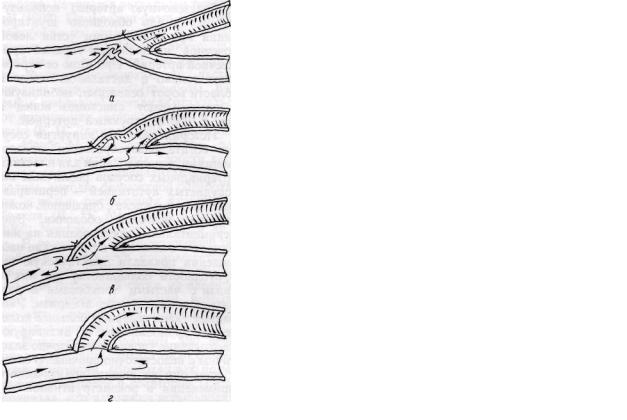
В технике операции обходного шунтирования веной могут быть допущены ошибки, вследствие чего нарушается ламинарный характер кровотока, возникает турбулентность в области анастомозов с последующим тромбозом шунта. Ошибки обусловлены чаще всего несоответствием длины трансплантата, а также неправильной техникой сосудистого шва (рис. 22).
Тромбоз венозного шунта на операционном столе может быть вызван перекрутом по оси, перегибом, сдавле-нием трансплантата, неполным разрушением клапанов при использовании метода in situ, а также усилением коагуляционных свойств крови. Необходимо выяснить и устранить причину тромбоза. Тромбэктомию из венозного трансплантата мы обычно производим с помощью катетера Fogarty через одну из крупных боковых ветвей венозного трансплантата, предварительно снимая лигатуру, без рассечения шунта.
Сужение проксимального анастомоза при обходном шунтировании с реверсией венозного трансплантата обычно возникает при малом диаметре дистального конца вены. Стеноз приводит к уменьшению объемной скорости кровотока в шунте и линейной скорости в области дистального анастомо-
Рис. 22. Ошибки наложения анастомоза вены и артерии конец в бок при обходном шунтировании:
а — короткий шунт, |
обусловивший деформацию артерии в области анастомоза; 6 — |
|
длинный |
обходной |
шунт; в, г — неправильно наложенный сосудистый шов (по И. |
Генову, |
1974) |
|
за, что благоприятствует тромбозу шунта. В случае малого диаметра вены мы применяем различные методы расширения анастомоза.
Аутотрансплантация артерий с точки зрения биологической совместимости и свойств сосудистой стенки является оптимальным методом, но его используют очень редко в связи с отсутствием трансплантатов необходимой длины и диаметра
37
просвета. В качестве трансплантата могут быть использованы внутренняя подвздошная, глубокая бедренная артерии. Их применяют некоторые авторы для пластики почечных артерий у больных с ва-зоренальной гипертонией (М. Д. Князев, Г. С. Коротовский, 1971). Селезеночную артерию используют иногда для обходного шунтирования при облитерации устья левой почечной, чревной или верхней брыжеечной артерий. При этом ее пересекают только в дистальном отделе в области ворот селезенки, мобилизуют и накладывают анастомоз конец в бок с соответствующей артерией.
История развития хирургии сосудов богата разнообразными предложениями использования для пластики артериальных сосудов различных несосудистых аутотканей
— перикарда, фасции, в том числе с брюшиной, кожи, твердой мозговой оболочки. Экспериментальные исследования на животных и отдельные клинические наблюдения показали практическую непригодность большинства из них в связи с частыми тромбозами
иразвитием в последующем аневризм. Указанные ткани содержат большое количество тромбокиназы и активируют свертывание крови, недостаточно эластичны и недостаточно прочны. В связи с этим они не нашли практического применения в реконструктивной хирургии артериальных сосудов.
Аллопластика артериальных сосудов. Отсутствие аутогенных сосудов необходимого диаметра, особенно для пластики аорты и крупных артерий — «транспортирующих» сосудов, побуждает к применению гомо-, гетерососу-дов и синтетических сосудистых протезов.
60-е годы были периодом увлечения гомотрансплантацией артерий, которая рассматривалась как метод выбора при пластике аорты и артерий крупного и среднего калибра. Разработка и применение этого метода сыграли большую роль в развитии хирургии сосудов.
Впервые гомопластику артерий у человека, правда безуспешно, осуществил Pirovano в 1910 г. Первую успешную гомотрансплантацию артерий в клинике выполнили Gross и соавторы (1949).
Использовались различные методы консервации артерий в жидких средах (жидкость Тироде, 4% раствор формалина, 70% этиловый спирт, плазма), а также
замораживание. Наиболее широкое применение в клинике (Н. И. Краковский и соавт., 1958; binder, 1955; Hufnagel, 1955, и др.) нашли артериальные гомо-трансплантаты, консервированные методом замораживания и высушивания (лиофилизации), предложенным в 1951 г. Marrangoni и Cecchini.
Однако независимо от вида консервации истинного вживления сосудистых гомотрансплантатов не наблюдается — происходит постепенная резорбция и замещение стенки трансплантата врастающей с окружающих тканей собственной соединительной тканью. Так как стенка трансплантата относительно толстая и плотная, этот процесс осуществляется медленно, может продолжаться в течение 1 года. Еще до врастания соединительной ткани развиваются дегенеративные изменения и даже некробиоз средней
ивнутренней оболочек. Указанное обстоятельство, особенно разрушение эластических мембран, приводит к нарушению механической прочности стенки и благоприятствует возникновению аневризм. Не отмечено истинной регенерации мышечных волокон. Внутренняя оболочка покрывается фибрином и эндотелием — неоинти-мой.
Таким образом, сосудистые гомо-трансплантаты, как и синтетические сосудистые протезы, являются в сущности каркасом для формирования новой сосудистой стенки из соединительной ткани. Гомотрансплантаты могут также вызывать иммунобиологическую реакцию (П. П. Коваленко, В. Н. Юсков, 1968; Lie и соавт., 1971, и др.).
Гомотрансплантаты крупных сосудов, особенно аорты, могут функционировать продолжительное время. Однако в настоящее время метод практически не применяют в связи с часто развивающимися поздними осложнениями (тромбозы, аневризмы, разрывы, рубцовые сужения, склероз с кальцинозом, вспышки инфекции), а также с широким клиническим использованием более эффективных аллопластических (для замещения
medwedi.ru
38
крупных сосудов) и аутовенозных (для замещения периферических артерий) трансплантатов.
Гомовенопластику артерий отдельные авторы применяют (Hariola и соавт., 1969; Marcuson и соавт., 1969; Tice, Santoni, 1970; Ochsnez и соавт., 1971; Jackson, Abel, 1972) для бедрен- но-подколенного шунтирования при отсутствии аутовенозного трансплантата необходимых параметров (гипоплазия, облитерация, резко выраженное варикозное расширение большой подкожной вены, ее отсутствие вследствие венэктомии или использование при ранее выполненных реконструктивных операциях). После гомовенопластики наблюдаются такие же поздние осложнения, как и после пластики артериальными гомотрансплан-татами. Мы также применяем в указанных выше случаях гомовену, консервированную при низких температурах.
Впоследние годы сделаны попытки использования для обходного шунтирования бедренной артерии пуповин-ной вены (наша клиника, Ibrahim с соавт., 1977, и др.). Однако еще рано делать выводы о перспективности применения этого вида сосудистых трансплантатов.
Экспериментальными исследованиями установлено, что гомотранс-плантаты, как антигены, вызывают состояние иммунитета подобно пересаженной коже и другим органам. Состояние иммунитета не обязательно ведет к тромбозу, хотя тяжесть морфологических изменений трансплантата влияет на частоту его тромбозов (Perloff и соавт., 1972).
Решение проблемы гомопластики сосудов в целом зависит от решения биологической проблемы преодоления реакции антигенной несовместимости тканей.
Попытки пересадки гетеросо-судов предпринимались неодно-
кратно, начиная с экспериментов Carrel (1907). Применяли разные способы обработки трансплантатов для подавления их специфических антигенных свойств. Хотя ближайшие результаты были обнадеживающими, частые поздние осложнения (тромбозы, разрывы, инфекция) заставили отказаться от применения гетеропластики в клинике (Е. Н. Данилов, 1961; Rob, 1962).
Наиболее перспективными для устранения антигенных свойств гете-рососудистых трансплантатов оказались методы ферментной обработки их с целью растворения аутогенных белков (Е. Н. Мешалкин и соавт., 1962; Newton и соавт., 1958, и др.).
Врезультате соответствующей обработки гетерососуд превращается в биологическую коллагеновую трубку в форме фиброзной сетки из адвенти-ции и внутренней оболочки, которая служит каркасом для формирования сосуда в организме реципиента.
Имплантация больным 120 артериальных трансплантататов из бычьей сонной артерии, обработанных по методике Rosenberg и соавторов (1964), показала, что их можно использовать для замещения артерий человека (Keshishian и соавт., 1971). Эти трансплантаты иммунологически совместимы с тканями человека, имеют отрицательный электрический потенциал, что уменьшает опасность тромбоза, могут сохраняться продолжительное время в консервирующей среде.
Авторы использовали трансплантат как заплату на артерию, для замещения и обходного шунтирования, в том числе для подмышечно-бедренного шунтирования. Продолжительность функционирования трансплантатов не установлена. По мнению авторов, она соответствует длительности функционирования дакроновых протезов или аутовенозных трансплантатов.
Недостаточное количество наблюдений не позволяет сделать окончательные выводы о возможности более широкого практического использования гетеро- и гомотрансплантатов для реконструкции сосудов у человека. Необходимы дальнейшие исследования.
Пластика сосудов с использованием синтетических трансплантатов нашла практическое применение в клинике -в 50-е годы, когда были предложены пористые синтетические пластмассовые сосудистые протезы из виньона (Voorhees, Jaretski, Blakemore, 1952). Однако этот вопрос имеет давнюю историю. Abbe в 1894 г. заменил артерию у собаки
