
Хирургия аорты и магистральных артерий. Шалимов А.А
..pdf59
а — сосудистым протезом; 6, в — селезеночной артерией (in situ); г — селезеночной артерией и аутовенозным трансплантатом из большой подкожной вены бедра Частота операционных и послеоперационных осложнений значительно колеблется и достигает 20—50% (В. В. Сатмари, С. Е. Дыкуха, 1974; Ownes и Swan, 1963).
Наиболее частым осложнением хирургического лечения коарктации аорты является кровотечение из анастомозов и пересеченных коллатеральных сосудов — у 4—20% пациентов. Мы наблюдали кровотечение у 4 из 49 больных. Чаще всего источником кровотечения во время операции были межреберные сосуды. Особенно опасны кровотечения из правых межреберных артерий, доступ к которым затруднен. Выделять их следует в последнюю очередь и с большой осторожностью. При значительном, особенно остро развивающемся кровотечении, в послеоперационный период (продолжающееся обильное выделение крови через дренаж, расширение тени средостения по рентгенологическим данным, изменение гемодинамических показателей, коллапс) необходима срочная реторакотомия.
Тромбоз в области анастомоза наблюдается относительно редко и является следствием технических ошибок (нерадикальное устранение коарктации, сужение просвета швами). Тромбоз анастомоза в ранний послеоперационный период является грозным осложнением в связи с недостаточностью коллатерального кровообращения, остро развивающейся перегрузкой левого желудочка и является показанием к срочной рето-ракотомии.
Реторакотомию в ближайший послеоперационный период мы произвели 1 больному. Нередким осложнением ближайшего послеоперационного периода является абдоминальный синдром и парадоксальная (пароксизмальная) ги-пертензия — у 10—15% больных (Vuden, 1972). Мы наблюдали паро-ксизмальную гипертензию у 6 больных, абдоминальный синдром — у 3. Абдоминальный синдром проявляется болью в животе различной интенсивности и локализации и может привести к смерти при явлениях коллапса и острого живота. На секции обнаруживают артериолонекроз сосудов органов брюшной полости с некрозом кишечника, инфарктами почек.
Пароксизмальная гипертензия наблюдается в ранний послеоперационный период. Артериальное давление обычно выше дооперационного уровня и трудно поддается лечению гипотензивными средствами.
Этиология и патогенез этих осложнений окончательно не выяснены. Механизм их развития связан со сложной перестройкой режима кровообращения после устранения коарктации. Большую роль в патогенезе, несомненно, играет симпатическая нервная система. Существует точка зрения, согласно которой в основе парадоксальной гипертензии лежит увеличение выброса катехоламинов рефлек-торно через барорецепторы каротид-ного синуса в ответ на понижение артериального давления в верхнем сосудистом бассейне (Goodall и Sealy, 1965; O'Gorman и соавт., 1969). Стенка сосудов нижней половины тела атрофирована, приспособлена к низкому давлению. Поэтому при повышении артериального давления в нижней половине тела может возникнуть повреждение сосудистой стенки (артериит).
Для предупреждения этих осложнений имеет значение минимальная продолжительность пережатия аорты, а также постепенное расслабление зажимов при включении кровотока. В плановом
порядке назначают спазмолитики с первых суток послеоперационного периода, а при повышении давления более 140—150 мм рт. ст. вводят ганглиоблокаторы. В первые сутки после операции артериальное •давление контролируют ежечасно.
Исследование гемодинамических сдвигов, наступающих в связи с операцией по поводу коарктации аорты, показали, что объем циркулирующей крови (ОЦК) в первые дни после операции значительно понижен по сравнению с дооперационным уровнем (В. И. Францев и соавт., 1971; В. В.Сатмари, С. Е. Дыкуха, 1974, и др.). Восполнение ОЦК после устранения коарктации аорты является важным фактором предупреждения парок-сизмальной гипертензии. Его осуществляют в основном кровезамещающими растворами. Основным
medwedi.ru
60
критерием адекватного восполнения ОЦК является центральное венозное давление (ЦВД), которое после операции падает до 0 и удерживается в первые сутки на низких цифрах (В. В. Сатма-ри, С. Е. Дыкуха, 1974).
Результаты хирургического лечения. Методы хирургической коррекции коарктации аорты хорошо разработаны. По данным литературы и собственных наблюдений, отличные и хорошие результаты в отдаленные сроки (до 10 лет и более) отмечаются у 80—95% больных, оперированных в оптимальные для хирургического лечения сроки.
Артериальное давление после операции может снижаться медленно и продолжительное время; по данным Wisheart (1970),— по крайней мере в течение 5—10 лет. Однако, несмотря на радикальное устранение препятствия на пути кровотока в аорте (определяется отчетливая пульсация на артериях стоп), проксимальная гипертензия сохраняется у значительной части больных — 2—43%.
Лучшие отдаленные результаты наблюдаются у больных, оперированных в возрасте до 10 лет. Раннее оперативное вмешательство предупреждает развитие значительных изменений со стороны сердечно-сосудистой системы. Радикальность хирургической коррекции порока является важнейшим условием отличных и хороших результатов в отдаленные сроки наблюдения. Изучение результатов лечения больных демонстрирует преимущество прямых анастомозов и истмопластики по сравнению с циркулярным протезированием (С. М. Кавалеров, 1969, и др.).
К. поздним осложнениям относятся аневризмы в области оперативного вмешательства и повторные сужения (рекоарктация).
Источником образования аневризм являются значительно измененная и травмированная зажимами стенка аорты, прорезывание швов анастомоза. Мы оперировали больную с аневризмой в области анастомоза протеза и аорты, развившейся через 6 лет после первичной операции. Повторная операция выполнена после образования соединительнотканной капсулы ложной аневризмы. Наличие капсулы позволило вскрыть плевральную полость, мобилизовать большую часть легкого, которое было тесно спаяно с аневризмой, частично образуя ее стенку, и выделить дугу аорты и нисходящий отдел на некотором расстоянии от аневризмы. После резекции аневризмы вместе с протезом дефект грудной аорты замещен гофрированным лавсановым сосудистым протезом.
В развитии сужений в области анастомозов большую роль играют технические погрешности операции (А. В. Покровский и соавт., 1972). К ним относятся небольшой диаметр анастомозов (меньше 15 мм), чрезмерное стягивание швов, неправильное сопоставление краев аорты с алло-протезом. Достаточно достоверным признаком нарушения нормального кровотока в аорте в отдаленные сроки у больных, оперированных в детском возрасте, является патологический градиент давления в верхних и нижних конечностях. Градиент давления выше 30—40 мм рт. ст. является показанием к
проведению рентгенохирур-гических исследований и к повторной операции (А. В. Покровский и соавт., 1972).
У больных, оперированных в раннем детском возрасте, в отдаленные сроки повторные стенозы, требующие хирургической коррекции, встречаются нередко — у 8% из 333 детей, 54% которых оперированы в возрасте до 1 года (Тawes и соавт., 1969). Основная причина
— несоответствие роста аорты и диаметра анастомоза. Однако следует напомнить, что операцию у детей этого возраста выполняют, по сути, по жизненным показаниям, так как при одной лишь консервативной терапии смертность достигает 80% (Bur-ford и соавт., 1960). Клинические результаты (до 70% детей остаются в живых) оправдывают риск операции, хотя и ценой нарушенной гемодинамики и возможности повторной операции в отдаленные сроки (Pelletier и соавт., 1969).
Приведенные данные о результатах хирургического лечения больных с коарктацией аорты убедительно свидетельствуют о том, что своевременно и радикально произведенная реконструктивная операция является единственно правильным и высокоэффективным методом лечения этого опасного порока развития.
61
АНЕВРИЗМЫ ГРУДНОЙ АОРТЫ
Аневризмы аорты представляют собой диффузное расширение ее сегмента или выбухание стенки на ограниченном участке, когда полость расширения сообщается с просветом аорты.
Аневризмы грудной аорты развиваются обычно вследствие дегенеративных изменений ее стенки и относятся чаще к истинным аневризмам. Ложные аневризмы наблюдаются редко, обычно после травм аорты.
этиология
Различают врожденные, приобретенные и идиопатические, или неясной этиологии, аневризмы. Развитие аневризмы аорты связано с поражением эластических и мышечных элементов ее стенки на почве сифилиса, атеросклероза, септического эндокардита, ревматизма, коарктации (пост-и престенотические аневризмы), идио-патического кистозного медионекроза (Erdheim), врожденного недоразвития эластических элементов соединительной ткани (болезнь Марфана). На первом месте среди причин аневризм грудной аорты стоят сифилис, атеросклероз и травмы.
Приобретенные аневризмы чаще (почти у 90% больных) сифилитического происхождения. Возраст больных — 40—60 лет. Однако за последние годы удельный вес атеросклеротических аневризм растет. Врожденные аневризмы наблюдаются, как правило, у больных до 25—30-летнего возраста.
Наиболее характерная локализация сифилитических аневризм — восходящий отдел и дуга аорты, атеро-склеротических и травматических аневризм — нисходящая аорта (Б. Д. Комаров, 1967, и др.). Встречаются и послеоперационные аневризмы аорты, возникающие на месте сосудистого шва.
Мужчины болеют аневризмой грудной аорты в 3—5 раз чаще, чем жен-жины.
По форме выделяют мешотчатые и веретенообразные аневризмы. Ме-шотчатая аневризма представляет собой выпячивание стенки аорты в виде мешка или шара различного размера (от 1 см до 20—30 см в диаметре), который соединяется с полостью аорты отверстием. Отверстие обычно сравнительно широкое, достигает величины диаметра аорты, а иногда узкое, в виде шейки. В последнем случае аневризма заполняется тромбами.
Веретенообразная аневризма образуется вследствие диффузного патологического процесса и представляет собой расширение стенки аорты по всей или большей части окружности на определенном
ее участке. Веретенообразные аневризмы встречаются чаще — у 80% больных.
По локализации выделяют аневризмы восходящего отдела, дуги аорты, нисходящей аорты, а также тора-ко-абдоминальные аневризмы. Аневризмы синусов Вальсальвы выделяют в самостоятельную патологию. Аневризмы восходящей аорты встречаются чаще, чем других ее отделов.
КЛИНИЧЕСКАЯ КАРТИНА И ДИАГНОСТИКА
Клиническая картина аневризм грудной аорты может быть выраженной с самого начала заболевания или наблюдается скудная симптоматика и даже бессимптомное течение, когда аневризма обнаруживается случайно при рентгенологическом исследовании.
Симптоматика в значительной степени зависит от локализации, величины и протяженности аневризмы. Ведущим симптомом у 1/8 больных с аневризмой грудной аорты любой ло-.кализации является боль за грудиной, в шее, спине, между лопатками различной интенсивности и продолжительности, которая в зависимости от расположения аневризмы выражена больше справа или слева. Она объясняется растяжением и давлением на нервные сплетения, коронарной недостаточностью, сдавлением и смещением соседних органов. У V3 больных ведущими симптомами являются одышка, стридор,
medwedi.ru
62
сухой кашель, обусловленные смещением и сдавлением трахеи, бронхов, легочных сосудов, в связи с чем нередко больных направляют в клинику с диагнозом рака бронхов. Почти у половины больных отмечается артериальная гипер-тензия.
Аневризмы больших размеров характеризуются более яркой клиникой. Под давлением увеличивающейся аневризмы грудная клетка может выпячиваться, рассасываются хрящи, ребра, рукоятка грудины, правая клк> чица, и аневризма определяется паль-паторно или видима под кожей в виде пульсирующей опухоли. Распространение аневризмы кзади вызывает узу-рацию позвонков, кифоз( сдавление нервных корешков и спинного мозга.
Аневризмы грудной аорты характеризуются разнообразной неврологической симптоматикой, обусловленной сдавлением возвратного нерва (сухой кашель, охриплость голоса), блуждающего нерва (брадикардия, слюнотечение), симпатических узлов (симптом Горнера), раздражением пе-риаортального симпатического сплетения (аортально-плечевой синдром, проявляющийся болью в левой лопатке, плече, предплечье), ишемическими нарушениями со стороны головного мозга (от аортально-церебральных кризов до ишемического мозгового инсульта) и спинного мозга (парапа-рез, параплегии) (Н. К. Боголепов, Н. П. Баринов, 1969).
Сосудистые шумы — систолический или систоло-диастолический — вследствие поступления крови в полость аневризмы и обратно отмечаются редко, так как у большинства больных (у 40%, Б. Д. Комаров, 1967) аневризма тромбируется. Появление диастолического шума чаще свидетельствует о развивающейся недостаточности аортального клапана.
Симптоматика зависит от локализации аневризмы, что позволяет некоторым больным поставить предположительный топический диагноз на основании клинических данных. Аневризмы восходящей аорты занимают сравнительно небольшой по длине отдел аорты от клапанов до устья плече-головного ствола, но нередко достигают больших размеров. Аневризмы этой локализации чаще имеют сифилитическую природу. Мешотчатые аневризмы встречаются относительно чаще, чем других отделов аорты.
Для аневризм восходящей аорты характерна загрудинная локализация боли и ощущение пульсации за грудиной. Аневризмы восходящей аорты, растущие
вперед, долго могут не вызывать сдавления органов средостения, достигают больших размеров и нередко впервые распознаются по выпячиванию участка грудной клетки и определяемому пальпаторно характерному шуму. При перкуссии отмечается расширение границ сосудис того пучка.
Аневризмы, растущие вправо, вызывают сдавление верхней полой вены и развитие синдрома верхней полой вены (отек и цианоз лица, шеи, расширение вен верхних конечностей, шеи, головная боль). Особенно выражен этот синдром при прорыве аневризмы в верхнюю полую вену с быстро наступающей декомпенсацией кровообращения.
Поражение интраперикардиальной части аорты проявляется клинически симптомами хронической коронарной недостаточности и недостаточности аортальных клапанов (диастолический шум во II межреберье у правого края грудины, аортальная конфигурация сердца, низкое диастолическое давление).
Характерно быстрое развитие осложнений, которые приводят к летальному исходу. Наиболее частые причины смерти — разрыв аневризмы и кровотечение в полость перикарда, прогрессирование аортальной недостаточности и окклюзия коронарных сосудов, сдавление жизненно важных органов.
Аневризмы дуги аорты проявляются особенно яркой клинической симптоматикой, обусловленной частотой и серьезностью осложнений в результате сдавления трахеи, левого главного бронха, верхнего отдела пищевода, легочной артерии, левой безымянной вены, нервов средостения, а также вовлечением в процесс ветвей дуги аорты.
Чаще всего наблюдаются симптомы сдавления и смещения трахеи и левого главного бронха: одышка в покое, чаще инспираторного типа, стридор, ателектаз, абсцесс, воспаление левого легкого, симптом Оливера — Карда-релли (при потягивании
63
щитовидного хряща вверх и кпереди определяется смещение гортани при каждой систоле в связи с передачей пульсации на бронх, трахею и гортань).
Сдавление верхнего отдела пищевода проявляется дисфагией. Ценные данные могут быть получены при рентгенологическом обследовании с барием. Сдавление легочной артерии приводит к хронической перегрузке правого сердца, застойным явлениям в легких.
Распространение аневризмы на выпуклую часть дуги, особенно при тром-бировании аневризматического мешка, проявляется симптомами нарастающих расстройств кровоснабжения головы и верхних конечностей (см. «Синдром дуги аорты»). Аневризмы на верхней выпуклой части дуги можно прощупать пальцем в яремной ямке. При больших аневризмах отмечаются притупление перкуторного звука и пульсация слева от грудины'.
Для этой локализации аневризмы характерна неврологическая симптоматика: сухой кашель, охриплость голоса вследствие сдавления возвратного нерва, симптом Горнера при сдав-лении шейного симпатического узла.
Аневризмы дуги аорты нередко распространяются на восходящую и нисходящую аорту. Аневризмы нисходящей аорты. Для аневризм этой локализации характерны симптомы сдавления пищевода (дисфагия), грудного лимфатического протока (отек верхней половины тела, хилоторакс), корня левого легкого (застойные явления, пневмонии), позвонков (узурация, кифоз), межреберных нервов и сосудов (ради-кулярный и миелитический синдромы).
Ранним симптомом является упорная боль в спине, между лопатками, нередко в левой руке. Боль является ведущим признаком у 2/3 больных. (Schildberg, Heberer, 1971). При аневризмах больших размеров могут появляться небольшие кровотечения из пищевода, паренхиматозные легочные кровотечения
(предвестники разрыва аневризмы). Аневризмы этой локализации менее сложны для диагностики и относительно легко определяются при клинико-рентгенологическом исследовании.
Диагностика аневризмы грудной аорты трудная: 40—50% больных госпитализируют с ошибочными диагнозами. Точный топический диагноз основывается на данных рентгенологических методов исследования, которые по своей диагностической ценности превосходят другие клинические и специальные методы. Применяют многоосевую рентгеноскопию и рентгенографию, томографию, ангиографию, кинематоангиографию.
Аневризмы восходящего отдела обычно проецируются на правое легочное поле, затемняя правую границу сердца. Особенно эффективна рентгенография в передне-задней и правой задней косой позиции. При аневризмах дуги аорты отмечается расширение тени средостения чаще влево. Сдавление трахеи и ее смещение обычно выявляются на снимке в боковой проекции и при томографии. Рентгеноскопия пищевода с барием позволяет выявить его смещение или сдав-ление. Аневризмы нисходящей аорты диагностир уются рентгенологически относительно легко. Они проецируются слева и кзади, обычно не затемняют левой границы сердца. Кальцифика-ция аневризматического мешка очень характерна для сифилитических и ате-росклеротических аневризм.
Рентгеноконтрастное исследование — аортография — показано в трудных диагностических случаях, когда с помощью обычных рентгенологических методов исследования не удается установить характер патологии (В. С. Смоленский, 1964; И. В. Спиридонов, 1967).
Аортография в большинстве случаев подтверждает диагноз и позволяет определить локализацию, форму, распространенность аневризмы, степень поражения ветвей дуги аорты, отношение аневризмы к окружающим органам, состояние аортального клапана. Значение этих данных для хирургического лечения является решающим.
При аневризме дуги и нисходящей аорты контрастное вещество вводят в восходящую аорту путем ретроградной катетеризации по Сельдин-геру через подмышечную артерию. Катетер вводят проксимальнее аневризмы (И. X. Рабкин, 1977). Серийная ангиография может быть выполнена также в левой передней косой позиции, при которой хорошо
medwedi.ru
64
контури-руются ветви дуги аорты (Roux и соавт., 1971), и в левой боковой проекции (при аневризмах дуги аорты). О недостаточности аортального клапана судят на основании регургитации контрастного вещества в левый желудочек. Для уточнения состояния аортальных клапанов при аневризме восходящей аорты приходится осуществлять ретроградную катетеризацию через бедренную артерию с введением контрастного вещества в восходящую аорту.
Обычно же при локализации аневризмы в области восходящей аорты показана левая вентрикулография путем транссептальной пункции (И. X. Рабкин, 1977). Ангиографическая тень аневризмы обычно меньше действительных размеров ее полости.
Аневризмы грудной аорты необходимо дифференцировать с опухолями и кистами переднего и заднего средостения, перикарда, которые у большинства больных распознаются с помощью клинико-рентгенологических методов исследования. Хорошим критерием для отличия аневризм от опухолей средостения Heberer и Schildberg (1970) считают определение угла между опухолевидным образованием и аортой, который при аневризме тупой, а при опухоли чаще острый. При веретенообразных аневризмах определяется усиленная или обычная пульсация, а у больных с мешотчатой аневризмой нередко отсутствует или резко снижена амплитуда зубцов по контуру патологической тени (Б. Д. Комаров, 1967).
Необходимо исключить также удлинение и дила-тацию аорты различного происхождения, которые выявляются при ан-гиографическом исследовании.
Прогноз при нелеченых аневризмах грудной аорты неблагоприятный в связи с частыми и тяжелыми осложнениями. В течение 3 лет после установления диагноза умирают 37,5% больных, через 5 лет—54% (Jouce и соавт., 1964). Причины смерти: у 35—40% больных — разрыв аневризмы, у 20—36% — сердечная недостаточность, у 14—20% больных — сдавление трахео-бронхиального дерева и пневмония.
Разрыв аневризмы с кровотечением происходит в различные органы: в перикард (острая тампонада сердечной сумки), верхнюю полую вену (аорто-кавальная фистула с прогрессирующей сердечной недостаточностью), трахею и бронхи, плевральную полость, средостение, пищевод и, как казуистика, наружу. Такие разрывы, особенно в полости перикарда, плевры, в бронх в течение нескольких минут или часов приводят к летальному исходу. Наблюдаются также эмболии тромботическими массами из аневриз-матического мешка в различные области сосудистой системы: сосуды головного мозга, бифуркацию аорты, артерии конечностей, висцеральные сосуды.
ЛЕЧЕНИЕ
Лечение аневризм аорты только хирургическое, необходимость которого диктуется тяжелым прогнозом, а также задачей устранения компрессионного синдрома и осложнений. Риск операции крайне высокий.
Показания к хирургическому лечению определяются предполагаемым риском операции, который зависит в первую очередь от наличия и тяжести сопутствующих заболеваний (хроническая коронарная недостаточность, гипертония, цереброваскулярные нарушения, заболевания легких и почек), формы и локализации аневризмы. Основными показаниями к операции являются аневризмы с относительно меньшим операционным риском (мешотчатые аневризмы любой локализации, аневризмы нисходящей аорты), аневризмы больших размеров (больше 7—8 см в диаметре), вызывающие выраженный медиастинальный компрессионный синдром. При аневризме дуги аорты с выраженной клиникой больных целесообразно оперировать, так как только около 20% живут больше 5 лет. При асимптом-ном течении больше 50% больных живут свыше 5 лет, поэтому операция не показана, так как успешные результаты хирургического лечения значительно не превышают это число (Carpentier и соавт., 1971).
Ведущее значение в настоящее время приобрели радикальные хирургические методы лечения аневризм грудной аорты. Паллиативные операции, направленные на укрепление
65
стенки аневризмы синтетической или органической тканью с целью предотвращения ее разрыва, а также введение в просвет аневризмы металлических тел с целью вызвать ее тромбирование оставлены как бесполезные и опасные.
Первая попытка радикального лечения — перевязка мешотчатой аневризмы — сделана Tuffier в 1902 г. Впервые успешно выполнили резекцию аневризмы в сочетании с устранением коарктации грудной аорты Ochsner (1944) и Schumacker (1948), резекцию мешотчатой аневризмы — Monod (1949) и Bahnson (1953). В нашей стране первые радикальные операции по поводу аневризмы грудной аорты выполнили А. Н. Бакулев и Б. В. Петровский. Однако систематическим изучением этой патологии и развитием хирургии грудной аорты клиническая хирургия обязана в первую очередь De Bakey и его сотрудникам, которые разработали ряд оригинальных способов оперативного лечения. В нашей стране ни один автор не располагает большим опытом оперативного лечения данной патологии.
Основной принцип радикальных операций заключается в иссечении аневризмы и восстановлении непрерывности кровотока с помощью сосудистого шва или пластики аорты. Трудности при операциях на грудной аорте заключаются не в самой технике операции, а в необходимости решения следующих основных проблем, связанных с пережатием аорты: предупреждение ишемических поражений головного и спинного мозга, почек, миокарда; предупреждение острой перегрузки сердца в связи с острой артериальной гипертензией выше места пережатия аорты.
Важным для успеха операции является выбор адекватного доступа, а также метода пластики и трансплантата для замещения дефекта аорты. Решение этих вопросов стало возможным в связи с разработкой методов временного шунтирования, искусственного кровообращения и созданием синтетических сосудистых протезов.
Хирургический доступ должен быть достаточно широким, чтобы свободно манипулировать на аневризме, обеспечить контроль сосудов проксимально и дистально от аневризмы, а при необходимости — возможность шунтирования и экстракорпоральное кровообращение. Выбор оптимального доступа определяется локализацией и протяженностью аневризмы.
Оптимальный хирургический доступ к восходящей аорте — продольная срединная стернотомия (доступ Милтона). При необходимости выполнения манипуляций на брахиоце-фальных ветвях разрез может быть продлен на область шеи (см. рис. 41). Доступ удобен также для применения искусственного кровообращения.
Для доступа к дуге аорты и бра-хиоцефальным артериям в зависимости от локализации поражения и характера оперативного вмешательства могут быть использованы срединная стернотомия, горизонтальная (двусторонняя) стерноторакотомия и срединная стернотомия, дополненная тора-котомией слева. При двусторонней стерноторакотомии разрез выполняют по II межреберью справа и по III— IV — слева с пересечением грудины. Больной при этом находится в положении лежа на правом боку с отведением и фиксацией левой руки. Разрез обеспечивает достаточно хороший доступ ко всем отделам дуги аорты и возможность применения искусственного кровообращения, но связан с большой операционной травмой. Срединная стернотомия с левосторонней боковой торакотомией по IV или V межреберью обеспечивает доступ ко всем отделам грудной аорты.
Для доступа к нисходящей части аорты чаще используют боковую то-ракотомию слева по IV или V межреберью или же с поднадкостничной резекцией ребра. Этот разрез обеспечивает выделение перешейка аорты, дис-тальной части дуги, левой подключичной артерии, а также большей части нисходящего отдела аорты. При этом доступе возможно применение лево-предсердно-бедренного экстракорпорального шунтирования. При поражении дистального отдела нисходящей грудной аорты торакотомия может быть выполнена по VI или VII межреберью. Для доступа к торакоабдоми-нальному отделу аорты используют торакофренолапаротомию или торако-френолюмботомию.
medwedi.ru
66
Вбольшинстве случаев доступы к грудной аорте связаны с большой операционной травмой и возможностью развития тяжелых осложнений. Особенно травматичны двусторонняя то-ракостернотомия и комбинированные доступы (стернотомия, дополненная торакотомией). Большое значение при этих доступах имеют тщательный гемостаз и хорошее дренирование полостей (загрудинный и внутриплевральный дренажи).
Впослеоперационный пе-. риод необходимо тщательно налаживать активное функционирование дренажей, проводить клинический рентгенологический контроль за плевральными полостями и средостением, профилактику пневмоний и эффективное лечение легочной недостаточности.
Наибольшие трудности заключаются в предупреждении тяжелых последствий пережатия аорты. Пережатие аорты в восходящем отделе приводит к острой перегрузке левого желудочка и его фибрилляции. Пережатие аорты под левой подключичной артерией вызывает резкое повышение артериального давления в системе брахиоцефаль-ных ветвей до 200—300 мм рт. ст., которое через 10—20 мин постепенно снижается почти до нормы. Пережатие аорты ниже почечных артерий сопровождается незначительными колебаниями артериального давления. В условиях нормотермии пережатие восходящей аорты приводит через несколько минут к необратимым изменениям в головном мозге, через 20—30 мин — в спинном мозге с последующей параплегией. Почки могут переносить ишемию при пережатии грудной аорты в течение 30—40 мин, печень, селезенка, кишечник — 40—50 мин.
Опасность ишемического поражения органов значительно уменьшается при умеренной гипотермии. Использование временного шунтирования сосудистым синтетическим трансплантатом, который вшивают проксималь-нее и дистальнее аневризмы, или внутрисосудистого шунтирования при помощи пластмассовых трубок, применение экстракорпорального кровообращения позволили решить проблему кровоснабжения жизненно важных органов во время иссечения аневризмы и пластики аорты. Для пластики аорты применяют синтетические сосудистые протезы из дакрона, тефлона, фтор-лон- лавсана.
При радикальном лечении аневризм грудной аорты применяют два основных метода: боковую (тангенциальную) резекцию аневризмы с ушиванием раны аорты и резекцию ее с замещением стенки аорты сосудистым трансплантатом.
Первый метод наиболее простой, так как кровоток в аорте полностью не прерывается. С
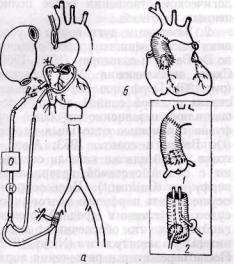
момента первой  Рис. 27. Методы реконструктивных операций при мешотчатых аневризмах грудной аорты:
Рис. 27. Методы реконструктивных операций при мешотчатых аневризмах грудной аорты:
а '— наиболее частая локализация мешотчатых аневризм; б — тангенциальная резекция аневризмы без перерыва кровотока в аорте; в — резекция мешотчатой аневризмы восходящей аорты с широкой шейкой, занимающей 1/3 — 1/2 окружности аорты в условиях экстракорпорального кровообращения операции перевязки мешотчатой аневризмы эта техника операции достигла высокого
развития (De Bakey и соавт., 1958; Dubost и соавт., 1962; НеЬегег, 1966). Операцию
67
производят в случае мешотчатых аневризм при условии, если шейка аневризмы располагается в положении, допускающем тангенциальное пережатие аорты. Большой изогнутый зажим или зажим Сатин-ского накладывают параллельно стенке аорты обычно без перерыва кровотока в ней. Аневризму иссекают над зажимом (рис. 27). Дефект в аорте ушивают двухэтажным швом: П-об-разным прерывистым и непрерывным обвивным или восьмиобразным (De Bakey). Важным условием является наложение швов в пределах здоровой стенки аорты. Для укрепления ее стенки может быть подшита сверху заплата из синтетической ткани.
Второй способ — резекция аневризмы с замещением дефекта трансплантатом — применяют при веретенообразных аневризмах, а также мешотчатых с широкой шейкой, занимающей 1/3 — V2 окружности аорты. При этом методе необходимо времен-
ное пережатие аорты, что сопряжено с большими техническими трудностями и большим операционным риском.
Выбор метода операции и способа защиты жизненно важных органов от ишемии во время пережатия аорты зависит от локализации и формы аневризмы.
Лечение аневризм восходящей аорты. Первые успешные операции по поводу аневризмы восходящей аорты выполнили Cooley и соавторы (1955).
При аневризмах этой локализации лучшим доступом считается срединная продольная стернотомия. Этот разрез удобен также для подключения экстракорпорального кровообращения. При наличии больших аневризм, тесно прилегающих к передней грудной стенке, узурирующих грудину, ребра, выполнение срединной стерно-томии рискованно. Целесообразно применить правостороннюю переднюю торакотомию или двустороннюю тора-котомию с поперечной стернотомией.
Мешотчатые аневризмы с хорошо оформленной шейкой, доступные для тангенциального пережатия, резецируют над зажимом, как описано выше. Если шейка широкая, охватывает более V3 окружности аорты или аневризма кзади расположена, а также при веретенообразных аневризмах необходима резекция пораженного участка аорты с замещением его трансплантатом. Для поддержания кровотока дистальнее места пережатия аорты применяют полное экстракорпоральное кровообращение.
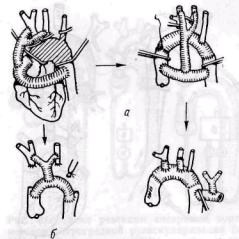
При резекции аневризм, расположенных близко к аортальным клапанам, необходима перфузия всех органов, включая миокард. Кровоток в органах брюшной полости, спинном и головном мозге обеспечивается искусственным кровообращением с помощью АИК через бедренную артерию, в миокарде — селективной перфузией коронарных артерий (рис. 28, а). При распространении поражения на ветви дуги аорты используют также
дополнительную перфузию сонных артерий. |
|
|
|
Рис. 28. Метод операции |
при аневризме восходящей |
аорты, |
осложненной |
выраженной недостаточностью |
аортального клапана: |
|
|
а — резекция аневризмы в условиях искусственного кровообращения с коронарной перфузией; б — имплантация искусственного клапана и пластика восходящей аорты
medwedi.ru
68
синтетическим сосудистым протезом: / — супракоронарная резекция; 2 — инфракоронарная резекция с имплантацией устьев коронарных артерий в сосудистый протез (по Benntall с соавт., 1968)
В случае выраженной недостаточности аортального клапана выполняют резекцию аорты с бикуспидализацией (впервые выполнена Ellis и соавт., 1961; Groves и соавт., 1964) или протезированием (Groves и соавт., 1964; Cooley и соавт., 1967; Schulte, Bircks, 1971) аортальных клапанов (рис. 28, б).
Применение искусственного кровообращения при удалении аневризм восходящей аорты в настоящее время считается методом выбора. Способ временного шунтирования, предложенный Cooley и соавторами (1955), используется редко при условии, если имеется относительно здоровый участок аорты над клапанами для наложения бокового анастомоза с шунтом.
Лечение аневризм дуги аорты. Аневризмы этого сегмента аорты считаются наиболее трудными для хирургического лечения. Это обусловлено сложностью анатомического строения этого отдела аорты, расположенного в переднем и заднем средостении, не-
Рис. 29. Резекция аневризмы дуги аорты с замещением дуги синтетическим сосудистым протезом без применения искусственного кровообращения:
а — способ временного наружного шунтирования сосудистым протезом с последующим удалением шунта (по Cooley с соавт , 1955); б — способ временного шунтирования с последующим превращением временного шунта в постоянный трансплантат (no Cwathmey с соавт., 1958)
редким поражением брахиоцефальных сосудов и опасностью ишемического поражения головного мозга во время операции.
Известны три основных способа оперативного лечения аневризм дуги аорты.
1. Способ временного шунтирования без искусственного кровообращения (Cooley и соавт., 1955). Временный шунт из синтетического сосудистого протеза анастомозируют с восходящей и нисходящей аортой по типу конец в бок при тангенциальном отжатии аорты. Боковые ветви шунта анастомозируют конец в бок с плече-головным стволом и левой сонной артерией. Затем аорту пережимают, переключая кровоток на временный шунт, аневризму иссекают, вшивают постоянный сосудистый протез конец в конец с восходящей и нисходящей аортой, плече-головным стволом, левой сонной и левой подключичной артериями (рис. 29, а). Временный шунт удаляют и ушивают разрезы на сосудах.
