
- •1. Строение, свойства и биологические функции
- •1.1. Углеводы
- •1.1.1. Моносахариды
- •1.1.2. Олигосахариды
- •1.1.3. Полисахариды
- •Различаются строением и физико-химическими свойствами.
- •1.2. Липиды
- •1.2.1. Жиры
- •Ведётся направленная селекция этих растений с целью понижения в масле содержания эруковой кислоты.
- •1.2.2. Фосфолипиды
- •1.2.3. Гликолипиды
- •1.2.4. Стероидные липиды
- •1.2.5. Воски
- •1.3. Аминокислоты
- •1.1. Важнейшие аминокислоты растений
- •Вопросы для самоконтроля
- •1.4. Нуклеотиды
- •1.2. Названия важнейших нуклеотидов.
- •1.5. Белки
- •1.5.1. Строение белковых молекул
- •1.5.2. Конформация белковых молекул
- •1.5.3. Размеры и формы белковых молекул
- •1.5.4. Свойства белков
- •1.5.5. Классификация белков
- •1.5.6. Аминокислотный состав белков
- •1.3. Аминокислотный состав некоторых растительных белков
- •1.4. Содержание аминокислот в некоторых растительных белках (%)
1.3. Аминокислоты
А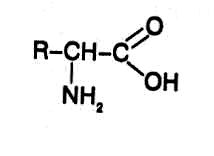 минокислоты
– это
первичные азотистые вещества растений,
кото-рые синтезируются с использованием
минерального азота, поступающего главным
образом из почвы. В молекулах аминокислот
имеются карбок-сильные
и аминные группы, соединенные с
органическим радикалом али-фатической,
ароматической или гетероциклической
природы. Если амино-кислота содержит
одну карбоксильную и одну аминную
группу, связанную со вторым углеродным
атомом (а-положение),
строение такой аминокис-лоты можно
выразить следующей формулой:
минокислоты
– это
первичные азотистые вещества растений,
кото-рые синтезируются с использованием
минерального азота, поступающего главным
образом из почвы. В молекулах аминокислот
имеются карбок-сильные
и аминные группы, соединенные с
органическим радикалом али-фатической,
ароматической или гетероциклической
природы. Если амино-кислота содержит
одну карбоксильную и одну аминную
группу, связанную со вторым углеродным
атомом (а-положение),
строение такой аминокис-лоты можно
выразить следующей формулой:
Аминокислоты, имеющие одну карбоксильную и одну аминную группу, принято называть моноамuномонокарбоновымu. У большинства из них аминогруппа находится в α-положении по отношению к атому угле-рода карбоксильной группы. Однако известны также некоторые аминокис-лоты, у которых аминогруппа связана с другими углеродными атомами (b, γ, d и др., см. табл. 1.1).
В организмах также синтезируются аминокислоты с двумя карбок-сильными или двумя аминными и другими азотсодержащими группи-ровками. Аминокислоты, содержащие две карбоксильные и одну аминную группы, обычно называют моноамuнодuкaрбоновымu, а имеющие две аминные и одну карбоксильную – диаминомонокарбоновымu. Кроме того, аминокислоты различаются по строению радикала R, который может быть представлен неразветвленной, а у некоторых аминокислот и разветвленной углеродной цепью, ароматическими и гетероциклическими производными.
Наряду с аминокислотами важную роль в обмене азотистых веществ растений играют некоторые иминокислоты (пролин, оксипролин, пипеко-лииовая кислота и др.), содержащие вторичную аминную группировку (═NH). Они близки по своим физико-химическим свойствам к истинным аминокислотам и выполняют сходные биологические функции.
Важные функции в растительном организме выполняют производ-ные аминокислот – амиды и бетаины, из которых наиболее хорошо изучены аспарагин, глутамин и гликоколбетаин. Аспарагин и глутамин участвуют в построении белковых молекул, являются продуктами обмена многих азотистых веществ. Гликоколбетаин ─ продукт азотного обмена у некоторых растений, служит активным донором метильных групп.
Все α-аминокислоты, за исключением глицина, содержат асиммет-рические атомы углерода и проявляют оптическую активность. D- и L-формы аминокислот различают по положению водорода и аминогруппы у α-углеродного атома. За эталон сравнения принимаются конфигурации молекул L- и D-серина. Изомеры аминокислот, имеющие ориентацию в пространстве водорода и аминогруппы у α-углеродного атома такую же, как у L- или D-серина, относят соответственно к L- или D-ряду.
1.1. Важнейшие аминокислоты растений




Направление и угол вращения плоскости поляризации света у разных аминокислот и их оптических изомеров зависят от строения радикала R, реакции среды (рН), природы растворителя и растворенных в нем веществ.
Подавляющее большинство природных аминокислот синтезируется в организмах в виде L-форм, а D-формы аминокислот встречаются редко, чаще всего в клетках микроорганизмов. При химическом синтезе образу-ется рацемическая смесь L- и D-изомеров аминокислот.
Ф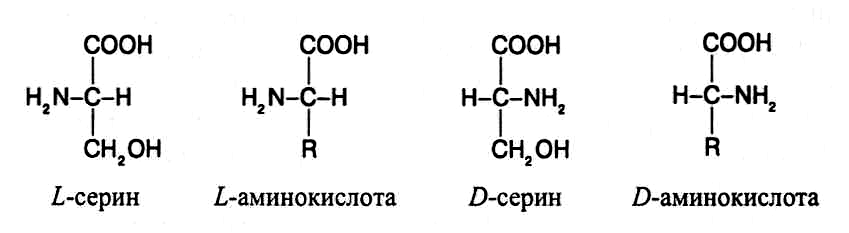 ерментные
системы растений, человека и животных
специфически приспособлены
катализировать биохимические реакции,
происходящие с участием L-изомеров
аминокислот, и не способны к превращениям
D-изомеров, которые могут даже ингибировать
биохимические процессы в организме. В
опытах установлено, что только метионин
может усваиваться организмами человека
и животных как в L-форме,
так и D-форме.
ерментные
системы растений, человека и животных
специфически приспособлены
катализировать биохимические реакции,
происходящие с участием L-изомеров
аминокислот, и не способны к превращениям
D-изомеров, которые могут даже ингибировать
биохимические процессы в организме. В
опытах установлено, что только метионин
может усваиваться организмами человека
и животных как в L-форме,
так и D-форме.
Первые аминокислоты были открыты в начале XIX в., а к концу века уже были выделены и изучены почти все аминокислоты, входящие в состав белков. В настоящее время известно более 200 аминокислот. Важнейшая биологическая роль аминокислот – построение белковых молекул. Аминокислоты, участвующие в синтезе белков, принято называть протеиногенными, их насчитывается 18. Кроме того, в синтезе белков принимают участие два амида – аспарагин и глутамин. Протеиногенные аминокислоты и указанные амиды кодируются определенными кодонами генетического кода (см. табл. 3.2).
После синтеза белковой молекулы в ней могут происходить модификации радикалов некоторых аминокислот, поэтому при анализе состава белков кроме протеиногенных обнаруживают некоторые другие аминокислоты (оксипролин, оксилизин и др.).
Аминокислоты, не участвующие в синтезе белков, являются важны-ми метаболитами, с участием которых происходит синтез протеиногенных аминокислот, а также всех других азотистых веществ растительного орга-низма: нуклеотидов, амидов, азотистых оснований, различных пептидов, алкалоидов, некоторых липидов, многих витаминов, хлорофилла, фитогор-монов (ауксинов, цитокининов), некоторых фитонцидов. Строение и био-логическая роль важнейших аминокислот представлены в таблице 1.1.
Растения и природные формы микроорганизмов способны синтези-ровать все необходимые им аминокислоты из других органических ве-ществ, тогда как организмы человека и животных не способны к синтезу некоторых аминокислот, входящих в состав белков. Эти аминокислоты называют незаменимыми, и они должны поступать в организм с пищей.
Для взрослого человека незаменимыми являются 8 аминокислот: ли-зин, триптофан, метионин, треонин, валин, лейцин, изолейцин, фенилала-нин. У детей и некоторых групп животных к незаменимым аминокислотам относятся также аргинин, гистидин и цистеин. При недостатке незамени-мых аминокислот ослабляется синтез белков, что может быть причиной тяжелых заболеваний. А их недостаток в растительных кормах снижает выход животноводческой продукции в расчете на единицу массы затрачен-ного корма, в результате чего повышается ее себестоимость.
В целях составления правильного пищевого рациона для каждого ви-да организмов с учетом возрастного и физического состояния определены ежедневные нормы потребления незаменимых аминокислот. В среднем для человека они составляют, г: валин – 5,0, лейцин – 7,0, изолейцин – 4,0, ли-зин – 5,5, триптофан – 1,0, треонин – 4,0, метионин – 3,5, фенилаланин – 5,0.
Чаще всего в кормах сельскохозяйственных животных в недостаточ-ном количестве содержатся такие незаменимые аминокислоты, как лизин, триптофан и метионин. Для балансирования кормов по содержанию этих аминокислот разработаны промышленные способы их получения. В связи с тем что лизин и триптофан усваиваются животными только в виде L-изомеров, для производства кормовых препаратов указанных аминокислот применяют микробиологический синтез, при котором реализуется природ-ный механизм образования L-изомеров аминокислот. Поскольку метионин может усваиваться животными в виде D- и L-форм, для его промышлен-ного получения используют менее затратный химический синтез, дающий рацемическую смесь оптических изомеров этой аминокислоты.
Содержание свободных аминокислот в растениях (включая и сель-скохозяйственные культуры) зависит от вида органа или ткани, возраста растений, внешних условий и особенно подвержено большим изменениям в зависимости от интенсивности протекания биохимических процессов, которые сопряжены с их потреблением (синтез белков, нуклеиновых кислот и других азотистых веществ). Концентрация аминокислот повышается при ослаблении ростовых процессов, недостатке питательных элементов, избыточном азотном питании, усилении процессов распада белков и других азотистых веществ при старении растений или прорастании семян.
Концентрации отдельных аминокислот могут возрастать в результате метаболических нарушений в организме и под воздействием стрессов. Так, например, при вододефицитном стрессе в клетках растений происходит накопление аминокислоты пролина, а при избыточном аммонийном пита-нии – аспарагина, глутамина и аргинина. Концентрация аминокислот повышается в соке листьев растений при ослаблении ростовых процессов, связанном с действием неблагоприятных факторов внешней среды и недостаточным азотным питанием.
В водном растворе карбоксильные группы
аминокислот подверга-ются диссоциации
с образованием катионов водорода, а
азот аминогруппы довольно активно
присоединяет катионы водорода,
превращаясь в заря-женную группировку,
в результате чего образуется биполярное
соедине-ние:
водном растворе карбоксильные группы
аминокислот подверга-ются диссоциации
с образованием катионов водорода, а
азот аминогруппы довольно активно
присоединяет катионы водорода,
превращаясь в заря-женную группировку,
в результате чего образуется биполярное
соедине-ние:
П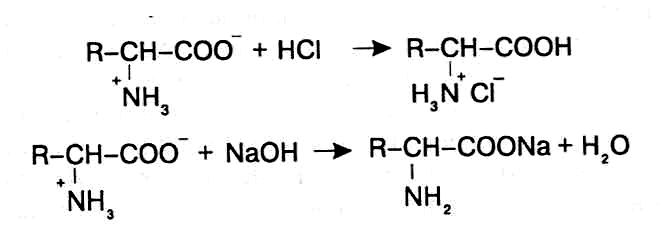 оскольку
в молекулах аминокислот имеются как
кислотные, так и основные (аминные)
группировки, они проявляют амфотерные
свойства и могут взаимодействовать как
с кислотами, так и с основаниями, образуя
соответствующие соли:
оскольку
в молекулах аминокислот имеются как
кислотные, так и основные (аминные)
группировки, они проявляют амфотерные
свойства и могут взаимодействовать как
с кислотами, так и с основаниями, образуя
соответствующие соли:
Аминокислоты довольно легко вступают в реакции с редуцирующими сахарами, образуя при этом темноокрашенные продукты – мелано-идины. На первом этапе взаимодействия аминокислоты и моносахарида образуются продукты их разложения: из сахаров – фурфурол или оксиме-тилфурфурол, а из аминокислоты – альдегид, диоксид углерода и аммиак. На следующем этапе фурфурол и оксиметилфурфурол, вступая в соеди-нение с аминокислотами, образуют меланоидины. Интенсивность реакции усиливается при повышенной температуре, которая создается при терми-ческой обработке рacтитeльной продукции или её перерaботке (сушка овощей, фруктов и продуктов из картофеля, выпечка хлеба, получение макарон и кондитерских изделий). Меланоидины вызывают потемнение растительных продуктов, что ухудшает их товарные свойства. В процессе хлебопечения реакции образования меланоидинов влияют на формирова-ние цвета, вкуса и аромата ржаного и пшеничного хлеба.
В результате ферментативного окисления ароматических аминокис-лот тирозина и фенилаланина также образуются темноокрашенные продук-ты – меланины, вызывающие потемнение на воздухе очищенных клубней картофеля, измельченных корнеплодов, овощей и фрyкroв. Эти вещества совместно с меланоидинами определяют тёмный цвет ржаного хлеба и вызывают потемнение макарон при сушке (см. раздел 4.1.3). В целях предотвращения потемнения растительной продукции при ее переработке применяют технологии выращивания сельскохозяйственных культур, не допускающие накопления в товарной продукции редуцирующих сахаров и свободных аминокислот.
