
- •1. Строение, свойства и биологические функции
- •1.1. Углеводы
- •1.1.1. Моносахариды
- •1.1.2. Олигосахариды
- •1.1.3. Полисахариды
- •Различаются строением и физико-химическими свойствами.
- •1.2. Липиды
- •1.2.1. Жиры
- •Ведётся направленная селекция этих растений с целью понижения в масле содержания эруковой кислоты.
- •1.2.2. Фосфолипиды
- •1.2.3. Гликолипиды
- •1.2.4. Стероидные липиды
- •1.2.5. Воски
- •1.3. Аминокислоты
- •1.1. Важнейшие аминокислоты растений
- •Вопросы для самоконтроля
- •1.4. Нуклеотиды
- •1.2. Названия важнейших нуклеотидов.
- •1.5. Белки
- •1.5.1. Строение белковых молекул
- •1.5.2. Конформация белковых молекул
- •1.5.3. Размеры и формы белковых молекул
- •1.5.4. Свойства белков
- •1.5.5. Классификация белков
- •1.5.6. Аминокислотный состав белков
- •1.3. Аминокислотный состав некоторых растительных белков
- •1.4. Содержание аминокислот в некоторых растительных белках (%)
1.5.3. Размеры и формы белковых молекул
Определенные представления о пространственном строении и форме белковых молекул были получены в исследованиях с использованием электронного микроскопа. У многих белков форма молекул компактна. Они представляют шарообразные или вытянутые в виде эллипсоида части-цы диаметром 10–30 нм. Кроме того, белковые молекулы могут быть вытянуты в виде нитей диаметром 5–15 нм и длиной несколько сотен нанометров или образуют палочковидные структуры диаметром 10–20 нм и длиной 100–300 нм.
Наиболее точные сведения о пространственном строении белковых молекул были получены методом рентгеноструктурного анализа, с помощью которого изучают структуру белков в кристаллическом состоя-нии. Оказалось, что в белковых кристаллах полностью сохраняется натив-ная конформация молекул, которая стабилизируется большим количес-твом кристаллизационной воды.
Длинные белковые молекулы нитевидной формы принято называть фибриллярными белками. Они содержат длинные параллельные полипеп-тидные цепи, скрепленные поперечными связями. Эти белки отличаются высокой механической прочностью и обычно выполняют структурную функцию. К фибриллярным белкам относятся коллаген сухожилий, миозин мышц, фиброин шелка, кератин волос и перьев.
Белковые молекулы со сферической формой называют глобулярными белками. Их полипептидные цепи свернуты в глобулы, имеющие форму эллипсоида вращения разной степени вытянутости. К глобулярным белкам относятся ферменты, регуляторные и транспортные белки, запасные расти-тельные белки.
На поверхности молекул глобулярных белков имеются складки и довольно глубокие полости, в которые могут проникать низкомолеку-лярные вещества и взаимодействовать с локализованными в них внутри-молекулярными группировками, что очень важно для выполнения белком его биологической функции. Хотя гидрофобное ядро белковой молекулы плотно упаковано, возможны обратимые локальные изменения её вторич-ной и третичной структуры, в результате которых белок приобретает необходимую лабильность. Аминокислотные остатки на поверхности белковой молекулы более подвижны, чем в гидрофобном ядре, и поэтому легко смещаются при взаимной подгонке поверхностей глобул в процессе формирования четвертичной структуры белка.
В связи с большими различиями форм белковых молекул и высокой степенью их полимерности при определении молекулярных масс белков возникают существенные трудности, поэтому для этих целей разработаны специальные методы исследований. Молекулярные массы хорошо раство-римых и очищенных от примесей белков могут быть определены с доволь-но высокой точностью по изменению осмотического давления белкового раствора. Наблюдается обратная зависимость между молекулярной массой белков и осмотическим давлением их растворов.
Молекулярные массы кристаллических форм хорошо очищенных белков с высокой степенью точности определяют методом рентгенострук-турного анализа.
При определении молекулярных масс белков очень часто исполь-зуют седиментационный анализ, основанный на измерении скорости седиментации (осаждения) молекул белков под действием центробежной силы, возникающей при высокоскоростном центрифугировании (ультра-центрифугировании) белкового раствора. Первая установка для высокоско-ростного центрифугирования (ультрацентрифуга) была сконструирована Т. Сведбергом и Д.Б. Никольсом в 1923 г. В современных ультрацен-трифугах можно создавать центробежное ускорение более 500000 g. Под действием центробежной силы молекулы белка, равномерно распределен-ные в растворе, начинают перемещаться в направлении её действия с определенной скоростью, образуя удаляющуюся от центра вращения границу раздела между осаждающимися молекулами белка и чистым растворителем. Положение границы раздела через определенные проме-жутки времени регистрируется с помощью оптической системы, и на основе этих измерений определяется коэффициент седиментации, кото-рый и выражает скорость седиментации белков.
По мере возрастания молекулярной массы белка коэффициент се-диментации увеличивается, однако строго прямой зависимости между эти-ми показателями не наблюдается, так как скорость седиментации белковых молекул зависит также от их формы.
Коэффициент седиментации белков выражают в единицах, называе-мых сведбергом, которые обозначают символом S. Один сведберг (1 S) численно равен 1 × 10-13 с. Для большинства растительных белков коэффи-циенты седиментации находятся в пределах 1–20 S.
На основе коэффициентов седиментации и диффузии белковых мо-лекул рассчитаны молекулярные массы многих белков, выделенных из различных объектов:
рибонуклеаза 12640 α-амилаза 97600
гемоглобин 64500 каталаза 247500
глиадин пшеницы 27500 эдестин конопли 300000
альбумин яйца 44000 уреаза сои 483000
зеин кукурузы 50000 пепсин 35500
Для определения молекулярных масс полипептидов, входящих в состав олигомерных белков, очень часто примененяют метод электро-фореза заряженных частиц в полиакриламидном геле, который позволяет проводить очень точное разделение полипептидов под воздействием электрического поля.
Под влиянием электрического поля заряженные молекулы полипеп-тидов движутся к аноду или катоду через пористый носитель – полиакрил-амидный гель, образующийся при совместной полимеризации акриламида и бисакриламида в определенной буферной среде. Этот гель сильно гид-ратирован и имеет поры определенных размеров в зависимости от соот-ношения в нем акриламида и бисакриламида. Скорость движения заря-женных частиц в пористом носителе зависит от величины заряда, молекулярной массы и пространственной конфигурации молекул, поэтому в результате электрофореза разделяемые частицы, различающиеся по элек-трическому заряду и пространственным параметрам, распределяются в полиакриламидном геле в виде узких зон, которые окрашивают специ-альным красителем. Размеры окрашенных зон точно указывают концен-трацию выделенных при электрофорезе белков или отдельных белковых полипептидных субъединиц (рис. 1.9).
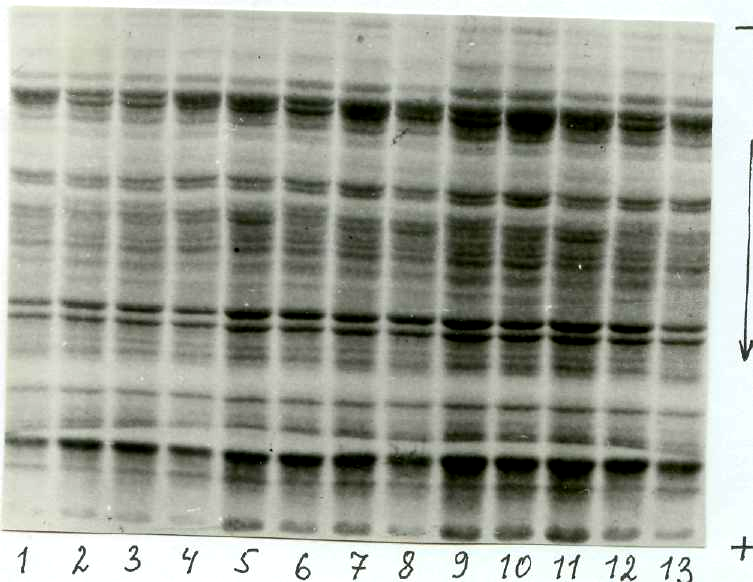
Рис. 1.9. Разделение полипептидов водо- и солерастворимых белков зерна пшеницы методом электрофореза в полиакриламидном геле (стрелкой показано направление движения полипептидов при электрофо-резе; 1–13 – образцы полипептидов разных сортов пшеницы)
Выделение из молекул белков полипептидных субъединиц осуществ-ляют под воздействием анионного детергента – додецилсульфата натрия и восстановителя дисульфидных связей b-меркаптоэтанола. Под влиянием этих денатурирующих агентов олигомерные белки распадаются на состав-ляющие их полипептиды, превращяясь в отрицательно заряженные палоч-ковидные структуры, длина которых зависит от длины полипептидной цепи и, следовательно, в этих условиях является характеристикой моле-кулярной массы выделенных белковых полипептидов.
Гидрофобные радикалы детергента, взаимодействуя с радикалами гидрофобных аминокислот, равномерно связываются с полипептидной цепью, которая за счет анионных групп детергента приобретает довольно высокий отрицательный заряд, многократно превышающий собственный заряд полипептида, вследствие чего при электрофорезе он существенной роли не играет. Поэтому в присутствии додецилсульфата натрия общий заряд полипептида определяется зарядом детергента и длиной полипеп-тидной цепи, с которой равномерно связывается заряженный детергент. В свою очередь, длина полипептидной цепи определяет величину молеку-лярной массы полипептида.
Таким образом, при электрофорезе полипептидов в присутствии анионного детергента додецилсульфата натрия происходит их разделение в зависимости от величины молекулярной массы. Полипептиды с мень-шей молекулярной массой движутся в электрическом поле быстрее, так как при прохождении через поры носителя испытывают меньшее сопро-тивление, чем более крупные полипептиды. Чтобы рассчитать точную величину молекулярной массы изучаемых полипептидов, электрофорезу подвергают смесь полипептидов с известными молекулярными массами и определяют их электрофоретическую подвижность, а затем с помощью специальных расчетов или графически производят оценку молекулярной массы исследуемых полипептидов.
