
- •1. Строение, свойства и биологические функции
- •1.1. Углеводы
- •1.1.1. Моносахариды
- •1.1.2. Олигосахариды
- •1.1.3. Полисахариды
- •Различаются строением и физико-химическими свойствами.
- •1.2. Липиды
- •1.2.1. Жиры
- •Ведётся направленная селекция этих растений с целью понижения в масле содержания эруковой кислоты.
- •1.2.2. Фосфолипиды
- •1.2.3. Гликолипиды
- •1.2.4. Стероидные липиды
- •1.2.5. Воски
- •1.3. Аминокислоты
- •1.1. Важнейшие аминокислоты растений
- •Вопросы для самоконтроля
- •1.4. Нуклеотиды
- •1.2. Названия важнейших нуклеотидов.
- •1.5. Белки
- •1.5.1. Строение белковых молекул
- •1.5.2. Конформация белковых молекул
- •1.5.3. Размеры и формы белковых молекул
- •1.5.4. Свойства белков
- •1.5.5. Классификация белков
- •1.5.6. Аминокислотный состав белков
- •1.3. Аминокислотный состав некоторых растительных белков
- •1.4. Содержание аминокислот в некоторых растительных белках (%)
1.4. Содержание аминокислот в некоторых растительных белках (%)
|
Аминокислоты* |
Альбу- мины проса |
Глобу- лины ячменя |
Легу- мины сои |
Зеины куку- рузы |
Оризе- нины риса |
Норматив ФАО для пищевых белков |
|
Аланин |
6.9 |
4.8 |
3,4 |
8,8 |
5,4 |
– |
|
Аргинин |
9,1 |
10.6 |
7.0 |
1.3 |
7.5 |
– |
|
Аспарагиновая кислота |
4,6 |
10.9 |
12,2 |
4,9 |
7,6 |
– |
|
Валин |
5.1 |
6,3 |
4,3 |
3,6 |
6,4 |
5,0 |
|
Гистидин |
2,6 |
2,5 |
2,3 |
1,0 |
2,2 |
– |
|
Глицин |
6,3 |
5,5 |
3,6 |
1,1 |
4,1 |
– |
|
Глутаминовая кислота |
21,2 |
14,0 |
20,8 |
23,4 |
17,7 |
– |
|
Изолейцин |
3,1 |
3,3 |
5,1 |
3,3 |
5,8 |
4,0 |
|
Лейцин |
6,0 |
6,5 |
6,3 |
18,6 |
9,3 |
7,0 |
|
Лизин |
6,5 |
4,7 |
4,2 |
0,2 |
4,0 |
5,5 |
|
Метионин |
1,7 |
1,1 |
1,3 |
0,9 |
1,9 |
1,7 |
|
Пролин |
4,9 |
4,2 |
4,9 |
9,2 |
5,4 |
– |
|
Серин |
4,5 |
6,2 |
6,5 |
4,9 |
4,8 |
– |
|
Тирозин |
3,1 |
3,1 |
3,9 |
5,0 |
3,8 |
– |
|
Треонин |
4,6 |
5,1 |
4,5 |
2,8 |
4,1 |
4,0 |
|
Триптофан |
1,5 |
1,1 |
1,4 |
0,1 |
1,2 |
1,0 |
|
Фенилаланин |
3,3 |
4,5 |
4,9 |
6,9 |
5,6 |
2,6 |
|
Цистеин |
2,4 |
2,3 |
1,4 |
1,0 |
0,5 |
– |
|
*Вследствие потерь при гидролизе выход аминокислот не равен 100 %. |
||||||
Растительные белки – источники незаменимых аминокислот для че-ловека и сельскохозяйственных животных, так как являются основными компонентами пищи или корма. Под действием пищеварительных фер-ментов белки корма животных или продуктов питания человека гидролизу-ются до аминокислот, которые затем поступают в кровь и далее исполь-зуются для синтеза белков организма.
Потребность животного организма и человека в незаменимых амино-кислотах определяется средним аминокислотным составом синтезируемых белков и, кроме того, учитывается коэффициент использования каждой аминокислоты, зависящий от химического состава корма или пищи, а также особенностей пищеварительной системы и обмена веществ организ-ма. Этот показатель выражает необходимую пропорцию аминокислот в кормовом или пищевом белке.
Если содержание незаменимых аминокислот в белках корма точно соответствует установленной пропорции (т. е. потребности), то все они полностью используются для синтеза белков организма животных и такие кормовые белки называют полноценными. Если же в кормовом белке со-держание хотя бы одной аминокислоты недостаточно, то она будет лими-тировать синтез белков в животном организме и для образования опреде-ленной массы животного белка потребуется восполнять недостаток этой аминокислоты добавлением дополнительного количества корма, что вызы-вает перерасход корма и увеличение затрат на создание одной единицы животноводческой продукции. Кроме того, другие аминокислоты в таких условиях оказываются в избытке и должны превращаться в организме в другие органические вещества. Кормовые белки с низким содержанием незаменимых аминокислот принято называть неполноценными.
По средним нормам питания человеку необходимо потреблять 8–10 г полноценных белков в расчете на 1 МДж обменной энергии, содержа-щейся в пище, коровам – 8–12, свиньям – 10–14, птице – 12–15 г. (Обменная энергия – часть общей энергии, доступная для использования в процессе обмена веществ организма).
Для каждого вида организмов с учетом их возраста и физиологи-ческого состояния определены оптимальные нормы содержания незаме-нимых аминокислот в белках пищи или корма. Наиболее часто в качестве эталона полноценных пищевых и кормовых белков используются норма-тивы, разработанные экспертами Продовольственной и сельскохозяй-ственной организации ООН (ФАО) и Всемирной организации здраво-охранения (ВОЗ). В таблице 5.2 приведен эталон аминокислотной шкалы, рекомендуемый ФАО/ВОЗ для пищевых белков. Биологическая ценность таких белков принимается за 100 %, а другие белки в опытах или с помощью расчетов сравнивают с эталоном.
Более высокую биологическую ценность имеют белки животного происхождения: белок яйца и казеин молока – 100 %, белки мяса и рыбы – 95 %. Из растительных белков наиболее полноценными являются альбу-мины, их биологическая ценность составляет 85–95 %. В составе этих белков валин, лизин, треонин, триптофан, метионин, фенилаланин содер-жатся почти в оптимальных концентрациях, но они имеют некоторый дефицит по содержанию лейцина и изолейцина. Глобулины также хорошо сбалансированы по содержанию незаменимых аминокислот и их биологи-ческая ценность составляет 80–90 %, они в большей степени дефицитны по метионину и лизину и в меньшей – по лейцину, изолейцину, валину.
Биологическая ценность глютелинов – 70–80 %, в них понижена концентрация триптофана, метионина и лизина. Наиболее полноценны по содержанию незаменимых аминокислот глютелины риса – оризенины, в которых отмечается лишь некоторый дефицит по лизину, и их биологи-ческая ценность составляет около 90 %. К неполноценным белкам относят-ся проламины, биологическую ценность которых составляет 40–50 %. В этих белках содержится очень мало триптофана, лизина, метионина и понижена концентрация треонина, валина и изолейцина.
Проламины – специфические белки зерна злаковых растений, поэто-му у них суммарные белки зерновок, включающие проламины, имеют довольно низкую биологическую ценность: белки зерна кукурузы – 52–58%, пшеницы, ячменя и проса – 60–70, ржи и овса – 70–75 %. Суммар-ные белки зерна зернобобовых и семян масличных культур, клубней картофеля, корнеплодов, овощей, плодов и ягод, а также вегетативной массы кормовых трав и других растений вследствие повышенной концен-трации альбуминов и глобулинов характеризуются довольно высокой биологической ценностью – 80–90 %.
Для оценки пищевой полноценности белков очень часто исполь- зуют показатель – биологическая ценность белков (БЦБ), который рас-считывают по формуле:
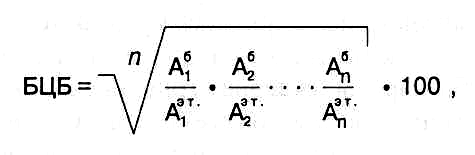
где числитель – содержание незаменимых аминокислот в оцениваемом белке, знамена-тель – содержание тех же аминокислот в эталонном белке (по ФАО/ВОЗ), n – число аминокислот, 100 – пересчет в проценты.
Указанный способ определения биологической ценности белков удобен тем, что позволяет использовать данные аминокислотного анализа.
Более точные результаты по оценке биологической ценности белков дают методы, основанные на использовании живых организмов. Одним из таких методов является расчет показателя "эффективность белка", который выражается отношением увеличения массы животных к массе потреб-лённых кормовых белков. В этом случае биологическую ценность белков оценивают по интенсивности роста опытных животных.
Хороший источник достаточно полноценных белков – вегетативная масса растений (листья люцерны, клевера, сахарной свеклы), в сухом веществе которой содержится 15–25 % белковых веществ. Технология приготовления белковых концентратов из листьев растений включает из-мельчение растительной массы, отжим сока и его ферментацию, выделе-ние белкового коагулята и консервирование белково-витаминной пасты.
В результате переработки растительной массы обычно получают три вида продуктов: белковый коагулят, содержащий 15–22 % белков в расчете на сухую массу, из которого готовят белково-витаминную пасту; фермен-тированный сок, образующийся после отделения белкового коагулята и содержащий 1–3 % белков, 4–5 % усвояемых углеводов и 40–50 мг% каротина; остатки растительного материала (после отжатия сока) в виде жома, в сухом веществе которого содержится 12–17 % белков и 3–4 % сырого жира.
В ходе исследований аминокислотного состава белков древесных растений было установлено, что в белках листьев хвойных пород (хвои) по сравнению с принятыми кормовыми нормативами повышено содержание незаменимых аминокислот: лизина – на 16–41 %, треонина – на 16–39 %, валина – на 10–57 %, лейцина – 33–86 %, фенилаланина – на 30–41 %. В связи с этим разработаны технологии получения хвойной кормовой муки и белково-витаминного концентрата (БВК), содержащего 49 % белков, в которых концентрация лизина по сравнению с кормовыми нормативами повышена на 93 %. Кроме белков в коагуляте содержится примерно такой же комплекс витаминов, как и в БВК, получаемом из листьев травянистых растений.
Наряду с производством белковых концентратов в нашей стране и за рубежом разрабатывают и реализуют научные программы, связанные с созданием новых генотипов растений, отличающихся повышенным содер-жанием белков с улучшенным аминокислотным составом. Примером тому может служить создание высоколизиновых гибридов кукурузы, у которых уровень урожайности примерно такой же, как и у районированных сортов, однако в их зерновках накапливается больше белков с повышенным содер-жанием лизина (на 50–80 %) и триптофана (на 30–50 %).
Высоколизиновые гибриды кукурузы получены от скрещивания обычной кукурузы с генотипами, имеющими гены Опейк-2 и Флаури-2, которые вызывают изменение состава белков зерна: массовая доля спир-торастворимых белков – зеинов, имеющих низкую биологическую цен-ность, снижается в 2,5–3 раза, а доля других белков (альбуминов, глобулинов и глютелинов) возрастает. В результате таких изменений бел-кового комплекса зерна биологическая ценность суммарного белка зерна значительно повышается. Использование зерна высоколизиновой кукурузы для кормления животных позволяет существенно повысить их продуктив-ность и сократить затраты кормовых белков на создание одной единицы животноводческой продукции на 20–25 %.
Во многих лабораториях селекционно-генетического профиля прово-дят работу по улучшению аминокислотного состава белков зерна ячменя на основе скрещиваний с высоколизиновыми формами Хайпроли и Ризо 1508, а также поиск генетических источников высокого содержания белков с улучшенным аминокислотным составом для пшеницы, проса, тритикале и других зерновых злаковых культур.
Определенные надежды возлагают на новые методы создания цен-ных генотипов растений, основанные на использовании достижений гене-тической и клеточной инженерии. Так, путем направленного мутагенеза в ген спирторастворимого белка зерна кукурузы α-зеина были введены дополнительные кодоны лизина и в результате включения такого модифи-цированного гена в генотип кукурузы получены линии с повышенным содержанием лизина в белках зерна.
В 1986 г. Дж. М. Джейнс с помощью ферментов синтезировал ген, кодирующий структуру белка с высокой концентрацией незаменимых аминокислот (80 %). В настоящее время разрабатываются способы вве-дения этого гена в генотипы злаковых культур.
Вопросы для самоконтроля
1. Каковы функции белков в живых организмах и сколько белков содержится в различных растительных продуктах? 2. Каковы основные положения полипептидной теории стоения белков? 3. Чем отличаются белки от пептидов? 4. Какие имеются све-дения о первичной структуре белков? 5. Как формируется вторичная, третичная и чет-вертичная структура белков? 6. Каковы особенности структуры олигомерных белков? 7. Чем отличаются нативная и денатурированная конформации белковых молекул? 8. Какие известны катализаторы формирования пространственной структуры белковых полипептидов? 9. Как происходит денатурация белков? 10. Как определяются размеры и форма белковых молекул и какие имеются сведения об этих показателях? 11. Какие методы применяют для изучения физико-химических свойств белков? 12. Каковы особенности методов выделения белков и разделения белковых смесей? 13. Какие принципы положены в основу классификации белков и какие известны разновидности белковых групп в соответствии с современной классификацией? 14. Как определяют аминокислотный состав белков? 15. Как различаются растительные белки по содер-жанию аминокислот? 16. Как определяют биологическую ценность белков? 17. Какие белковые препараты используют для балансирования растительных кормов по содержанию белков и незаменимых аминокислот? 18. Какие имеются сведения о биологической ценности растительных белков? 19. Какие разрабатываются методы создания генотипов растений с повышенным содержанием незаменимых аминокислот в белках? 20. Каково содержание белков в вегетативных органах и семенах сельскохозяй-ственных растений?
