
- •Глава 1 вода основа жизни на земле
- •1.1.Вода, ее происхождение и количество на земном шаре.
- •Мировые запасы воды
- •Периоды возобновления запасов воды на земле
- •1.2.Круговорот воды на земном шаре.
- •Характеристики круговорота воды для материков земного шара
- •1.3.Физические и химические свойства воды.
- •Глава 2 состав и показатели качества природных и сточных вод
- •2.1.Дисперсные водные системы и их классификация.
- •2.2.Свойства коллоидных растворов, их устойчивость и разрушение.
- •2.3.Состав природных вод.
- •2.4.Показатели качества природных вод.
- •Степень жесткости природных вод
- •2.5.Оценка качества поверхностных вод
- •Общие требования к составу и свойствам воды
- •Критерии оценки загрязненности поверхностных вод
- •Эколого-санитарная классификация качества поверхностных вод
- •Классификация загрязненности воды водных объектов
- •Ориентировочная шкала оценки загрязнения водных систем
- •2.6.Контроль загрязнения поверхностных вод
- •Расположение и категория пунктов наблюдения на водных объектах
- •Состав программ наблюдений за качеством поверхностных вод
- •2.7.Характеристика сточных вод.
- •Состав сточных вод машиностроительного завода
- •Состав сточных вод цехов приборостроительного завода
- •Состав сточных вод металлопокрытий автомобильных заводов
- •Классификация примесей воды по их фазово-дисперсному состоянию и процессы, используемые для их удаления. (по л.А.Кульскому)
- •2.8.Показатели качества сточных вод
- •2.9.Оценка качества сточных вод.
- •Характеристика агрессивности производственных сточных вод
- •Глава 3 Современное производство и загрязнение гидросферы
- •3.1.Понятие о системах водообеспечения и водоотведения промышленных предприятий.
- •Укрупненные нормы водоотведения
- •3.2.Система канализации промышленных предприятий.
- •Методы обезвреживания производственных сточных вод (по с. В. Яковлеву)
- •3.3.Условия выпуска производственных сточных вод в городскую канализацию.
- •3.4.Определение необходимой степени очистки производственных сточных вод
- •3.4.1.Расчет необходимой степени очистки сточных вод по концентрации взвешенных веществ.
- •3.4.2.Расчет допустимого состава сточных вод по концентрации растворенных вредных веществ.
- •3.4.3.Расчет необходимой степени очистки по изменению активной реакции воды.
- •Глава 4 Механические методы очистки сточных вод
- •4.1.Основная схема механической очистки производственных сточных вод.
- •4.2.Решетки для процеживания.
- •Решетка из металлических стержней; 2 - механизм для снятия задержанных решеткой
- •4.3.Песколовки
- •4.4.Усреднители.
- •4.5.Устройства для выделения из сточных вод нерастворимых примесей под действием гравитационных сил.
- •4.5.1.Теоретические основы процессов осаждения твердых частиц в вязкой среде.
- •4.5.2.Первичные отстойники.
- •4.5.3.Прочие устройства для механической очистки воды.
- •4.6. Устройства для выделения из сточных вод нерастворимых примесей под действием центробежных сил
- •4.6.1.Открытые и напорные гидроциклоны.
- •Числовые значения коэффициентов и констант m в формуле
- •Сточная вода
- •4.6.2.Центрифуги.
- •4.7.Фильтрование.
- •4.7.1.Фильтрование через фильтрующие перегородки.
- •4.7.2. Сетчатые барабанные фильтры.
- •4.7.3. Фильтры с зернистой загрузкой.
- •Основные размеры, мм, напорных вертикальных фильтров
- •4.7.4.Магнитные фильтры.
- •4.7.5.. Фильтрование эмульгированных веществ
- •Глава 5 Химические методы очистки сточных вод
- •5.1.Нейтрализация
- •Условия применения способов нейтрализации кислых сточных вод
- •5.1.1.Нейтрализация смешением.
- •5.1.2.Реагентная нейтрализация.
- •Расход реагентов, кг/кг, для нейтрализации 100%-ных кислот и щелочей
- •5.1.3.Нейтрализация кислых сточных вод путем их фильтрования через нейтрализующие материалы.
- •5.1.4.Нейтрализация щелочных сточных вод кислыми газами.
- •5.2.Окислительный метод очистки сточных вод.
- •5.2.1.Окисление реагентами, содержащими активный хлор.
- •Состав цианосодержащих сточных вод гальванических цехов автозаводов России. (по д.Н.Смирнову и в.Е.Генкину).
- •5.2.2.Окисление пероксидом водорода.
- •5.2.3.Окисление кислородом воздуха.
- •5.2.4.Озонирование.
- •Технические характеристики отечественных озонаторов трубчатого типа
- •5.2.5.Окисление перманганатом калия.
- •5.2.6.Радиационное окисление.
- •5.3.Очистка восстановлением.
- •5.4.Реагентные методы выделения загрязняющих веществ в виде малорастворимых и нерастворимых соединений.
- •Значения констант произведения растворимости при комнатной температуре
- •Расход реагентов, кг/кг, требуемых для удаления металлов
- •Величины рН осаждения гидроксидов металлов
- •Растворимость сульфидов некоторых металлов в зависимости от рН раствора при комнатной температуре.
- •Глава 6 Физико-химические методы очистки сточных вод
- •6.1.Коагуляция и флокуляция.
- •6.1.1.Основные характеристики дисперсных систем.
- •Основные типы дисперсных систем
- •6.1.2.Теоретические основы коагуляции коллоидных примесей, содержащихся в сточных водах.
- •6.1.2.1.Понятие о строении двойного электрического слоя.
- •6.1.2.2.Устойчивость дисперсных систем
- •6.1.3. Понятие о гетерокоагуляции и применяемых коагулянтах .
- •Оптимальные величины рН при коагуляционной очистке
- •6.1.4. Флокуляция.
- •6.1.5. Технология коагуляционной и флокуляционной очистки сточных вод и используемое оборудование.
- •Зависимость скорости потока сточной воды в осветлителе от концентрации взвешенных веществ.
- •6.2. Сорбция.
- •Конструктивные и технологические показатели сорбционных фильтров с активированным углем.
- •6.3.Флотация.
- •6.3.1.Флотация с выделением воздуха из раствора.
- •6.3.2.Напорная флотация.
- •6.3.3.Флотация с механическим диспергированием воздуха.
- •6.3.4.Флотация с подачей воздуха через пористые материалы.
- •Скорость подъема пузырьков в воде при 20 оС
- •6.3.5.Очистка методом пенного фракционирования (пенной сепарацией)
- •6.3.6.Понятие о химической, биологической и ионной флотации.
- •6.4. Экстракция.
- •Значения коэффициента распределения kp некоторых загрязняющих веществ между экстрагентами и водой при комнатной температуре.
- •Основные экстрагенты, предназначенные для выделения из сточных вод тяжелых цветных металлов и железа.
- •6.5.Ионный обмен.
- •Характеристика основных марок отечественных катионитов, выпускаемых для нужд водоподготовки (по а.И.Родионову с соавт.).
- •Характеристика основных марок отечественных анионитов, выпускаемых для нужд водоподготовки (по а.И.Родионову с соавт.)
- •6.5.1. Понятие об ионообменном равновесии.
- •6.5.2.Понятие о регенерации ионитов.
- •6.5.3. Технологические схемы ионообменной очистки сточных вод и установки для их реализации.
- •VIII - обезвоженный осадок на полигон.
- •6.6.Электрохимическая очистка сточных вод.
- •6.6.1. Классификация методов электрохимической очистки сточных вод.
- •6.6.2. Теоретические основы электрохимических процессов.
- •6.6.2.1.Электродные потенциалы.
- •6.6.2.2.Понятие об окислительно-восстановительном равновесии
- •6.6.2.3. Массоперенос вещества и скорость электрохимической реакции.
- •6.6.2.4. Поляризационные явления в электрохимических реакциях.
- •6.6.2.5.Кинетические закономерности основных электродных процессов, протекающих при очистке сточных вод.
- •6.6.2.6.Понятие о редокси -процессах (электрохимическом восстановлении и окислении).
- •6.6.3. Применение электрохимических методов при очистке сточных вод.
- •6.6.3.1. Анодное окисление и катодное восстановление.
- •6.6.3.2. Электрокоагуляция.
- •6.6.3.3.Электрофлотация.
- •6.6.3.4.Электродиализ.
- •Основные свойства ионитовых мембран.
- •6.6.3.5.Гальванокоагуляционная очистка сточных вод.
- •Результаты опытно-промышленных испытаний по гальванокоагуляционной очистке сточных вод
- •6.7. Применение методов обратного осмоса и ультрафильтрации для очистки сточных вод.
- •6.7.1.Понятие о мембранных процессах.
- •6.7.2.Классификация полупроницаемых мембран.
- •6.7.3.Использования установки обратного осмоса для очистки хромсодержащих сточных вод.
- •6.8.Термическая обработка сточных вод.
- •6.8.1.Очистка сточных вод с выделением растворенных веществ (концентрирование сточных вод).
- •6.8.2.Выделение растворенных веществ из концентрированных растворов.
- •6.8.3.Термоокислительные методы обезвреживания сточных вод.
- •Глава 7 Биологическая очистка сточных вод
- •7.1.Общие положения.
- •7.2.Влияние различных технологических факторов на эффективность процессов биологической очистки
- •7.3.Естественные и искусственные методы биологической очистки.
- •7.3.1.Сооружения почвенной очистки и биологические пруды.
- •Продолжительность очистки сточных вод в биологических прудах
- •7.3.2.Биофильтры.
- •7.3.3.Аэротенки.
- •7.3.4.Окситенки.
- •7.4.Использование биологических методов очистки сточных вод от тяжелых металлов.
- •7.5.Понятие о глубокой очистке (доочистке) производственных сточных вод
- •Глава 8 Обработка осадков производственных сточных вод
- •8.1.Состав и свойства осадков.
- •Химический состав минеральной части осадков
- •Удельное сопротивление осадков сточных вод
- •Зависимость удельного сопротивления сырых осадков первичных источников от характерных особенностей сточных вод
- •8.2.Основные процессы, применяемые для обработки осадков производственных сточных вод
- •8.3.Уплотнение осадков.
- •8.3.1.Гравитационное уплотнение осадков.
- •8.3.2.Флотационное уплотнение осадков.
- •8.3.3.Центробежное уплотнение осадков.
- •Техническая характеристика серийных центрифуг
- •Оптимальный режим работы центрифуги огш 502 к-4
- •Значения критериев гидродинамического подобия при разделении активного ила
- •8.4. Анаэробное (метановое) сбраживание осадков
- •8.4.1. Понятие об анаэробном сбраживании.
- •8.4.2. Технологические схемы анаэробного сбраживания осадков.
- •1 Ступени, 6 - метатенк п ступени, 7 - выгрузка сброженного осадка.
- •Требуемые объемы и число метатенков для станций аэрации различной производительности
- •8.4.3.Основы расчета метатенков.
- •8.5.Аэробная стабилизация осадков.
- •8.6.Кондиционирование осадков.
- •8.6.1.Реагентная обработка .
- •8.6.3. Жидкофазное окисление (метод Циммермана).
- •8.6.4. Замораживание и оттаивание.
- •8.7. Обезвоживание осадков.
- •8.7.1. Сушка осадков на иловых площадках.
- •8.7.2. Фильтрование.
- •Технические характеристики отечественных барабанных вакуум-фильтров
- •Показатели работы барабанных вакуум-фильтров
- •Показатели работы фильтр-прессов
- •8.7.3. Центрифугирование и сепарирование.
- •Технологические параметры работы осадительной центрифуги
- •8.8. Термическая сушка осадков.
- •8.8.1. Основные понятия.
- •8.8.2. Оборудование для сушки осадков.
- •8.9. Термические методы обезвреживания осадков.
- •8.9.1. Основные положения.
- •8.9.2. Основное оборудование для термического обезвреживания осадков.
- •Сравнительная характеристика показателей работы печей при термическом обезвреживании осадков (по с.В.Яковлеву).
- •Глава 9 Очистка сточных вод от радиоактивных загрязнений
- •Пдк и содержание отдельных компонентов в шахтных водах
- •Пдк и содержание компонентов жидкой фазы отвальной рудной пульпы, г/л.
- •Нормированные количества жидких радиоактивных отходов.
- •Ориентировочная характеристика отходов аэс.
- •Классификация жидких радиоактивных отходов.
- •Количество твердых отходов низкой и средней активности, образующихся в год при эксплуатации аэс мощностью 100 мВт.
- •Реакции образования радионуклидов - продуктов коррозии.
- •Количества радиоактивных отходов, образующихся на аэс
6.6.2.6.Понятие о редокси -процессах (электрохимическом восстановлении и окислении).
Указанные процессы используют для очистки сточных вод от органических загрязнений.
Наиболее часто используют реакции катодного восстановления, примером которого может служить реакция электрохимического восстановления нитробензола и аминобензола, протекающая по следующей схеме:

( 6.0)
Образующиеся аминосоединения значительно легче окисляются, чем исходные нитросоединения. На практике сточные воды, содержащие нитросоединения, подвергают обработке сначала в катодной камере электровосстановлением, а затем в анодной, где происходит окисление аминосоединений.
Метод электрохимического окисления может быть использован для очистки сточных вод от формальдегида по следующей реакции:
HCHO + O CO2 + H2 + 2e- ( 6.0)
Указанный метод анодного окисления может быть использован также для очистки сточных вод от полипропиленгликоля,фенантрена и др.
6.6.3. Применение электрохимических методов при очистке сточных вод.
Наибольшее распространение в практике очистки сточных вод получили методы анодного окисления и катодного восстановления, электрокоагуляционный метод, электрофлотация, электродиализ. В ряде случаев используют и другие методы электрохимической очистки сточных вод, представленные в классификации на рис 4.27
6.6.3.1. Анодное окисление и катодное восстановление.
Процессы электрохимического окисления-восстановления проводят в электролизерах, принципиальная схема которого представлена на рис.6.29.
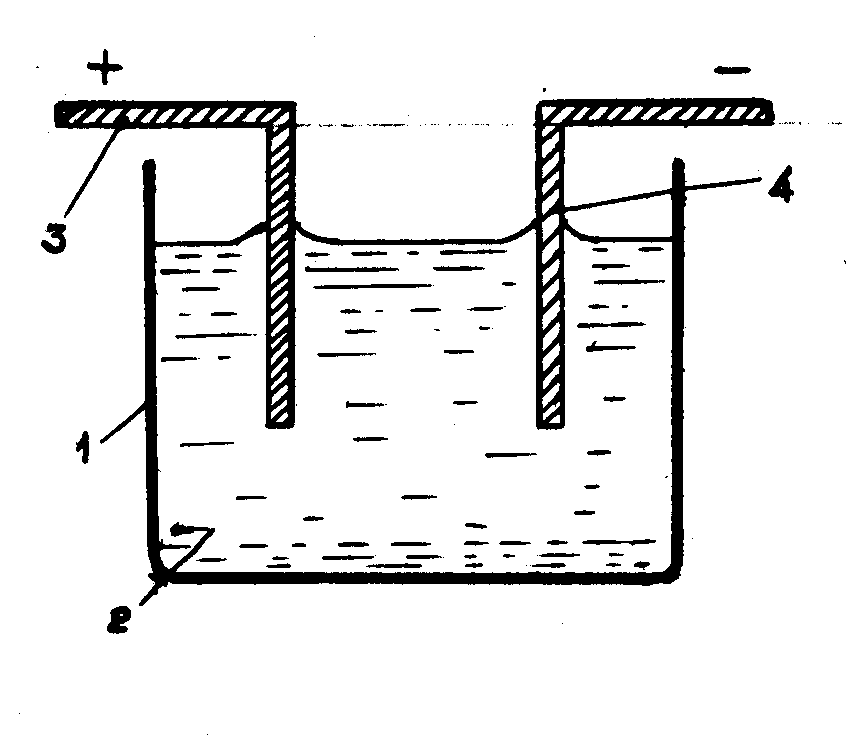
Рис. 6.58. Принципиальная схема электролизера.
1 - корпус, 2 - раствор электролита (обрабатываемая сточная вода), 3 - анод, 4 - катод.
При прохождении электрического тока через раствор происходит электролиз, на электродах образуются продукты окисления-восстановления. На положительном электроде (аноде) протекает окисление, а на отрицательном (катоде) - восстановление. Таким образом, анод является электрохимическим окислителем, а катод - электрохимическим восстановителем. В ряде случаев катодное и анодное пространство разделяют пористыми диафрагмами. Их значение - не допускать смешения растворов, препятствовать диффузии, переносу нерастворимых частиц, не затрудняя при этом переноса ионов.
Количественные зависимости, наблюдаемые при электролизе описываются законами М.Фарадея.
В процессах анодного окисления, вещества, находящиеся в сточных водах либо полностью распадаются (с образованием СО2, NH3 и Н2О), либо образуются менее токсичные вещества, которые удаляют другими методами.
Таким методом сточные воды очищают от цианидов, роданидов, нитросоединений, формальдегида, сульфидов, меркаптанов и ряда других веществ.
В качестве анодов используют следующие электрохимически нерастворимые материалы: графит (С), магнетит (Fe3O4), свинец и его соединения (Pb, PbO2 ), кремниевые сплавы и др.
Рассмотрим наиболее распространенные примеры использования метода анодного окисления.
Электохимическая очистка сточных вод от циклидов заключается в их обработке в открытых безинфрагменных электролазерах непрерывного или периодического действия (рис.6.28). Используются графитированные аноды, либо аноды из магнетита и диоксида свинца (на титановой основе). Катоды изготовлены из легированной стали.
Указанным методом обрабатываются сточные воды и растворы различных производств, содержащие цианиды и, в первую очередь, стоки гальванических цехов и участков, причем данный способ наиболее экономичен при концентрации цианидов 200 мг/л.
При электролизе щелочных сточных вод (обычно их рН лежит в пределах 8-12), содержащих цианистые соединения, происходит анодное окисление СN- ионов, а также комплексных анионов, содержащих CN- -группы ([Сu(СN3)]2-, [Zn(СN)4]2-, [Сd(CN)4]2- и др.) с образованием цианат-ионов:
СN- + 2ОН- - 2е- СNO- + Н2О ( 6.0)
[Cu(СN)3]2- + 6ОН- - 6е- Cu+ + 3СNO- + 3Н2О ( 6.0)
Образующиеся по реакциям (5.108), (5.109) цианит-ионы (СNO- ) частично окисляются на аноде с образованием нетоксичных газообразных продуктов:
2СNO- + 4ОН- - 6е- СО2 + N2 + 2Н2О ( 6.0)
На катоде происходит разряд Н+ - ионов с образованием газообразного водорода, а также разряд ионов Сu+ , Zn2+ , Сd2+ , образующихся при диссоциации комплексных ионов, содержащих СN - группы [Сu(CN)3]2- , [Zn(СN)4]2- и др.
Электролиз сточных вод проводят при анодной плотности тока 0,5-2 А/дм2 . К сточным водам добавляют хлорид натрия в концентрации 5-10г/л. При этом цианиды дополнительно окисляются хлором, выделяющимся на аноде вследствие электрохимического разложения хлористого натрия:
2Сl- - е- Сl2 ( 6.0)
Сl2 + СN- +2ОН- СNO- + 2 Cl- + H2O ( 6.0)
Степень очистки сточных вод от цианидов приближается к 100%. Кроме того, утилизируется до 80% общего количества металлов, выделяемых в виде катодных осадков. Остальные 20% от общего количества металлов удаляется в виде гидрооксидов. рН процесса рекомендуется поддерживать в пределах 8-9.

Рис. 6.59 Схема установки для электрохимического окисления цианидов.
1 - усреднитель, 2 - бак для приготовления раствора хлорида натрия, 3 - электролизер, 4 - выпрямитель переменного тока.
При анодном окислении роданидов они разрушаются по следующей схеме:
СNS- + 10 ОН- - 8е- СNO- + SO42- + 5H2O ( 6.0)
Примеры реакции анодного окисления органического соединения (формальдегида) представлены на с... (реакция 5.107).
Рассмотрим примеры катодного восстановления металлов. Их используют для выделения из сточных вод следующих ионов тяжелых металлов. Как уже указывалось выше, общая схема восстановления катодных металлов описывается реакцией (5.93).
Укажем, что очистка сточных вод от ионов Нg2+ , Рb2+ , Сd2+ , Сu2+ проводят в кислой среде на катодах из смеси угольного и сернистого порошков при плотности тока до 2,5 А/дм2 . Рассмотренные катионы осаждают в виде сульфидов и бисульфидов.
Рассмотрим также реакцию электрохимической очистки сточных вод от NH4 NO3 . При проведении электролиза используют графитовый катод, на котором протекает следующая реакция:
NH4NO3 + 2H+ + 2e- NH4NO2 + H2O ( 6.0)
Нитрит аммония при нагревании разлагается с выделением азота:
NH4NO2 N2 + 2H2O ( 6.0)
