
- •Глава 1 вода основа жизни на земле
- •1.1.Вода, ее происхождение и количество на земном шаре.
- •Мировые запасы воды
- •Периоды возобновления запасов воды на земле
- •1.2.Круговорот воды на земном шаре.
- •Характеристики круговорота воды для материков земного шара
- •1.3.Физические и химические свойства воды.
- •Глава 2 состав и показатели качества природных и сточных вод
- •2.1.Дисперсные водные системы и их классификация.
- •2.2.Свойства коллоидных растворов, их устойчивость и разрушение.
- •2.3.Состав природных вод.
- •2.4.Показатели качества природных вод.
- •Степень жесткости природных вод
- •2.5.Оценка качества поверхностных вод
- •Общие требования к составу и свойствам воды
- •Критерии оценки загрязненности поверхностных вод
- •Эколого-санитарная классификация качества поверхностных вод
- •Классификация загрязненности воды водных объектов
- •Ориентировочная шкала оценки загрязнения водных систем
- •2.6.Контроль загрязнения поверхностных вод
- •Расположение и категория пунктов наблюдения на водных объектах
- •Состав программ наблюдений за качеством поверхностных вод
- •2.7.Характеристика сточных вод.
- •Состав сточных вод машиностроительного завода
- •Состав сточных вод цехов приборостроительного завода
- •Состав сточных вод металлопокрытий автомобильных заводов
- •Классификация примесей воды по их фазово-дисперсному состоянию и процессы, используемые для их удаления. (по л.А.Кульскому)
- •2.8.Показатели качества сточных вод
- •2.9.Оценка качества сточных вод.
- •Характеристика агрессивности производственных сточных вод
- •Глава 3 Современное производство и загрязнение гидросферы
- •3.1.Понятие о системах водообеспечения и водоотведения промышленных предприятий.
- •Укрупненные нормы водоотведения
- •3.2.Система канализации промышленных предприятий.
- •Методы обезвреживания производственных сточных вод (по с. В. Яковлеву)
- •3.3.Условия выпуска производственных сточных вод в городскую канализацию.
- •3.4.Определение необходимой степени очистки производственных сточных вод
- •3.4.1.Расчет необходимой степени очистки сточных вод по концентрации взвешенных веществ.
- •3.4.2.Расчет допустимого состава сточных вод по концентрации растворенных вредных веществ.
- •3.4.3.Расчет необходимой степени очистки по изменению активной реакции воды.
- •Глава 4 Механические методы очистки сточных вод
- •4.1.Основная схема механической очистки производственных сточных вод.
- •4.2.Решетки для процеживания.
- •Решетка из металлических стержней; 2 - механизм для снятия задержанных решеткой
- •4.3.Песколовки
- •4.4.Усреднители.
- •4.5.Устройства для выделения из сточных вод нерастворимых примесей под действием гравитационных сил.
- •4.5.1.Теоретические основы процессов осаждения твердых частиц в вязкой среде.
- •4.5.2.Первичные отстойники.
- •4.5.3.Прочие устройства для механической очистки воды.
- •4.6. Устройства для выделения из сточных вод нерастворимых примесей под действием центробежных сил
- •4.6.1.Открытые и напорные гидроциклоны.
- •Числовые значения коэффициентов и констант m в формуле
- •Сточная вода
- •4.6.2.Центрифуги.
- •4.7.Фильтрование.
- •4.7.1.Фильтрование через фильтрующие перегородки.
- •4.7.2. Сетчатые барабанные фильтры.
- •4.7.3. Фильтры с зернистой загрузкой.
- •Основные размеры, мм, напорных вертикальных фильтров
- •4.7.4.Магнитные фильтры.
- •4.7.5.. Фильтрование эмульгированных веществ
- •Глава 5 Химические методы очистки сточных вод
- •5.1.Нейтрализация
- •Условия применения способов нейтрализации кислых сточных вод
- •5.1.1.Нейтрализация смешением.
- •5.1.2.Реагентная нейтрализация.
- •Расход реагентов, кг/кг, для нейтрализации 100%-ных кислот и щелочей
- •5.1.3.Нейтрализация кислых сточных вод путем их фильтрования через нейтрализующие материалы.
- •5.1.4.Нейтрализация щелочных сточных вод кислыми газами.
- •5.2.Окислительный метод очистки сточных вод.
- •5.2.1.Окисление реагентами, содержащими активный хлор.
- •Состав цианосодержащих сточных вод гальванических цехов автозаводов России. (по д.Н.Смирнову и в.Е.Генкину).
- •5.2.2.Окисление пероксидом водорода.
- •5.2.3.Окисление кислородом воздуха.
- •5.2.4.Озонирование.
- •Технические характеристики отечественных озонаторов трубчатого типа
- •5.2.5.Окисление перманганатом калия.
- •5.2.6.Радиационное окисление.
- •5.3.Очистка восстановлением.
- •5.4.Реагентные методы выделения загрязняющих веществ в виде малорастворимых и нерастворимых соединений.
- •Значения констант произведения растворимости при комнатной температуре
- •Расход реагентов, кг/кг, требуемых для удаления металлов
- •Величины рН осаждения гидроксидов металлов
- •Растворимость сульфидов некоторых металлов в зависимости от рН раствора при комнатной температуре.
- •Глава 6 Физико-химические методы очистки сточных вод
- •6.1.Коагуляция и флокуляция.
- •6.1.1.Основные характеристики дисперсных систем.
- •Основные типы дисперсных систем
- •6.1.2.Теоретические основы коагуляции коллоидных примесей, содержащихся в сточных водах.
- •6.1.2.1.Понятие о строении двойного электрического слоя.
- •6.1.2.2.Устойчивость дисперсных систем
- •6.1.3. Понятие о гетерокоагуляции и применяемых коагулянтах .
- •Оптимальные величины рН при коагуляционной очистке
- •6.1.4. Флокуляция.
- •6.1.5. Технология коагуляционной и флокуляционной очистки сточных вод и используемое оборудование.
- •Зависимость скорости потока сточной воды в осветлителе от концентрации взвешенных веществ.
- •6.2. Сорбция.
- •Конструктивные и технологические показатели сорбционных фильтров с активированным углем.
- •6.3.Флотация.
- •6.3.1.Флотация с выделением воздуха из раствора.
- •6.3.2.Напорная флотация.
- •6.3.3.Флотация с механическим диспергированием воздуха.
- •6.3.4.Флотация с подачей воздуха через пористые материалы.
- •Скорость подъема пузырьков в воде при 20 оС
- •6.3.5.Очистка методом пенного фракционирования (пенной сепарацией)
- •6.3.6.Понятие о химической, биологической и ионной флотации.
- •6.4. Экстракция.
- •Значения коэффициента распределения kp некоторых загрязняющих веществ между экстрагентами и водой при комнатной температуре.
- •Основные экстрагенты, предназначенные для выделения из сточных вод тяжелых цветных металлов и железа.
- •6.5.Ионный обмен.
- •Характеристика основных марок отечественных катионитов, выпускаемых для нужд водоподготовки (по а.И.Родионову с соавт.).
- •Характеристика основных марок отечественных анионитов, выпускаемых для нужд водоподготовки (по а.И.Родионову с соавт.)
- •6.5.1. Понятие об ионообменном равновесии.
- •6.5.2.Понятие о регенерации ионитов.
- •6.5.3. Технологические схемы ионообменной очистки сточных вод и установки для их реализации.
- •VIII - обезвоженный осадок на полигон.
- •6.6.Электрохимическая очистка сточных вод.
- •6.6.1. Классификация методов электрохимической очистки сточных вод.
- •6.6.2. Теоретические основы электрохимических процессов.
- •6.6.2.1.Электродные потенциалы.
- •6.6.2.2.Понятие об окислительно-восстановительном равновесии
- •6.6.2.3. Массоперенос вещества и скорость электрохимической реакции.
- •6.6.2.4. Поляризационные явления в электрохимических реакциях.
- •6.6.2.5.Кинетические закономерности основных электродных процессов, протекающих при очистке сточных вод.
- •6.6.2.6.Понятие о редокси -процессах (электрохимическом восстановлении и окислении).
- •6.6.3. Применение электрохимических методов при очистке сточных вод.
- •6.6.3.1. Анодное окисление и катодное восстановление.
- •6.6.3.2. Электрокоагуляция.
- •6.6.3.3.Электрофлотация.
- •6.6.3.4.Электродиализ.
- •Основные свойства ионитовых мембран.
- •6.6.3.5.Гальванокоагуляционная очистка сточных вод.
- •Результаты опытно-промышленных испытаний по гальванокоагуляционной очистке сточных вод
- •6.7. Применение методов обратного осмоса и ультрафильтрации для очистки сточных вод.
- •6.7.1.Понятие о мембранных процессах.
- •6.7.2.Классификация полупроницаемых мембран.
- •6.7.3.Использования установки обратного осмоса для очистки хромсодержащих сточных вод.
- •6.8.Термическая обработка сточных вод.
- •6.8.1.Очистка сточных вод с выделением растворенных веществ (концентрирование сточных вод).
- •6.8.2.Выделение растворенных веществ из концентрированных растворов.
- •6.8.3.Термоокислительные методы обезвреживания сточных вод.
- •Глава 7 Биологическая очистка сточных вод
- •7.1.Общие положения.
- •7.2.Влияние различных технологических факторов на эффективность процессов биологической очистки
- •7.3.Естественные и искусственные методы биологической очистки.
- •7.3.1.Сооружения почвенной очистки и биологические пруды.
- •Продолжительность очистки сточных вод в биологических прудах
- •7.3.2.Биофильтры.
- •7.3.3.Аэротенки.
- •7.3.4.Окситенки.
- •7.4.Использование биологических методов очистки сточных вод от тяжелых металлов.
- •7.5.Понятие о глубокой очистке (доочистке) производственных сточных вод
- •Глава 8 Обработка осадков производственных сточных вод
- •8.1.Состав и свойства осадков.
- •Химический состав минеральной части осадков
- •Удельное сопротивление осадков сточных вод
- •Зависимость удельного сопротивления сырых осадков первичных источников от характерных особенностей сточных вод
- •8.2.Основные процессы, применяемые для обработки осадков производственных сточных вод
- •8.3.Уплотнение осадков.
- •8.3.1.Гравитационное уплотнение осадков.
- •8.3.2.Флотационное уплотнение осадков.
- •8.3.3.Центробежное уплотнение осадков.
- •Техническая характеристика серийных центрифуг
- •Оптимальный режим работы центрифуги огш 502 к-4
- •Значения критериев гидродинамического подобия при разделении активного ила
- •8.4. Анаэробное (метановое) сбраживание осадков
- •8.4.1. Понятие об анаэробном сбраживании.
- •8.4.2. Технологические схемы анаэробного сбраживания осадков.
- •1 Ступени, 6 - метатенк п ступени, 7 - выгрузка сброженного осадка.
- •Требуемые объемы и число метатенков для станций аэрации различной производительности
- •8.4.3.Основы расчета метатенков.
- •8.5.Аэробная стабилизация осадков.
- •8.6.Кондиционирование осадков.
- •8.6.1.Реагентная обработка .
- •8.6.3. Жидкофазное окисление (метод Циммермана).
- •8.6.4. Замораживание и оттаивание.
- •8.7. Обезвоживание осадков.
- •8.7.1. Сушка осадков на иловых площадках.
- •8.7.2. Фильтрование.
- •Технические характеристики отечественных барабанных вакуум-фильтров
- •Показатели работы барабанных вакуум-фильтров
- •Показатели работы фильтр-прессов
- •8.7.3. Центрифугирование и сепарирование.
- •Технологические параметры работы осадительной центрифуги
- •8.8. Термическая сушка осадков.
- •8.8.1. Основные понятия.
- •8.8.2. Оборудование для сушки осадков.
- •8.9. Термические методы обезвреживания осадков.
- •8.9.1. Основные положения.
- •8.9.2. Основное оборудование для термического обезвреживания осадков.
- •Сравнительная характеристика показателей работы печей при термическом обезвреживании осадков (по с.В.Яковлеву).
- •Глава 9 Очистка сточных вод от радиоактивных загрязнений
- •Пдк и содержание отдельных компонентов в шахтных водах
- •Пдк и содержание компонентов жидкой фазы отвальной рудной пульпы, г/л.
- •Нормированные количества жидких радиоактивных отходов.
- •Ориентировочная характеристика отходов аэс.
- •Классификация жидких радиоактивных отходов.
- •Количество твердых отходов низкой и средней активности, образующихся в год при эксплуатации аэс мощностью 100 мВт.
- •Реакции образования радионуклидов - продуктов коррозии.
- •Количества радиоактивных отходов, образующихся на аэс
6.6.2. Теоретические основы электрохимических процессов.
6.6.2.1.Электродные потенциалы.
Протекание электрохимического процесса связано с обменом заряженными частицами между двумя фазами, у которых происходит перераспределение электрических потенциалов и, следовательно, возникает скачок электрического потенциала на границе раздела фаз. Если взять в качестве примера отрицательно заряженный электрод, то у его поверхности возникает обкладка из положительно заряженных ионов и, следовательно, скачок электрического потенциала, т.е. образуется электрический слой (рис.6.28)

Рис. 6.57Рaспределение положительных ионов (а) и скачка потенциала (б) у отрицательно заряженного электрода. ( - изменение потенциала в плотной части ДЭС, 1 - изменение потенциала в диффузной части ДЭС, a - абсолютный потенциал анода).
Как уже указывалось в разделе «Коагуляция и флокуляция», в реальных условиях под влиянием теплового воздействия и взаимного отталкивания ионов, ДЭС имеет размытое (диффузное) строение, общая толщина которого o складывается из толщины плотной части и толщины Д размытой части: o = +Д . Величина Д зависит от природы и особенно от концентрации электролита.
В чистой воде Д 10-8 м, а в концентрированных растворах Д очень мала и o ( равна радиусу сольватированных ионов плотной части порядка нескольких намометров).
Абсолютный скачок потенциала на границе "электрод-раствор" определяется уравнением Нернста:
![]() (
6.0)
(
6.0)
где
o - стандартный потенциал реакции, протекающей на электроде,
R - универсальная газовая постоянная,
Т - абсолютная температура,
Z - заряд иона,
F - постоянная Фарадея,
аox - активность окисленной формы иона металла,
аRed - активность восстановленной формы иона металла.
Представленное уравнение устанавливает зависимость равновесного потенциала электрода относительно раствора, в который он погружен, от температуры и активности окисленных и восстановленных форм вещества, участвующих в электрохимической реакции.
Абсолютный скачок потенциала нельзя измерить экспериментально а также рассчитать теоретически, т.к. неизвестны величины стандартных химических потенциалов и, следовательно, неизвестна o.
Поэтому для сопоставления равновесных величин потенциалов различных электродов их измеряют относительно стандартного водородного электрода(нормального) электрода, который изготовлен из платины, покрытой слоем губчатой платины и погружен в раствор кислоты с активностью ионов водорода аH+ = 1 при продувании через раствор пузырьков водорода под порциальным давлением рН2 = 0,1МП . Схема указанного электрода приводится практически в любом учебнике по электрохимии.
В соответствии с уравнением Нернста равновесный потенциал водородного электрода записывается следующим образом:
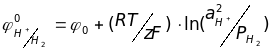 (
6.0)
(
6.0)
Как следует из представленного уравнения, потенциал водородного электрода определяется как активностью водородных ионов, так и парциальным давлением газообразного водорода PH2. Для стандартного потенциала водородного электрода oH+/H2=. Oтсюда следует, что потенциалом любого неизвестного электрода по водородной шкале является разность потенциалов между исследуемым и водородным электродом, находящимся в стандартных условиях.
Уравнение для равновесного потенциала металлического электрода, на котором протекает реакция Меz+ + Ze Ме записывается следующим образом:
 (
6.0)
(
6.0)
Так как активность чистого твердого вещества аМе при заданной температуре постоянна, то ее условно принимают равной единице и предыдущее уравнение принимает следующий вид:
![]() (
6.0)
(
6.0)
Из последнего уравнения следует, что потенциал металлического электрода, на котором установилось равновесие, зависит от активности только катионов металла. Ионы, непосредственно определяющие величину электродного потенциала, называются потенциалообразующими. Потенциал электрода является стандартным, когда активность потенциалопределяющих ионов в растворе равна единице.
Зная значение потенциалов различных электродных реакций, можно рассчитать с помощью уравнения Нернста равновесный потенциал электрода в растворе определенного состава.
Если стандартные потенциалы каких-либо реакций непосредственно определить не удается, то производят косвенное определение в соответствии с правилом Лютера:
![]() (
6.0)
(
6.0)
где Z и Zi - число электронов, участвующих соответственно в суммарной и промежуточной реакциях, 0сум и 0i - стандартный потенциал соответственно суммарной и промежуточных реакций.
