
- •Модуль 1. Естественнонаучные основы представлений об окружающей действительности
- •Тема 4. Основы современных концепций микро- и наномира Лабораторная работа № 4
- •4.1.1. Цели работы
- •4.2.1. Самостоятельная работа студентов
- •4.3.1. Средства и способы проведения эксперимента
- •4.4.1. Порядок выполнения работы
- •1.1. Теоретические предпосылки, позволяющие понять, как развивались представления об атоме
- •1.2. Теоретические предпосылки, позволяющие понять, как в настоящее время характеризуют состояния электронов в атоме
- •2.2. Теоретические предпосылки, позволяющие рассчитывать энергии
- •2.3. Теоретические предпосылки, позволяющие понять, чем важен озон для жизни на земле
- •4.1. Теоретические предпосылки, позволяющие понять связь строения атома от его положения в таблице Менделеева
- •5.1. Теоретические предпосылки, позволяющие понять, как образуются химические связи между элементами
- •6.1. Теоретические предпосылки, позволяющие понять, от чего зависят электрические свойства твердых тел
- •7.1. Теоретические предпосылки, позволяющие понять, от чего зависят электрические свойства полупроводниковых материалов, используемых в современной электронике и микроэлектронике
- •Распределение электронов по орбитам атомов
- •Ширина запрещенной зоны основных полупроводников
- •Концентрация собственных носителей заряда
- •Фрагмент периодической таблицы элементов д.И. Менделеева
- •Подвижности носителей заряда полупроводников
- •Подвижности носителей заряда полупроводников
- •7.2. Теоретические предпосылки
- •7.3. Теоретические предпосылки
- •8.1. Теоретические предпосылки, позволяющие понять, что такое аллотропные формы веществ
- •Итак, если подвести итого, то возможные применения нанотрубок следующие
- •9.1. Теоретические предпосылки
- •10.1. Теоретические предпосылки о супрамолекулярной химии
4.1. Теоретические предпосылки, позволяющие понять связь строения атома от его положения в таблице Менделеева
Современная квантовая теория строения атома позволяет объяснить зависимость химических свойств элементов от строения их атомов и положения в периодической системе элементов Менделеева (рис.12).
Вы
уже знаете, что каждому набору квантовых
чисел
![]() соответствует состояние с определенной
энергией и каждое состояние, согласно
принципу Паули, может быть занято одним
электроном.
соответствует состояние с определенной
энергией и каждое состояние, согласно
принципу Паули, может быть занято одним
электроном.
Период это горизонтальный ряд в таблице, именуемой периодической системой элементов Д. И. Менделеева, который начинается щелочным металлом (H, Li, Na, K, Rb, Cs, Fr) и оканчивается инертным элементом (He, Ne, Ar, Kr, Xe, Rn).
Так, атомы элементов водорода и гелия имеют один электронный слой – они находятся в первом периоде. Атомы элементов Li, Be, B, C, N, O, F, Ne имеют два электронных слоя – они находятся во втором периоде. Атомы восьми элементов от Na до Ar имеют три электронных слоя и т. д.
Группы периодической системы (вертикальные столбцы) содержат элементы, свойства которых подобны. Каждая группа состоит из двух подгрупп: главной (А) и побочной (В).
В атомах элементов каждого периода заполняется новый электронный слой. Число электронов во внешнем слое атомов всех элементов не больше восьми.
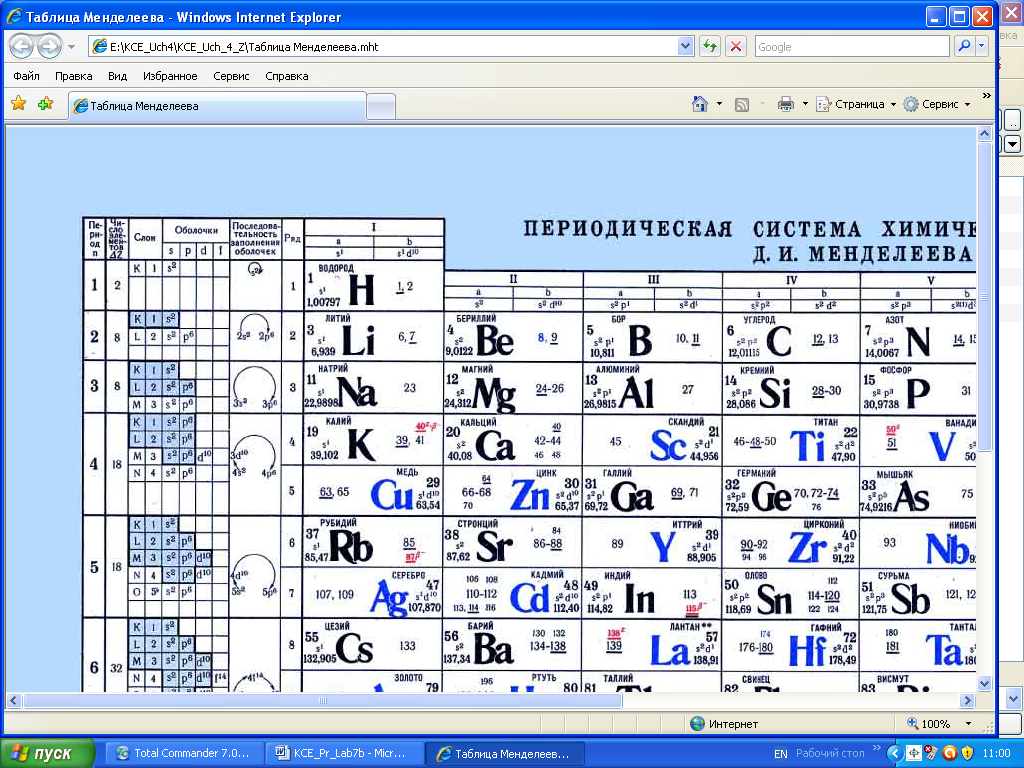
Рис. 12. Фрагмент периодической системы элементов Менделеева, который позволяет понять зависимость химических свойств элементов от положения и строения их атомов
Элементы, у которых заполняются s-орбитали последнего слоя, называют s-элементами (подгрупп IA и IIA). Элементы, у которых заполняются р-орбитали внешнего слоя, называются р- элементами и т. д.
Максимально
заполненные орбитали наиболее устойчивы.
Электронные слои, орбитали которых
заполнены максимально называются
завершенными. Внешний электронный слой
является завершенным, если он имеет
электронную конфигурацию
![]() (Для атомов водорода и гелия завершенным
является их единственный слой с
конфигурацией
(Для атомов водорода и гелия завершенным
является их единственный слой с
конфигурацией
![]() ).
).
Атомы инертных элементов (He, Ne, Ar, Kr, Xe, Rn) имеют завершенные внешние электронные слои и поэтому с трудом вступают в реакцию.
У атомов металлов во внешнем слое, как правило, содержится меньше четырех электронов, и они слабо связаны с атомом. Атомы металлов, вступая в химическую связь, теряют валентные электроны. Способность элемента отдавать электроны можно принять за меру металличности. Для сравнения металлических свойств элементов обычно используют специальную величину – энергию ионизации.
Энергия ионизации – это количество энергии, необходимое для отрыва наиболее слабо связанного электрона от атома.
Щелочные
металлы имеют самые низкие энергии
ионизации. Надо иметь в виду, что у атомов
элементов IA группы во внешнем слое
находится один s-электрон. С увеличением
порядкового номера элемента радиус
атомов и число электронных слоев
увеличивается. При этом притяжение
внешних электронов к ядру ослабевает,
энергия ионизации уменьшается. Самыми
малыми значениями энергии ионизации
обладают цезий Cs (![]() )
– 3.89 эВ и франций Fr
-3,83 эВ.
)
– 3.89 эВ и франций Fr
-3,83 эВ.
У атомов неметаллов во внешнем электронном слое содержится четыре и больше электронов, которые прочно связаны с атомом. Атомы неметаллов, вступая в химическую реакцию, обычно присоединяют электроны. Для сравнения неметаллических свойств используют специальную величину – сродство к электрону.
Сродство к электрону – это количество энергии, которое выделяется или поглощается при присоединении одного электрона к нейтральному атому. Неметаллические свойства наиболее сильно выражены у фтора.
Вещество,
которое приобретает электроны, часто
называют окислителем.
Количественной характеристикой
окисляющей способности атомно-молекулярной
частицы также служит сродство
к электрону.
Величина сродства к электрону в этом
случае это минимальная энергия,
необходимая для удаления электрона из
соответствующего отрицательного иона
![]() на бесконечность. Сродство к электрону
(А) определяет окислительную способность
частицы Х: чем больше А, тем более сильным
окислителем является молекула (радикал,
ион).
на бесконечность. Сродство к электрону
(А) определяет окислительную способность
частицы Х: чем больше А, тем более сильным
окислителем является молекула (радикал,
ион).
Молекулярный
кислород, которым мы дышим, имеет А=0,44
эВ. Для перекиси водорода или озона, под
действием которых разрушаются дерево,
металлы и гибнет все живое, А= 2эВ. Самый
сильный из всех окислителей – гексафторид
платины у которого А=7 эВ. Гексафторид
платины
![]() так силен, что окисляет даже «инертные»
газы – ксенон и криптон.
так силен, что окисляет даже «инертные»
газы – ксенон и криптон.
Способность атомов химического элемента притягивать к себе общие электронные пары называется электроотрицательностью. Электроотрицательность элемента определяется суммой его энергии ионизации и сродства к электрону. Чем больше электроотрицательность атома, тем сильнее притягивает он общую электронную пару.
Задание 5.
Получите, используя имеющиеся интерактивные таблицы Менделеева, следующие данные.
А) Используя Интернет- ресурс (находящийся в папке) и интерактивную таблицу (Periodic Table) представьте сведения о строении орбиталей атомов водорода, гелия, атомов элементов Li, Be, C, N, O, F, Ne.
Б) Используя Интернет- ресурс (находящийся в папке) и интерактивную таблицу (Periodic Table) для калия, меди, алюминия, серебра, цезия, золота, франция представьте в виде таблицы 1 сведения об энергии ионизации химического элемента, то есть о количество энергии, необходимое для отрыва наиболее слабо связанного электрона от атома.
Таблица1
Nп/п |
Элемент |
Энергия ионизации, эВ |
Энергия ионизации, кДж/моль |
1 |
Калий К |
|
|
2 |
|
|
|
|
|
|
|
|
|
|
|
В) Используя Интернет- ресурс (находящийся в папке) и интерактивную таблицу (Periodic Table) для калия, меди, алюминия, серебра, фтора, хлора, брома представьте в виде таблицы 3 сведения о электроотрицательности, то есть способности атомов химического элемента притягивать к себе общие электронные пары.
Таблица 3
Nп/п |
Элемент |
Сродство к электрону, эВ/атом |
Сродство к электрону, кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Г) Используя Интернет- ресурс (находящийся в папке) и интерактивную таблицу (Periodic Table) для фтора, хлора, брома представьте в виде таблицы 2 сведения о сродстве химического элемента к электрону, то есть о количестве энергии, которая выделяется или поглощается при присоединении одного электрона к нейтральному атому.
Таблица2
Nп/п |
Элемент |
Сродство к электрону, эВ/атом |
Сродство к электрону, кДж/моль |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Эксперимент 5. Изучение основных понятий, связанных с тем, как образуются химические связи между элементами.
Задание 6.
1. Кратко опишите, что представляет в современном понимании такая сущность, как химическая связь
2. Кратко сформулируйте, какие бывают виды химической связи и чем они принципиально отличаются друг от друга
3. Кратко опишите, какие образуются при перекрытии орбиталей виды ковалентных связей
4. Кратко сформулируйте, что представляет собой такая сущность, как бензольное кольцо.
