
- •Модуль 1. Естественнонаучные основы представлений об окружающей действительности
- •Тема 4. Основы современных концепций микро- и наномира Лабораторная работа № 4
- •4.1.1. Цели работы
- •4.2.1. Самостоятельная работа студентов
- •4.3.1. Средства и способы проведения эксперимента
- •4.4.1. Порядок выполнения работы
- •1.1. Теоретические предпосылки, позволяющие понять, как развивались представления об атоме
- •1.2. Теоретические предпосылки, позволяющие понять, как в настоящее время характеризуют состояния электронов в атоме
- •2.2. Теоретические предпосылки, позволяющие рассчитывать энергии
- •2.3. Теоретические предпосылки, позволяющие понять, чем важен озон для жизни на земле
- •4.1. Теоретические предпосылки, позволяющие понять связь строения атома от его положения в таблице Менделеева
- •5.1. Теоретические предпосылки, позволяющие понять, как образуются химические связи между элементами
- •6.1. Теоретические предпосылки, позволяющие понять, от чего зависят электрические свойства твердых тел
- •7.1. Теоретические предпосылки, позволяющие понять, от чего зависят электрические свойства полупроводниковых материалов, используемых в современной электронике и микроэлектронике
- •Распределение электронов по орбитам атомов
- •Ширина запрещенной зоны основных полупроводников
- •Концентрация собственных носителей заряда
- •Фрагмент периодической таблицы элементов д.И. Менделеева
- •Подвижности носителей заряда полупроводников
- •Подвижности носителей заряда полупроводников
- •7.2. Теоретические предпосылки
- •7.3. Теоретические предпосылки
- •8.1. Теоретические предпосылки, позволяющие понять, что такое аллотропные формы веществ
- •Итак, если подвести итого, то возможные применения нанотрубок следующие
- •9.1. Теоретические предпосылки
- •10.1. Теоретические предпосылки о супрамолекулярной химии
2.2. Теоретические предпосылки, позволяющие рассчитывать энергии
Полная энергия электрона (то есть состоящая из его кинетической и потенциальной энергии) на орбиталях, характеризуемых главным квантовым числом , определяется формулой
,
где =9,11х10-31 кг – масса электрона;
=1,602х10-19 Кл – элементарный электрический заряд;
- порядковый номер главного квантового числа;
=8,854х10-12 Ф/м – электрическая постоянная;
=6.626х10-34 Джс – постоянная Планка.
Обратите внимание на то, что определенное в системе СИ значение энергии на фигуре 1, выраженное в джоулях, обычно оказывается достаточно малым. Поскольку, говоря об атомах, приходится иметь дело именно с такими энергиями, то уступая естественному человеческому желанию пользоваться числами в пределах от 0,1 до 100, часто отказываются от использования единиц энергии, установленных системой СИ. Вместо джоулей используют электрон-вольт – единицу, численно равную энергии, которую приобретает электрон под действием разности потенциалов 1 В (вольт). То есть используют
1 эВ=1,6х10-19 Дж.
Подставив все необходимые константы можем записать
![]() .
.
Обратите внимание, что на графиках за нулевой уровень энергии принимается уровень энергии на бесконечном удалении от ядра атома (это достоверно установленный на основе экспериментальных исследований уровень, который характеризуется энергией -2,18х10-18 Дж или -13,6 эВ). Знак минус в значении энергии, означает, что энергия этого уровня ниже того, что принят за нулевой. Отрицательные значения энергии электрона убывают по абсолютной величине и можно считать, что энергетические уровни повышаются. Следовательно, с увеличением номера главного квантового числа, когда увеличивается радиус орбитали и электрон «удаляется» от ядра, его энергетический уровень повышается.
Следует также иметь в виду, что при электрон в атоме водорода обладает наименьшей энергией. Это соответствует так называемому основному состоянию атома, то есть такому состоянию, когда он не подвергается никаким внешним воздействиям. Остальные уровни энергии называются возбужденными. Возбуждение атома, то есть «переход» электрона в состояние, которое характеризуется большим квантовым числом (переход на орбиталь с большим радиусом), требует сообщения ему дополнительной энергии и, следовательно, происходит в результате каких-либо внешних воздействий (к примеру, за счет теплового воздействия).
Состояние 1s – основное. В этом состоянии атом имеет минимальную энергию. Чтобы перевести атом в одно из возбужденных состояний, ему надо сообщить энергию. Это можно осуществить за счет теплового удара (соударения с другим атомом в нагретом газе), за счет электронного удара (например, в электрическом разряде) или за счет поглощения атомом фотона.
Характерное время жизни атома в возбужденном состоянии составляет 10-8 с. Далее происходит спонтанный переход в одно из нижележащих состояний. Переход атома из состояния 2 в состояние 1 будет сопровождаться излучением кванта с энергией
hν = W2 - W1,
где W2 и W1 - энергии соответствующих состояний.
В квантовой механике доказывается, что возможны только такие переходы, при которых орбитальное квантовое число l меняется на единицу. Говорят, квантовое число l имеет правило отбора Δl = ±1. Это правило есть следствие закона сохранения момента количества движения. Изменение главного квантового числа n может быть любое. Возможные переходы показаны на схеме уровней.

Рис. 11а. Схема перехода электронов атома в основное состояние из возбужденного состояния.
Обратите внимание на следующее.
1. Возбужденное состояние атома неустойчиво
и примерно за время 10-8 секунды
электрон возвращается в основное
состояние (на основную орбиталь). При
этом он излучает порцию энергии (фотон
с энергией
![]() ),
равную той, которая была получена при
возбуждении.
),
равную той, которая была получена при
возбуждении.
2. Электрон может возвращаться на основную
орбиталь не единым переходом, а через
промежуточные уровни. В этом случае при
переходе будут излучаться несколько
фотонов с энергиями![]() и
и
![]() ,
равными разности энергий этих уровней.
,
равными разности энергий этих уровней.
Заметим,
что существуют два способа задать
частоту излучения: как круговую и как
циклическую. Соответствующие значения
частоты (обозначим их как
![]() и
и
![]() ).
Они различаются множителем 2π:
).
Они различаются множителем 2π:
![]() .
Помимо частоты излучения, можно
использовать такое понятие, как длина
волны -
.
Помимо частоты излучения, можно
использовать такое понятие, как длина
волны -
![]() ,
где с=108
м/с – скорость света. Длины волн измеряют
в нанометрах (1нм = 10-9
м)
или микрометрах (1мкм = 10-6
м,
микрон), а также ангстремах (1Å = 0.1 нм =
10-10
м).
,
где с=108
м/с – скорость света. Длины волн измеряют
в нанометрах (1нм = 10-9
м)
или микрометрах (1мкм = 10-6
м,
микрон), а также ангстремах (1Å = 0.1 нм =
10-10
м).
Возбужденный атом водорода в метастабильном состоянии 2s существует ~2 мс. Благодаря значительному времени жизни метастабильные атомы могут накапливаться до относительно высоких концентраций 1012 - 1014 см-3, оставаясь возбужденными. Снятие возбуждений в таких системах происходит вследствие межатомных столкновений и может затягиваться на макроскопические времена.
При комнатной температуре практически все атомы водорода находятся в основном состоянии, так как для перевода атома в первое возбужденное состояние требуется затратить энергию порядка 10.2 эВ, а тепловая энергия kT имеет порядок 10-2 эВ.
Введите в командное окно MATLAB програму 1.
Програма 1.
clear;
n=linspace(1,10,10);
disp( 'Величина энергии в джоулях')
disp( 'в зависимости от квантового числа')
Wn=-2.17991e-18./(n.*n)
bar(Wn)
disp( 'Величина энергии в электрон-вольтах')
disp( 'в зависимости от квантового числа')
figure
Wewn=-13.6058./(n.*n)
bar(Wewn)
Задание 3.
2. Изучите, используя
квантовомеханическую модель атома
водорода, какая испускается порция
энергии и какой частоты будет излучение
при переходе электрона с орбитали,
характеризуемой главным квантовым
числом
,
(более удаленной от ядра), на более
близкую к ядру орбиталь
.
Возьмите
![]() , а
, а
![]() .
.
Сделайте выводы о том, в какой диапазоне оптического излучения (ультрафиолетовом, видимом, инфракрасном) будет излучение.
При переходе электрона с орбитали,
характеризуемой главным квантовым
числом
,
(более удаленной от ядра), на более
близкую к ядру орбиталь
испускается порция энергии
![]() :
:
![]() .
.
Соответственно частота излучения в герцах будет
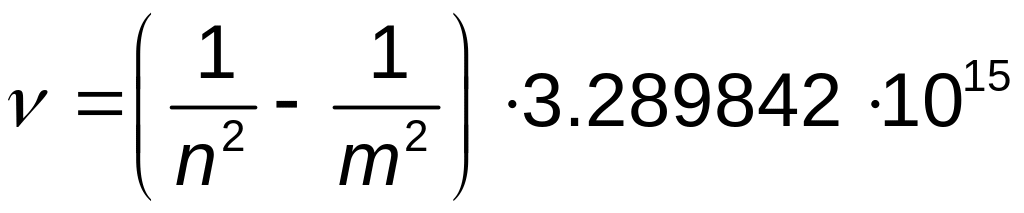 .
.
Если , то все получаемые при излучении частоты, находящиеся в ультрафиолетовой области спектра будут составлять так называемую серию Лаймана. Если , то все получаемые при этом частоты излучений видимого диапазона будут составлять так называемую серию Бальмера.
Введите в командное окно MATLAB програму 2.
Програма 2.
clear;
n1=linspace(1,5,5);
Wn1=-13.6058./(n1.*n1);
bar(Wn1)
disp( 'Серия Лаймана')
disp( 'Номера главных квантовых чисел')
n=1
m=5 %Значения от 2 до 5
disp( 'Испускаемая энергия')
DeltaWn=-13.6058*(1/(n*n)-1/(m*m))
disp( 'Длина волны, в нанометрах')
nuj=3.289842e15*((1/(n*n))-(1/(m*m)));
lambda=3e17/nuj
disp( 'Диапазон оптического излучения:')
disp( ' Ультрафиолетовый ')
Задание 4.
3. Изучите, используя квантовомеханическую модель атома, почему уменьшение в стратосфере содержания озона составляет в настоящее время одну из наиболее острых проблем глобальной экологии. Сформулируйте кратко, почему уменьшение или исчезновение озона в стратосфере создает серьезную угрозу
