
- •Модуль 1. Естественнонаучные основы представлений об окружающей действительности
- •Тема 4. Основы современных концепций микро- и наномира Лабораторная работа № 4
- •4.1.1. Цели работы
- •4.2.1. Самостоятельная работа студентов
- •4.3.1. Средства и способы проведения эксперимента
- •4.4.1. Порядок выполнения работы
- •1.1. Теоретические предпосылки, позволяющие понять, как развивались представления об атоме
- •1.2. Теоретические предпосылки, позволяющие понять, как в настоящее время характеризуют состояния электронов в атоме
- •2.2. Теоретические предпосылки, позволяющие рассчитывать энергии
- •2.3. Теоретические предпосылки, позволяющие понять, чем важен озон для жизни на земле
- •4.1. Теоретические предпосылки, позволяющие понять связь строения атома от его положения в таблице Менделеева
- •5.1. Теоретические предпосылки, позволяющие понять, как образуются химические связи между элементами
- •6.1. Теоретические предпосылки, позволяющие понять, от чего зависят электрические свойства твердых тел
- •7.1. Теоретические предпосылки, позволяющие понять, от чего зависят электрические свойства полупроводниковых материалов, используемых в современной электронике и микроэлектронике
- •Распределение электронов по орбитам атомов
- •Ширина запрещенной зоны основных полупроводников
- •Концентрация собственных носителей заряда
- •Фрагмент периодической таблицы элементов д.И. Менделеева
- •Подвижности носителей заряда полупроводников
- •Подвижности носителей заряда полупроводников
- •7.2. Теоретические предпосылки
- •7.3. Теоретические предпосылки
- •8.1. Теоретические предпосылки, позволяющие понять, что такое аллотропные формы веществ
- •Итак, если подвести итого, то возможные применения нанотрубок следующие
- •9.1. Теоретические предпосылки
- •10.1. Теоретические предпосылки о супрамолекулярной химии
5.1. Теоретические предпосылки, позволяющие понять, как образуются химические связи между элементами
Мы уже изучили, что электрон и ядро атома (протон) могут объединяться в атом водорода. Мы выяснили, что электрон в атоме водорода вблизи ядра обладает меньшей энергией, чем на бесконечном удалении от него (этот уровень энергии принят за нуль). В «поисках минимума энергии» электрон «стремится» быть «ближе» к ядру.
Применительно к атомам водорода можно говорить о том, что они стремятся «сблизится» для того, чтобы уменьшить суммарную энергию. Они сближаются и в результате образуют молекулу водорода. Такое объединение атомов называют химической связью. Изучает химические связи наука химия.
Резонно спросить, а надо ли, чтобы понять «электрические» свойства веществ и газов, изучать вопросы, касающиеся вроде бы химии, в других науках? Да надо! Дело в том, что химия – это в некотором смысле одна из ветвей науки об электрических свойствах материалов. По этой причине мы попытаемся выяснить этот же вопрос применительно с «соединениям» одинаковых и разных атомов.
Химическую связь можно объяснить, только опираясь на электрические свойства атомов, из которых состоит вещество, и на некоторые квантовые явления. Понимание химической связи в настоящее время является очень важным для многих отраслей науки. Например, для металлургии. Если большое число атомов, собравшись вместе, образуют твердое тело, то причину этого можно искать в особенностях поведения электронов. И не случайно, что все механические свойства твердых тел, включая твердость и высокую прочность, имеют свое «начало» в электрических свойствах тех компонентов, из которых они состоят. Поэтому, чтобы двигаться вперед, нам необходимо понять природу химической связи.
Химическая связь – это взаимодействие двух и нескольких атомов, в результате которого образуется химически устойчивая двух- или многоатомная система (например, молекула или кристалл).
Электронная теория строения атомов объясняет, как атомы соединяются в молекулы, то есть механизм образования химической связи, а также истолковывает, как происходит разложение двух- или многоатомных молекул, когда химические связи рвутся (разрушаются).
В основе теории химической связи лежат представления об электронных взаимодействиях. Наиболее устойчивыми (прочными) группировками электронов являются завершенные внешние электронные слои атомов инертных элементов. Незавершенные внешние электронные слои всех элементов являются неустойчивыми группировками электронов. При соединении атомов с незавершенными внешними электронными слоями происходит перестройка их электронных оболочек: непарные электроны с антипараллельными (противоположными) спинами различных атомов образуют общие электронные пары. При этом основными типами химической связи являются ионная, ковалентная, металлическая и водородная.
А. Ионная связь.
Атомы, стоящие в периодической системе Менделеева вблизи инертных газов, сравнительно легко могут образовывать конфигурацию их электронных оболочек, которая позволяет принимать электроны. К примеру, у галогенов, стоящих непосредственно перед инертными газами, недостает одного электрона для образования устойчивой электронной оболочки, поэтому они обладают высоким сродством к электрону (порядка 3 эВ). В то же время у атомов щелочных металлов, валентный электрон «находится» на не заполненной оболочке, связан с ядром относительно слабо, вследствие чего энергия ионизации этих атомов мала.
При образовании соединений из элементов, очень отличающихся по наличию электронов на внешней оболочке (типичных металлов и неметаллов, галогенов), электрон от атома металла переходит к атому галоида. При этом атом металла превращается в положительно заряженный ион (катион), а атом галогена – в отрицательно заряженный ион (анион). Ионы взаимодействуют по закону Кулона, как два разноименных заряда.
Например,
при горении натрия в хлоре неспаренный
3s-электрон атома натрия спаривается с
3p- электроном атома хлора. Общая
электронная пара полностью смещается
к атому хлора. В результате образуется
натрий-ион (катион)
![]() и хлорид –ион (анион)
и хлорид –ион (анион)
![]() .
.
Заряженные частицы, в которые превращаются атомы в результате отдачи или присоединения электронов, называют ионами. Соединения, которые образуются из ионов, называют ионными. Химическая связь между ионами называется ионной.
Следует обратить внимание, что на рис. 13 в виде совокупности находящихся в определенных точках пространства тел показан вспомогательный геометрический образ, вводимый для анализа строения вещества, который называют кристаллической решёткой. Решётка имеет сходство с канвой или сеткой, что даёт основание называть точки решётки узлами. Поскольку речь идет об ионной химической связи, то показанная на рис. 13 решетка называется ионной.
Ионная связь (взаимодействие за счет электростатической притяжения ионов по закону Кулона) – это сильная связь с энергией от сотен до тысяч килоджоулей на моль. Поэтому твердые тела с ионной связью обладают значительной прочностью и твердостью, имеют высокие температуры плавления. Вещества с ионной связью не летучи. Многие ионные кристаллы прозрачны в широком диапазоне длин волн.
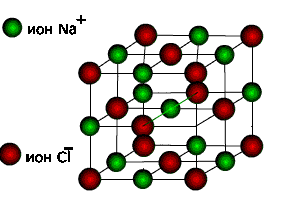
Рис. 13. Изображение расположения в узлах решетки ионов натрия и хлора при ионной химической связи
Б. Ковалентная связь.
В этом случае притяжение атомов происходит за счет обменного взаимодействия между неспаренными электронами соседних атомов (электроны внешних незаполненных оболочек стремятся образовать единую оболочку молекулы). Ковалентная связь, является результатом электронно-ядерных взаимодействий в веществе, характеризуемых направленностью и насыщаемостью.
Вам известно, что электронные орбитали (кроме s-орбиталей) имеют пространственную направленность. Так называемые волновые функции электрона, или орбитали, «ориентированы» вдоль осей X, Y, Z, так, что области максимальной вероятности обнаружения электронов в состояниях имеют вид вытянутых «лепестков» (рис.5, рис.6). Несложно предположить, что образование химической связи происходит более эффективно, если орбитали двух электронов, участвующих в обмене, «вытянуты» в одном и том же направлении навстречу друг другу. Ковалентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака, соответствующего валентным электронам. При этом осуществляется перекрытие облаков связующих электронов. Это и означает, что ковалентная связь имеет направленный характер, который играет важную роль в определении пространственного расположения атомов в решетке и для результата электронно-ядерных взаимодействий.
Насыщаемость состоит в том, что каждый атом способен образовывать ковалентную связь лишь с определенным числом соседей. Насыщение- это способность каждой связи обеспечивать притяжение не более двух электронов.
Если
атомы характеризуются орбиталью в виде
«лепестка», то при их сближении и
образовании молекулы электронные облака
могут перекрываться в направлении
прямой (оси координат), которая соединяет
ядра атомов (то есть по оси связи). Такая
ковалентная связь называется
![]() -связью
(сигма –связью).
При образовании такой химической связи
всегда происходит сдвиг электронной
плотности в направлении перекрывания,
а это приводит к изменению
формы орбиталей
по сравнению с их состоянием в свободном
атоме.
-связью
(сигма –связью).
При образовании такой химической связи
всегда происходит сдвиг электронной
плотности в направлении перекрывания,
а это приводит к изменению
формы орбиталей
по сравнению с их состоянием в свободном
атоме.
Например, атомы соединяются ковалентной σ-связью в молекулах Н2, HCl, Cl2 . Ковалентные σ-связи образуются при перекрывании орбиталей: s-s (H2), p-p (Cl2), s-p (HCl). Ковалентная связь между атомами образуется при перекрывании атомных орбиталей, например 1s-орбиталей при образовании связи H−H, 2p-орбиталей при образовании связи Cl- Cl, 1s-орбитали атома H и 3p-орбитали атома Cl при образовании связи H−Cl (рис.14).
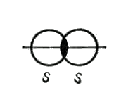
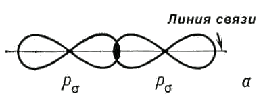
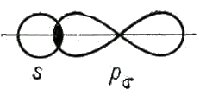
Рис. 14а. Схематическое изображение σ-связи в молекулах водорода, хлора, хлороводорода
Заметим, что в случае перекрытия частота обмена соседних атомов электронами увеличивается настолько, что теряет смысл говорить о принадлежности электрона 1 атому А и электрона 2 атому В. Это соответствует возникновению нового состояния, не свойственного системе, образованной двумя изолированными атомами. Оно замечательно тем, что электроны в этом состоянии принадлежат обеим ядрам, или, как говорят, обобществлены. Обобществление электронов сопровождается перераспределением электронной плотности и изменением энергии системы по сравнению с суммарной энергией изолированных атомов. Появление состояния с повышенной плотностью электронного облака, заполняющего межъядерное пространство, вызывает всегда уменьшение энергии системы и приводит к возникновению сил притяжения. Образно говоря, электронное облако повышенной плотности, которое образуется в межъядерном пространстве обобществленной парой электронов, как бы стягивает ядра, стремясь максимально их приблизить друг к другу.
При
перекрытии р-орбиталей, направленных
перпендикулярно оси связи, образуются
две области перекрывания по обе стороны
оси связи. Такая ковалентная связь
называется
![]() -
связью (пи – связью).
Следует иметь в виду, что из-за большего
взаимного удаления областей «перекрывания»
-
связь оказывается более слабой.
-
связью (пи – связью).
Следует иметь в виду, что из-за большего
взаимного удаления областей «перекрывания»
-
связь оказывается более слабой.
В общем случае могут образовываться несколько различных связей. Например, молекулы в атоме азота связаны одной -связью и двумя - связями.
Число общих электронных пар, которые связывают атомы, характеризует кратность ковалентной связи. Связь между двумя атомами при помощи одной электронной пары электронов называется простой. Связь между двумя атомами при помощи двух электронных пар называется двойной. Связь между двумя атомами при помощи трех электронных пар называется тройной. Например, двойная связь имеет место между атомами углерода в этилене, тройная связь наблюдается в молекулах азота, ацетилена.
Также надо иметь в виду, что процесс образования ковалентной связи характеризуется пространственной структурой (то есть определенной формой в пространстве). Перекрывание атомных орбиталей при формировании двухатомных молекул АВ (А и В - атомы одного или разных элементов) может приводить не только к линейной геометрической форме молекул (Н−Н, F−F, H−Cl). Образование ковалентных химических связей в многоатомных молекулах может приводить к изменению расположения орбиталей в пространстве (не в линию, а под различными углами). Кроме того при образовании молекул, как в 1931 году показал американский химик Л. Полинг, может происходить процесс гибридизации или, образования орбиталей - гибридов у центрального атома А.
Когда атом углерода участвует в образовании химических связей его одна s-орбиталь и три р-орбитали (рис.14) могут объединяться, образуя новые орбитали, представляющие собой гибриды исходных орбиталей.
Надо иметь в виду, что чем больше электроотрицательность атома, тем сильнее он притягивает общую электронную пару. Когда между двумя атомами разных элементов образуется ковалентная связь, общие электронные пары смещаются к более электроотрицательному атому.
В
частности, при образовании С-Н связей
в метане
![]() участвуют гибридные орбитали грушевидной
формы, обозначающиеся символами
участвуют гибридные орбитали грушевидной
формы, обозначающиеся символами
![]() .
Получившиеся орбитали - гибриды одинаковы
по форме и внешне напоминают асимметричные
объемные восьмерки (рис. 14). Вытянутая
форма орбиталей обеспечивает более
сильное перекрытие с орбиталями
присоединяющихся к углерода атомов и
тем самым стабилизирует молекулу.
.
Получившиеся орбитали - гибриды одинаковы
по форме и внешне напоминают асимметричные
объемные восьмерки (рис. 14). Вытянутая
форма орбиталей обеспечивает более
сильное перекрытие с орбиталями
присоединяющихся к углерода атомов и
тем самым стабилизирует молекулу.

Рис. 14б. Схематическое изображение формы одной из четырех гибридных орбиталей атома углерода
Взаимодействие атома углерода с четырьмя атомами водорода (рис.15) сопровождается взаимным перекрыванием вытянутых гибридных орбиталей углерода со сферическими орбиталями водорода.
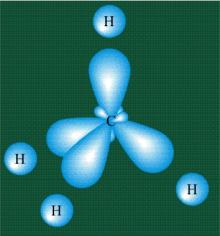
Рис. 14с. Схематическое изображение возможного взаимодействия гибридных орбиталей атома углерода и s- орбиталей водорода в молекуле метана
На каждой орбитали находится по одному электрону, в результате перекрывания каждая пара электронов начинает перемещаться по объединенной – молекулярной орбитали. Гибридизация приводит к изменению формы орбиталей внутри одного атома, а перекрывание орбиталей двух атомов (гибридных или обычных) приводит к образованию химической связи между ними. В результате, гибридные орбитали , перекрываясь с s-орбиталями четырех атомов водорода образуют прочную тетраэдрическую молекулу метана с четырмя - связями, направленными под углом 109 градусов. Четыре валентных электрона углерода располагаются на гибридных орбиталях так, что вся «конструкция» оказывается как бы вписанной в правильный тетраэдр. При этом орбитали-гибриды располагаются вдоль осей такого тетраэдра, угол между любыми двумя осями – 109° (рис.15).
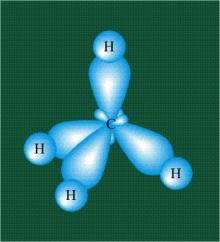
Рис. 15. Схематическое изображение образовавшейся химической связи в молекуле метана за счет гибридных орбиталей атома углерода и s- орбиталей водорода
Таким образом, структура молекулы метана определяется геометрией гибридных орбиталей углерода и водорода. Свойства электронов, разместившихся на четырех одинаковых орбиталях, эквивалентны, соответственно, будут эквивалентны химические связи, образованные с участием этих электронов при взаимодействии с атомами одного типа. Кратность химической связи, определяемая числом общих электронных пар, которые связывают атомы, одинарная.
В традиционном написании структуры образовавшегося метана вместо перекрывающихся орбиталей используют символ валентной черты. При объемном изображении структуры молекулу метана можно представить в виде, показанном на рис.16.
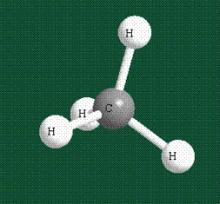
Рис. 16. Объемное изображение образовавшейся химической связи в молекуле метана
Образование
молекулы этана аналогично описанному
выше процессу. Отличие состоит в том,
что молекула этана
![]() (рис.17) содержит семь σ- связей: одна
связь
(рис.17) содержит семь σ- связей: одна
связь
![]() (С-С)
и шесть
(С-С)
и шесть
![]() (С-Н)
(С-Н)
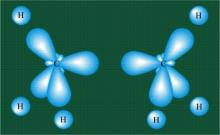
Рис. 17. Схематическое изображение возможного взаимодействия гибридных орбиталей атома углерода и s- орбиталей водорода в молекуле метана
Геометрия молекулы этана напоминает метан, валентные углы 109°, что определяется пространственным расположением гибридных орбиталей углерода (рис.18).
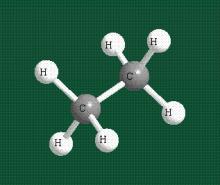
Рис. 18. Объемное изображение образовавшейся химической связи в молекуле этана
Молекула этилена
![]() (рис.19) образована также с участием
орбиталей-гибридов.
(рис.19) образована также с участием
орбиталей-гибридов.
Два атома углерода присоединяют четыре атома водорода, а также соединяются между собой. При этом имеет место двойная связь атомов углерода. Каждый атом углерода имеет три (рис.19) равноценные σ- связи: одну друг с другом и две с атомами Н. В гибридизации участвуют одна s-орбиталь и только две р-орбитали (рх и ру), третья орбиталь – pz, направленная вдоль оси z, в образовании гибридов не участвует. Из исходных трех орбиталей возникают три гибридных орбитали, которые располагаются в одной плоскости, образуя трехлучевую звезду, углы между осями – 120 (рис. 21, 22)

Рис. 19. Схематическое изображение возможного взаимодействия гибридных орбиталей атома углерода в молекуле этана
Две орбитали pz, не участвовавшие в гибридизации, тоже взаимоперекрываются. Но их геометрия такова, что перекрывание происходит не по линии связи С-С, а выше и ниже ее (рис.20). В результате образуются две области с повышенной электронной плотностью, где помещаются два электрона, участвующие в образовании этой связи. Таким образом, в молекуле этилена образуется одна молекулярная орбиталь, состоящая из двух областей, разделенных в пространстве. Связь, у которой максимальная электронная плотность расположена вне линии, связывающей два атома, называют -связью.
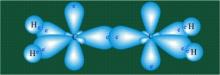
Рис. 20. Схематическое изображение образовавшейся химической связи в молекуле этилена за счет σ- связи (s-орбиталь и две р-орбитали рх и ру) и -связи двух орбиталей pz
В этилене между атомами углерода наблюдается двойная связь (кратность 2).
Таким образом, вторая валентная черта в обозначении двойной связи, широко используемая для изображения ненасыщенных соединений уже не одно столетие, в современном понимании подразумевает наличие двух областей с повышенной электронной плотностью, расположенных по разные стороны линии связи С-С.

Рис. 21. Объемное изображение образовавшейся химической связи в молекуле этилена
У
бензола
![]() остов молекулы собран из атомов углерода
(рис. 22), имеющих гибридные орбитали,
составленные из одной s-
и двух р-орбиталей,
расположенные в форме трехлучевой
звезды (как у этилена).
остов молекулы собран из атомов углерода
(рис. 22), имеющих гибридные орбитали,
составленные из одной s-
и двух р-орбиталей,
расположенные в форме трехлучевой
звезды (как у этилена).

Рис. 22. Схематическое изображение орбиталей атома бензола (р-орбитали, не участвующие в гибридизации, показаны полупрозрачными)
Шесть оставшихся р-орбиталей взаимоперекрываются, образуя молекулярную орбиталь в виде двух кольцевых областей, над и под плоскостью бензольного цикла (рис.23).
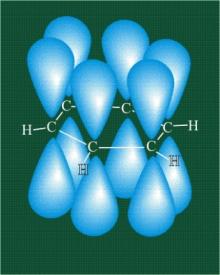
Рис. 23. Схематическое изображение образования кольцевой р-связи в молекуле бензола
Молекула бензола плоская, что задано плоской конфигурацией «трехлучевых звезд», из которых она собрана. Молекулярную орбиталь, образованную перекрыванием шести атомных р-орбиталей обозначают в виде кольцевого символа внутри бензольного цикла (рис. 24).
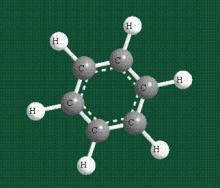
Рис. 25. Объемное изображение образовавшейся химической связи в молекуле бензола
Таким образом, при ковалентной химической связи, основываясь на электронных формулах двух и многоатомных частиц (молекул), можно определить валентность каждого атома. С точки зрения строения молекул валентность атома в сложной частице - это число общих электронных пар у этого атома в данной частице (по одной на каждую связь), то есть число σ-связей, которые этот атом образовал с другими атомами при формировании сложной частицы.
Отметим, что ковалентная связь, имеющая направленный характер, играет большую роль для пространственного расположения атомов в кристаллической решетке твердых тел.
Типичным примером кристаллических структур с ковалентной связью является алмаз (рис.26).
Кристаллическая решетка — кубическая гранецентрированная (рис.27). Атомы углерода в алмазе находятся в состоянии sp³-гибридизации. Каждый атом углерода в структуре алмаза расположен в центре тетраэдра, вершинами которого служат четыре ближайших атома. Именно прочная связь атомов углерода объясняет высокую твёрдость алмаза.
Такую кристаллическую решетку имеют и другие химические элементы подгруппы IVB таблицы Менделеева – кремний, германий, серое олово. Атомы этих элементов имеют четыре валентных электрона, которые обобществляются с электронами четырех соседних атомов.

Рис. 26. Фотография алмаза (от др.-греч. ἀδάμας — «несокрушимый»). Алмаз обладает среди минералов высочайшей твёрдостью, наиболее высокой теплопроводностью [900—2300 Вт/(м·К)], большим показателем преломления (средний показатель преломления бесцветных кристаллов алмаза в жёлтом цвете равен примерно 2,417). Большой показатель преломления, наряду с высокой прозрачностью, делает алмаз одним из самых дорогих драгоценных камней (наряду с изумрудом и рубином). Алмаз в естественном виде не считается красивым. Красоту придаёт алмазу огранка, создающая условия для многократных внутренних отражений (игры цвета). Огранённый алмаз называется бриллиантом.
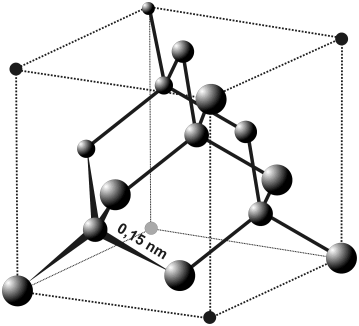
Рис. 27. Кристаллическая решетка алмаза. Обратите внимание на то, что каждый атом углерода находится в центре воображаемого куба, в вершинах которого находятся ближайшие соседи. Трубчатые соединения отображают ковалентные связи.
Энергия ковалентной связи высока - порядка сотен килоджоуль на моль. Поэтому ковалентные кристаллы обладают высокой прочностью, твердостью, имеют высокие точки плавления.
В кремнии ковалентные связи относительно слабые, поэтому при тепловых колебаниях атомов решетки от ядер могут отрываться некоторые электроны, что создает условия для протекания электрического тока. В электрическом отношении кремний и германий являются полупроводниками.
В. Молекулярная связь.
Молекулярными называют кристаллические решётки, в узлах которых располагаются молекулы (рис.29). В почти чистом виде такая связь проявляется между молекулами с насыщенными химическими связями (О2, Н2 и др.), а также между атомами инертных газов (когда оболочка заполнена и электростатических сил нет). Между любыми атомами и молекулами в таких кристаллах возникает связь Ван-дер-Ваальса. Эта сила ответственна за образование органических кристаллов. Она чрезвычайно слаба (можно показать, что эта сила убывает пропорционально седьмой степени от расстояния).
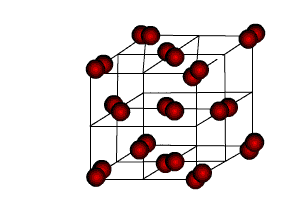
Рис. 29. Кристаллическая решётка с молекулярной связью
Связи в молекулах прочные, но между молекулами связи не прочные. Вещества с молекулярной связью имеют малую твёрдость, плавятся при низкой температуре, летучие, при обычных условиях находятся в газообразном или жидком состоянии.
Говоря о кислороде, играющем очень важную роль для жизни на Земле, заметим следующее.
Молекула кислорода может пребывать в различных активных формах: в триплетном или синглетном состоянии, в форме свободного радикала.
Основным состоянием молекулы кислорода является триплетное.
В молекуле кислорода, находящегося в триплетном состоянии, пары взаимодействующих электронов образуют атомные орбитали (АО) и две молекулярные орбитали (МО). Внутренние (остовные) АО образуют связывающую и разрыхляющую МО. На рис. 29.а самой верхней является разрыхляющая орбиталь (помечена желтой заливкой).
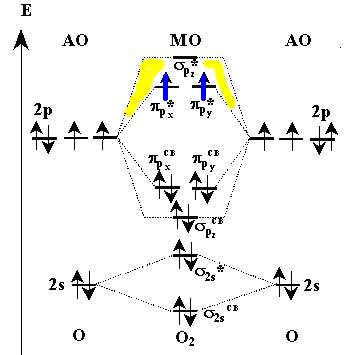
Рис. 29а. Схема триплетного состояния молекулы кислорода. На этой схеме по краям нанесены энергии атомных орбиталей (АО), а в середине - молекулярных (МО).
МО заполняются электронами в порядке возрастания их энергии. На каждой МО может находиться не более двух электронов с антипараллельными спинами (принцип Паули). Молекулярная орбиталь, образуемая двумя наборами р-орбиталей, является связующей и на ней располагаются шесть электронов (помечены черными стрелками). Оставшиеся два электрона размещаются на еще не заполненных МО. Как можно заметить, при триплетном состоянии два валентных электрона молекулы О2, находящиеся на разрыхляющих орбиталях не спарены и имеют параллельные спины (помечены синей толстой стрелкой).
Энергия диссоциации (распада) триплетного кислорода на атомы составляет 496 кДж/моль. Эта довольно большая величина служит основным фактором относительной химической инертности кислорода, а также причиной того, что кислород находится в свободном состоянии в атмосфере.
При возбуждении триплетного кислорода, например под действием света, может происходить электронная перестройка, в результате чего возникает молекула синглетного кислорода с парой электронов, принадлежащей одному из атомов кислорода – так называемый синглет. На это требуется энергия 92 кДж/моль.
Уравнение этого процесса будет иметь вид:
![]()
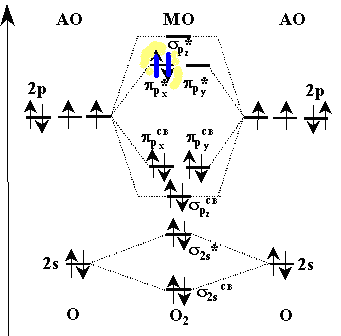
Рис. 29б. Схема синглетного состояния молекулы кислорода. На этой схеме синглет помечен желтой заливкой
Сиглетный кислород нестабилен и быстро распадается. Его среднее время жизни в атмосфере составляет 65 минут.
Синглетный кислород образуется также в воздухе, загрязненном оксидами азота, компонентами автомобильных выхлопных газов и выбросов промышленных предприятий.
Самое важное состоит в том, что синглетная форма кислорода очень химически активна. Она очень легко вступает в химические реакции. Как известно, чтобы молекулы могли прореагировать, необходимо им сообщить дополнительную энергию, либо снизить энергетический барьер, лежащий на пути превращения реагентов в продукты. Синглетная молекула кислорода может передавать свою энергию, существенно облегчая протекание химической реакции.
Заметим,
что может возникать и супероксид -
отрицательно заряженный свободный
радикал
![]() .
Это тоже чрезвычайно химически активная
форма кислорода, способная мгновенно
реагировать с окружающей молекулой и
даже с инертными частицами.
.
Это тоже чрезвычайно химически активная
форма кислорода, способная мгновенно
реагировать с окружающей молекулой и
даже с инертными частицами.
Эксперимент 6. Изучение основных электрических свойств твердых тел и показателей, которыми они характеризуются.
Задание 7.
1. Кратко опишите, на какие группы различают материалы по способности проводить ток. Назовите типичных представителей каждой из групп.
